香菇β-葡聚糖的提取及其对淀粉消化性的影响
2018-05-23陈忠秋庄海宁张劲松
陈忠秋,冯 涛,庄海宁*,杨 焱,张劲松
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.上海市农业科学院食用菌研究所,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,上海市农业遗传育种重点开放实验室,上海 201403)
香菇是一种重要的食药两用菌,不仅具有独特的香气,鲜美的味道,并且具有极高的营养价值。香菇干品的主要成分为碳水化合物(58%~60%)、蛋白质(20%~23%)、膳食纤维(9%~10%)、脂类(3%~4%)以及灰分(4%~5%)[1]。香菇被认为是药物、营养品和药妆品开发的天然来源。香菇中的β-葡聚糖被认为是最有潜力的活性成分之一。有研究表明,香菇粗多糖中含有大约27.19%的β-葡聚糖,是丰富的β-葡聚糖的来源[2]。香菇β-葡聚糖(Lentinus edodes β-glucan,LEBG)的主要成分为β-1,3-葡聚糖[3]。β-葡聚糖具有免疫活性、抗肿瘤活性[4]、放射防护性能[5]、抗氧化活性[6]和肝脏保护活性[7]。
随着人口老龄化以及人们生活习惯、饮食习惯的改变,与饮食密切相关的代谢类疾病(如糖尿病等)的发病率逐年上升。据世界卫生组织报道,全世界范围内至少有3亿人正在遭受糖尿病带来的痛苦,而中国糖尿病患者已达1亿[8]。淀粉广泛存在于食物中,其消化性会直接影响到机体的餐后血糖水平添加。根据其消化速率和程度,淀粉通常分为快速消化淀粉(rapidly digestible starch,RDS)、缓慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)[9]。加拿大学者Jenkins提出血糖指数预测值(predicted glycemic index,pGI)概念,根据其对餐后血糖的影响,将不同的富含碳水化合物的食物进行了分类[10]。因此,食品可以分为3 类:低pGI、中pGI和高pGI。研究表明SDS、RS可以提高对胰岛素的敏感性并调节身体的血糖平衡。此外,它还可以改善餐后饱腹感,减少身体的热量摄入。另外还可以防止肠道疾病、糖尿病、肥胖症等慢性疾病的发生。摄入高水平的SDS不会产生高血糖和胰岛素反应[11]。Puls等[12]从小麦中分离得到β-葡聚糖为一种α-淀粉酶抑制剂,能降低淀粉的消化速率。张宇[13]在研究燕麦β-葡聚糖对淀粉体外消化影响实验中发现,燕麦β-葡聚糖能够延缓淀粉的消化,并且随着燕麦β-葡聚糖分子质量和溶液浓度的增加,其延缓淀粉消化的效果越好,表现为慢消化淀粉增加。
在本研究中,从香菇中提取LEBG,并将LEBG添加到两种淀粉中,将其糊化后对其流变学特性进行检测,并研究LEBG对两种淀粉的体外消化的影响。本研究旨在为LEBG应用于淀粉基质食品以及降血糖食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
香菇子实体 上海百信生物科技有限公司;小麦淀粉 山东渠风食品科技有限公司;玉米淀粉 山东大宗玉米淀粉公司。
胃蛋白酶(EC 3.4.23.1,51 U/mg)、转化酶(EC 3.2.1.26,300 U/mg)、淀粉转葡糖苷酶(EC 3.2.1.3,21.1 U/mg)、α-淀粉酶(EC 3.2.1.1,19.6 U/mg)、荧光染料FITC 美国Sigma公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司;葡萄糖标准品南京建成生物工程研究所;普鲁兰标准品(shodex standard p-82) 昭和电工株式会社;苯酚、无水葡萄糖、浓硫酸、三氟乙酸、乙醇、盐酸、乙酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
电热鼓风干燥箱、电热恒温振荡水槽 上海一恒科学仪器有限公司;台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;紫外分光光度计 尤尼柯(上海)仪器有限公司;旋涡混合仪 海门市其林贝尔仪器制造有限公司;高效液相排阻色谱与多角度激光光散射分析仪、示差折光仪联用系统(high-performance sizeexclusion chromatography coupled with multi-angle laser light scattering-refractive index,HPSEC-MALLS-RI)(由Waters 2414示差检测器、Waters 2695高效液相色谱泵配以串联的凝胶色谱柱TSK PWXL6000 和TSKPWXL400、Waters 717 plus自动进样器和氦-氖激光光源的八角度激光光散射检测器组成) 美国Wyatt公司;红外光谱仪赛默飞世尔科技有限公司;共聚焦激光扫描显微镜(配备有两个空气冷却激光器Ar和He/Ne的TCS SP2 AOBS)德国Leica Microsystem Heidelberg GmbH公司。
1.3 方法
1.3.1 LEBG的提取及基本的组分测定
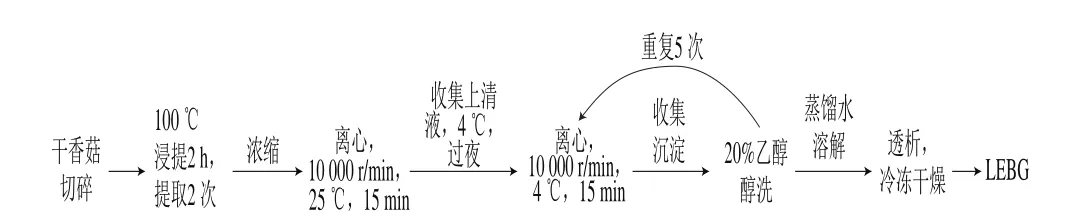
图1 LEBG的提取Fig. 1 Flow chart of LEBG extraction
参照Zhuang Haining等[14]提取β-葡聚糖的实验方法,按照图1的提取流程进行LEBG的提取,具体操作为:称取200 mg干香菇,按料液比1∶15(g/mL)加入蒸馏水,浸泡0.5 h;煮沸后100 ℃浸提2 h,滤布过滤,将滤渣进行第2次浸提,操作同上;将2 次得到的滤液混合,浓缩后,浓缩液于25 ℃、10 000 r/min离心25 min,转移上清液至烧杯,在4 ℃冰箱中存放12 h;在4 ℃、10 000 r/min离心25 min后得到部分沉淀;用20%的乙醇溶液醇洗沉淀;每次清洗后,在3 ℃、10 000 r/min离心15 min,得到离心后的沉淀;重复醇洗4~5 次,直至得到比较透明纯净的沉淀为止。醇洗后的沉淀,用蒸馏水溶解后透析3 d,将透析后的样品进行冷冻干燥,得到LEBG。
采用苯酚-硫酸法[15]、β-葡聚糖试剂盒法[16]分别对LEBG多糖含量和β-葡聚糖含量进行测定,并按照GB 5009.3—2016《食品中水分的测定》测定其水分含量,按照下式计算LEBG得率。

1.3.2 LEBG的分子质量和纯度
利用HPSEC-MALLS-RI分析多糖的分子质量分布,计算其分子质量[17]。称取5 mg样品,溶解于1 mL流动相中,流动相为含0.05 mol/L的NaH2PO4·2H2O 和0.15 mol/L的NaNO3溶液(pH 7,0.02%叠氮钠),配制成质量浓度5 mg/mL的溶液。用12 000×g离心20 min后取上清液进行HPSEC-MALLS-RI分析[18]。其中,流速为0.5 mL/min,色谱柱温用柱温箱恒定在35 ℃;激光检测器光源波长选用623.8 nm。多糖在溶液中的折光指数增量(dn/dc)按照0.146 mL/g计算。
1.3.3 LEBG单糖组成分析
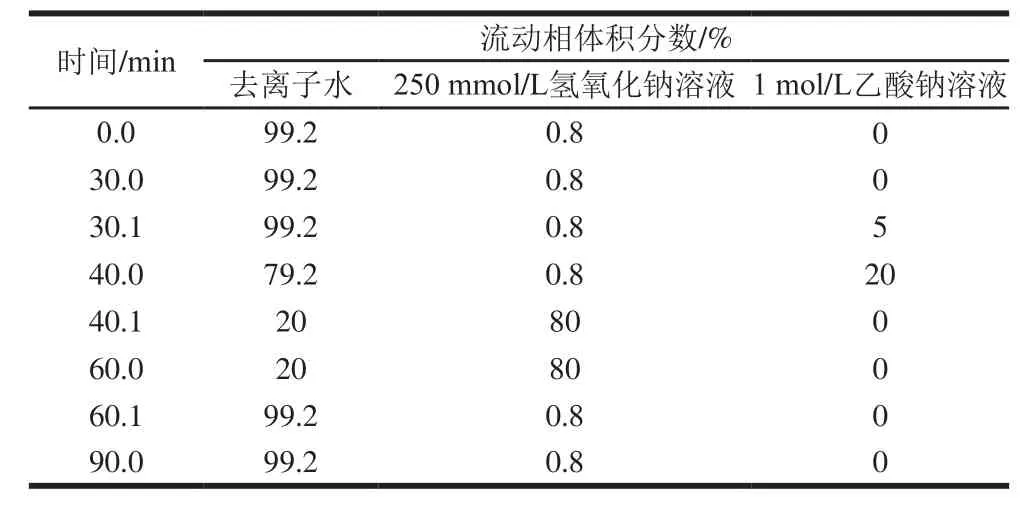
表1 高效阴离子色谱的洗脱程序Table 1 Elution program of high performance anion chromatography
精确称取3 mg LEBG样品放入耐高温具塞试管中,加入2 mol/L三氟乙酸溶液4.5 mL,将具塞试管置于110 ℃的油浴锅中水解3 h。水解后用氮吹仪吹干,待试管内的液体较少时,加入3 mL甲醇继续吹干,直至完全吹干无酸味。水解产物加入超纯水溶解,溶解后取25 μL用高效阴离子色谱测定其单糖组成和物质的量之比。标准品为葡萄糖、木糖、甘露糖、半乳糖、鼠李糖、阿拉伯糖、岩藻糖、果糖、葡萄糖醛酸和半乳糖醛酸混标[19]。
色谱条件:Dionex CarboPac PA20阴离子交换分析柱;采用脉冲安培检测器进行检测,柱温为30 ℃,流动相:去离子水、0.25 mol/L氢氧化钠和1 mol/L乙酸钠溶液,按照表1的程序进行洗脱。
1.3.4 LEBG的红外光谱
称取样品1~2 mg,进行常规红外光谱分析,扫描区间为4 000~400 cm-1[20]。
1.3.5 LEBG-淀粉的混合凝胶的动态流变学测试
1.3.5.1 混合凝胶的制备
向小麦淀粉及小麦淀粉中加入基于干质量0%和20%的LEBG,加入一定量的去离子水配制成质量分数为6%的淀粉浆[21],将各组样品置于沸水浴中进行糊化,不断搅拌避免结块直至完全糊化。
1.3.5.2 动态流变学的测定
为了测量受LEBG影响淀粉凝胶的黏弹性改变,采用TA流变仪对上述混合凝胶进行动态流变学的检测。在0.1 Hz和25 ℃条件下对0.1%~10%的形变范围扫描以测定其线性黏弹区。确定1%的形变为线性黏弹区范围内的形变值,样品的频率扫描程序在25 ℃条件下在1%的形变内从0.1~10 Hz运行[22],并记录储能模量G’和损耗模量G”以显示其黏弹性性能。
1.3.6 LEBG对淀粉体外消化的影响
1.3.6.1 制备LEBG-小麦淀粉的混合凝胶
按照总质量的0%、20%的LEBG分别替代小麦淀粉、玉米淀粉。将淀粉和LEBG的混合物(200 mg)分散在蒸馏水(2 mL)中,混匀后在95 ℃的水浴中磁力搅拌加热20 min。制备出的LEBG-淀粉混合凝胶用于淀粉消化的分析。
1.3.6.2 体外消化特性
根据Englyst方法[9]测定淀粉消化,略有改动。向装有混合凝胶样品的玻璃瓶中加入4 mL胃蛋白酶-磷酸缓冲溶液(5 mg/mL)。将在37 ℃条件下保温30 min。加入6 个玻璃珠和2 mL乙酸钠缓冲液(0.5 mol/L,pH 5.2),利用于涡旋混合仪进行充分混匀。将玻璃管置于37 ℃水浴中并以160 r/min振荡25 min。然后向玻璃管中加入淀粉转葡糖苷酶和转化酶组成的混合酶溶液(2 mL)。在不同时间(0、20、30、60、90、120、180 min和240 min)取50 μm使用葡萄糖氧化酶-过氧化物酶法测量酶解葡萄糖的含量。根据G20和G120值计算RDS、SDS和RS的值并绘制淀粉消化曲线。

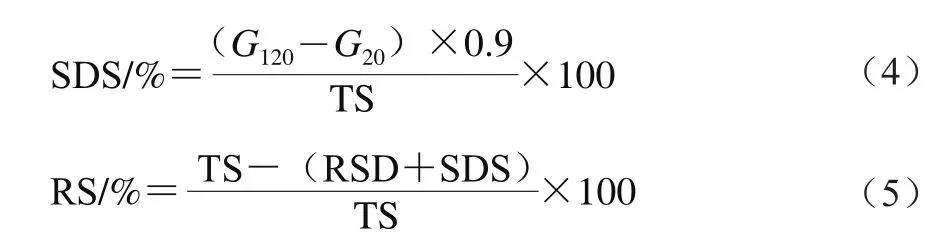
式中:C为淀粉消化率;t为取样时间点;Gt为在酶解t min后释放的葡萄糖含量/mg;G0为混合体系消化前所含游离葡萄糖的含量/mg;G20为在酶解20 min后释放的葡萄糖含量/mg;G120为在酶解120 min后释放的葡萄糖含量/mg;TS为淀粉的干基总质量/mg。
1.3.6.3 pGI测定
根据Goñi等[23]提出的如下公式,可通过淀粉酶解率计算出pGI。
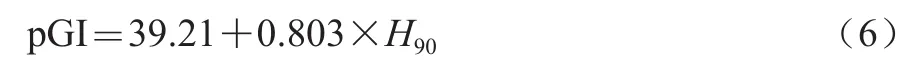
式中:H90为90 min酶解的总淀粉的百分比。
1.3.7 激光共聚焦扫描显微镜观察
利用激光共聚焦扫描显微镜观察LEBG与淀粉的相互作用的方式。向淀粉中加入干基质量0%和20%的LEBG,加入一定量的蒸馏水,配制成干基为5%的混合体系,置于沸水浴中糊化20 min(边糊化边进行磁力搅拌),糊化结束后,利用荧光染料FITC(20 μL,2 mg/mL)对淀粉-多糖复合凝胶进行染色,并在20 ℃条件下孵育24 h。取一定量混合物置于载玻片上,并在样品制备后15 min内观察。配备有两个空气冷却激光器Ar和He/Ne的TCS SP2 AOBS共聚焦激光扫描显微镜在×40物镜的荧光模式下观察。FITC的激发波长为488 nm,发射波长为500~525 nm[24]。
1.4 数据分析
采用Origin 9.0和Microsoft Excel 2016对数据进行统计分析和图表绘制;采用IBM SPSS Statistics 22软件进行方差分析;采用ASTRA 6.1数据分析软件对光散射数据进行采集和分析。
2 结果与分析
2.1 LEBG的基本组成

表2 LEBG的基本组成的质量分数(x±s,n=3)Table 2 Basic composition of LEBG (x ± s, n= 3)
由表2可见,香菇通过此种热水浸提方法得到的LEBG的多糖质量分数为80.04%,其中,β-葡聚糖质量分数为70.62%,其得率为0.49%。
2.2 LEBG的分子质量及纯度鉴定
如图2所示,利用HPSEC-MALLS-RI联用系统测定LEBG的分子质量,LEBG的重均分子质量(mw)为1.868×106Da,数均分子质量(mn)为1.854×106Da,多分散性指数为1.007 6,说明热水浸提得到的LEBG为大分子的β-葡聚糖,且分子质量分布较为集中。该结果与梅光明等[25]的香菇多糖分子质量(mw:5.203×104;mn:4.707×104)测定有一定的差异,造成这一差异的原因可能是香菇的前处理、来源不同,以及不同的提取方法。
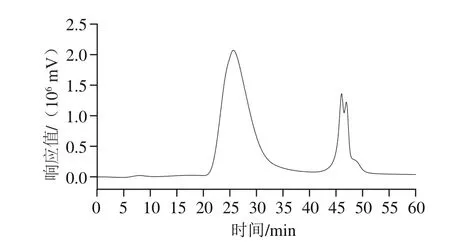
图2 LEBG的高效液相色谱图谱Fig. 2 HPLC profile of LEBG
2.3 LEBG的单糖组成分析
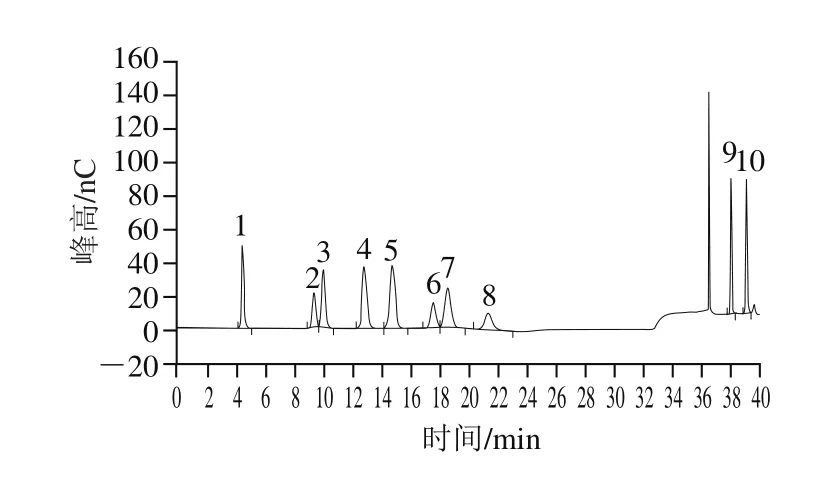
图3 混合标准品的离子色谱图Fig. 3 Ion chromatograms of mixed standards

图4 LEBG的离子色谱图Fig. 4 Ion chromatogram of LEBG
LEBG经水解后与标准单糖的离子色谱图进行对比,结果如图3、4所示,LEBG的单糖组成为葡萄糖、半乳糖、阿拉伯糖、木糖和甘露糖。LEBG中阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖物质的量之比为0.72∶1.61∶2.61∶92.75∶2.34,由此可判断,葡萄糖是LEBG的单糖组成主要为葡萄糖。这些结果与先前研究中的结果类似,Xie Hongqi等[26]从香菇中提取得到的3 种多糖Le1、Le2、Le3均由阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,其中葡萄糖为主要单糖组分。
2.4 红外图谱分析结果
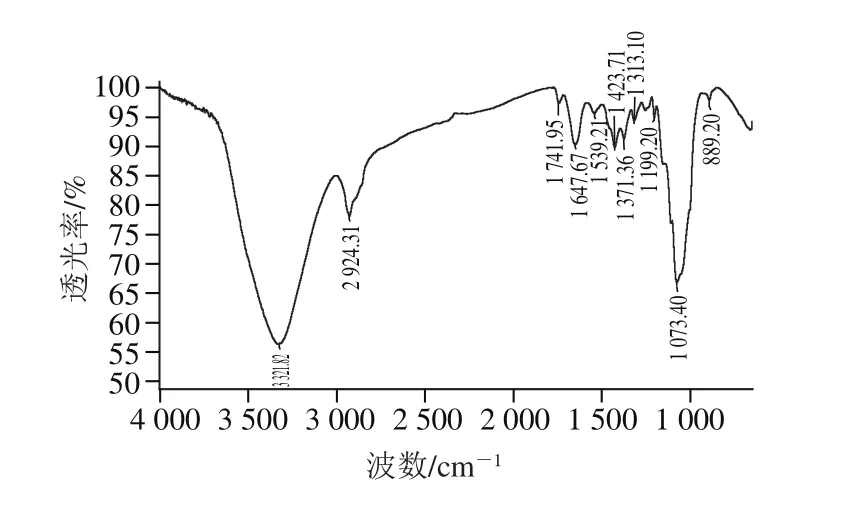
图5 LEBG的红外图谱Fig. 5 Infrared spectrum of LEBG
由图5可知,在3 321.82 cm-1处有强的—OH 吸收峰,说明LEBG存在分子间的氢键[27];在2 924.31 cm-1有CH3、CH2、CH的C—H伸缩振动吸收峰;波数为1 647.67 cm-1附近有C=H的伸缩振动吸收峰;波数为1 423.71 cm-1附近有甲基和次甲基的不对称C—H(即面内摇摆振动)吸收峰,波数为1 371.36 cm-1附近出现多重吸收峰,为甲基对称C—H的剪式振动的吸收峰,波数为1 199.20 cm-1附近为三级醇的伸缩振动吸收峰,1 400~1 200 cm-1附近的吸收峰说明该物质为糖类化合物[28];波数为1 073.40 cm-1处有强的C—O—C醚键的吸收峰,波数为889.20 cm-1有吸收峰,说明分子中不存在烷烃直链,在889.20 cm-1处吸收是β-吡喃糖苷键的特征峰[29],说明LEBG为β-吡喃型多糖。
2.5 LEBG对淀粉流变特性的影响
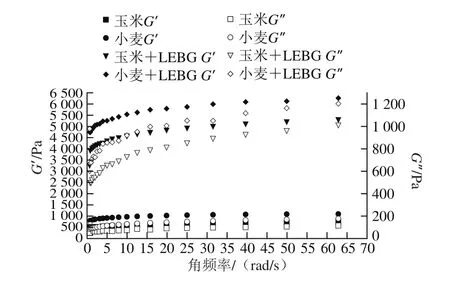
图6 LEBG对小麦淀粉和玉米淀粉黏弹性的影响Fig. 6 Effects of LEBG on the viscoelasticity of wheat starch and corn starch
黏弹性是高分子化合物特有的性质,高分子化合物既有弹性固体特性,又具有黏性流体的特性。淀粉是一种高分子化合物,兼具有弹性和黏性的双重特性[30]。通常利用动态流变学中的G’和G”表征淀粉的黏性和弹性大小。如图6所示,凝胶体系随着角频率的增加,G’和G”均呈现增加的趋势,G’总是大于G”,添加了LEBG的凝胶比未添加的G’、G”大,表明添加LEBG后,小麦淀粉糊和玉米淀粉糊的G’和G”均显著增加,这可能是LEBG相互交联,改善了混合结构分子链之间的连接,增强了凝胶的网络结构。据文献报道,富含β-葡聚糖的香菇粉的存在可显著改变淀粉的黏弹性。同时,香菇粉中的多糖和淀粉交联,导致分子混合体系的交联度增加,凝胶系统网络架构得到增强[31]。
2.6 LEBG对淀粉体外消化的影响
通过测量淀粉消化过程中的水解速率,研究了小麦淀粉凝胶中LEBG对体外淀粉消化的影响。图7描述了与小麦淀粉、玉米淀粉和20% LEBG进行比较的淀粉酶解曲线。其中,添加了20% LEBG的小麦淀粉消化的速度和程度在所有样品中是最低的,其次是添加了20% LEBG的玉米淀粉,这归因于凝胶体系中的网络结构。LEBG可能与淀粉相互缠结形成了更加稳定的凝胶网络结构。从流变学的结果进一步验证了此结论,LEBG增强了与淀粉缠结的可能性,促进了淀粉之间的相互聚集,LEBG和淀粉有一定程度的相互作用,同时降低了淀粉酶与淀粉接触的面积[14]。Hrvoje等[32]在研究中也得到相似的结论,主要由β-D-葡聚糖构成的黄原胶在体外消化过程中对淀粉的酶解起到抑制作用,其主要可能原因是其侧链与淀粉形成螺旋状结构,使得酶解速率降低。
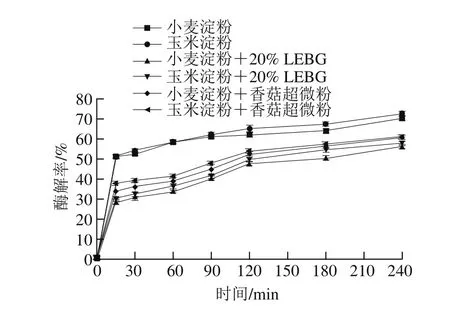
图7 LEBG对不同淀粉体外消化的影响Fig. 7 Effect of LEBG on in vitro digestion of different types of starch
4 组样品RDS、SDS、RS含量和pGI值如表3所示。与未添加LEBG相比,具有LEBG的淀粉表现出较低水平的RDS和pGI。此外,含有LEBG的淀粉含有较高含量的SDS和RS。其中,添加了LEBG的小麦淀粉具有最低的RDS(28.37)和pGI值(59.86),显著低于未添加LEBG的小麦淀粉,在玉米淀粉组别也有相同结果。说明LEBG对淀粉的体外消化具有显著的抑制作用,能显著降低RDS和pGI,增加SDS和RS的含量(P<0.05)。该结果与Regand等[33]的研究结果一致,表明作为可溶性膳食纤维来源的燕麦β-葡聚糖可以显著降低血糖反应峰值和曲线下的增量面积。另一重要原因是β-葡聚糖对体外消化过程所使用的酶有一定的相互作用[34]。张宇等[13]在研究燕麦β-葡聚糖对淀粉体外消化影响时发现,燕麦β-葡聚糖对α-淀粉酶中的色氨酸残基发生了静电或可能发生了由氢键、范德华力等非共价键的结合,形成了复合物,减少了酶和淀粉结合的机会,从而减缓了淀粉消化的进程。将含有LEBG的香菇超微粉加入淀粉中,也得到相同的结果,说明无论是提取出的LEBG还是含有LEBG的香菇超微粉对于淀粉的消化都有一定的抑制作用。
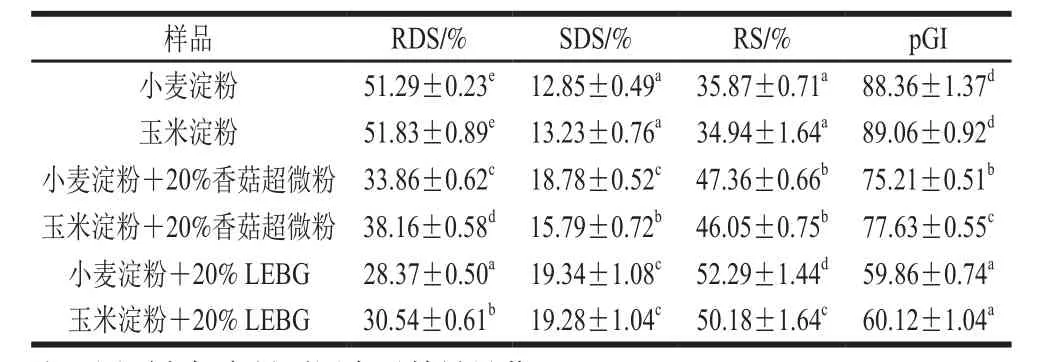
表3 LEBG对不同淀粉营养片段的影响以及pGITable 3 Effects of LEBG on different types of nutritive starch fragments and predicted glycemic index
2.7 LEBG与淀粉相互作用的可视化观察

图8 LEBG-淀粉混合体系的激光共聚焦扫描显微镜图片Fig. 8 Laser confocal scanning microscopy photos of LEBG-starch blend system
如图8可见,FITC能够对糊化淀粉以及多糖提供良好的分辨率,在激光共聚焦显微镜下,糊化后的小麦淀粉和玉米淀粉均呈现绿色荧光,加入20% LEBG的淀粉周围有更强的绿色荧光,说明LEBG将淀粉包裹其中,这与Funami等[24]的研究结果一致,多糖与淀粉相互作用方式为多糖包裹淀粉,这进一步说明LEBG对淀粉消化的抑制作用是由于LEBG对淀粉的包裹作用,使得淀粉与酶接触的可能性降低,从而降低其消化速度。
3 结 论
本实验采用热水浸提从香菇的子实体中成功分离得到β-葡聚糖质量分数为70.62%,mw为1.868×106Da的LEBG。该LEBG的单糖组分为阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖,其物质的量之比为0.72∶1.61∶2.61∶92.75∶2.34,并通过红外验证其结构为β-吡喃多糖。将20%的LEBG分别加入小麦淀粉和玉米淀粉中,其动态流变学揭示了LEBG与淀粉之间有相互作用的存在。体外消化结果显示,与未添加LEBG相比,添加了LEBG的小麦淀粉和玉米淀粉的酶解速率显著降低(P<0.05)。添加了LEBG的两种淀粉均表现出较低水平的RDS和pGI以及较高含量的SDS和RS。显然,LEBG对淀粉的体外消化具有一定的抑制作用,综合动态流变学的结论可以发现,LEBG可能与淀粉相互缠结形成了更加稳定的凝胶网络结构,降低了淀粉酶与淀粉接触的面积。在可视化实验中进一步说明LEBG与淀粉相互作用的具体方式为包裹作用。将含有LEBG的香菇超微粉加入淀粉,实验结果表明超微粉也具有一定抑制效果,可用于研发低血糖指数的淀粉类食品。
参考文献:
[1]XU X F, YAN H D, TANG J, et al. Polysaccharides in Lentinus edodes: isolation, structure, immunomodulating activity and future prospective[J]. Critical Reviews in Food Science and Nutrition, 2014,54(4): 474-487. DOI:10.1080/10408398.2011.587616.
[2]李文, 杨焱, 周帅, 等. 八种食用菌水溶性粗多糖的β-葡聚糖含量与体外免疫活性研究[J]. 食用菌学报, 2012, 19(1): 65-69.DOI:10.3969/j.issn.1005-9873.2012.01.012.
[3]WASSER S P. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Applied Microbiology and Biotechnology, 2002, 60(3): 258-274. DOI:10.1007/s00253-002-1076-7.
[4]庄海宁, 张劲松, 冯涛, 等. 我国食用菌保健食品的发展现状与政策建议[J]. 食用菌学报, 2015, 22(3): 85-90. DOI:10.16488/j.cnki.1005-9873.2015.03.018.
[5]PILLAI T G, DEVI P U. Mushroom beta glucan: potential candidate for post irradiation protection[J]. Mutation Research/Fundamental &Molecular Mechanisms of Mutagenesis, 2013, 751(2): 109-115.DOI:10.1016/j.mrgentox.2012.12.005.
[6]ZHANG Y, XIA L, PANG W, et al. A novel soluble β-1,3-D-glucan salecan reduces adiposity and improves glucose tolerance in highfat diet-fed mice[J]. British Journal of Nutrition, 2013, 109(2): 1-9.DOI:10.1017/s0007114512000980.
[7]李月梅. 香菇的研究现状及发展前景[J]. 微生物学通报, 2005, 32(4):149-152. DOI:10.3969/j.issn.0253-2654.2005.04.030.
[8]陈洁, 孟春雨, 何志勇, 等. 低血糖负荷食品研究进展[J]. 食品与生物技术学报, 2016, 35(5): 449-456. DOI:10.3969/j.issn.1673-1689.2016.05.001.
[9]ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(Suppl 2): S33-S50.
[10]刘慧颖, 任国峰. 食物血糖指数及其预测模型研究进展[J]. 实用预防医学, 2014, 21(2): 255-257. DOI:10.3969/j.issn.1006-3110.2014.02.043.
[11]KENDALL C W, EMAM A, AUGUSTIN L S, et al. Resistant starches and health[J]. Journal of AOAC International, 2004, 87(3): 769-774.DOI:10.1108/00346659610105842.
[12]PULS W, KEUP U. Influence of an α-amylase inhibitor (BAY d 7791)on blood glucose, serum insulin and nefa in starch loading tests in rats,dogs and man[J]. Diabetologia, 1973, 9(2): 97-101. DOI:10.1007/bf01230687.
[13]张宇. 燕麦β-葡聚糖对淀粉消化吸收和血糖的影响[D]. 无锡: 江南大学, 2015: 19-25.
[14]ZHUANG H N, CHEN Z Q, FENG T, et al. Characterization of Lentinus edodes β-glucan influencing the in vitro starch digestibility of wheat starch gel[J]. Food Chemistry, 2017, 224: 294-301.DOI:10.1016/j.foodchem.2016.12.087.
[15]唐川, 杨焱, 吴迪, 等. 可溶性固形物含量对制备猴头菇子实体多糖的理化性质及免疫活性的影响[J]. 食用菌学报, 2014(4): 61-66.DOI:10.3969/j.issn.1005-9873.2014.04.018.
[16]张宝月, 王改香, 赵春霞, 等. 测定燕麦β-葡聚糖含量的方法比较[J]. 香料香精化妆品, 2013(4): 29-32. DOI:10.3969/j.issn.1000-4475.2013.04.010.
[17]ZHANG A Q, FU L, SUN P L, et al. Isolation and structural characterization of a water-soluble polysaccharide from Hericium erinaceus[J]. Mycosystema, 2010, 29(6): 911-917. DOI:10.13346/j.mycosystema.2010.06.023.
[18]LIU Y F, ZHAO Y, YANG Y, et al. Structural characteristics and hypoglycemic activity of polysaccharides from Coprinus comatus[J].Bioactive Carbohydrates & Dietary Fibre, 2013, 2(2): 164-169.DOI:10.1016/j.bcdf.2013.10.001.
[19]JIA W, ZHANG J S, JIANG Y, et al. Structure of oligosaccharide F21 derived from exopolysaccharide WL-26 produced by Sphingomonas sp. ATCC 31555[J]. Carbohydrate Polymers, 2012, 90(1): 60.DOI:10.1016/j.carbpol.2012.04.061.
[20]刁毅, 刘涛, 韩洪波. 不同地区地木耳多糖红外光谱与抗氧化活性研究[J]. 湖北农业科学, 2016, 55(4): 984-987. DOI:10.14088/j.cnki.issn0439-8114.2016.04.042.
[21]冯涛. 凉粉草胶结构、性质及与淀粉相互作用的研究[D]. 无锡: 江南大学, 2007: 22-28.
[22]冷雪. 茶多酚对改性糯玉米淀粉消化性的影响[D]. 无锡: 江南大学,2013: 38-41.
[23]GOÑI I, GARCIA-ALONSO A, SAURA-CALIXTO F. A starch hydrolysis procedure to estimate glycemic index[J]. Nutrition Research,1997, 17(3): 427-437. DOI:10.1016/s0271-5317(97)00010-9.
[24]FUNAMI T, NAKAUMA M, NODA S, et al. Effects of some anionic polysaccharides on the gelatinization and retrogradation behaviors of wheat starch: soybean-soluble polysaccharide and gum arabic[J]. Food Hydrocolloids, 2008, 22(8): 1528-1540. DOI:10.1016/j.foodhyd.2007.10.008.
[25]梅光明, 郝强, 张小军, 等. 酸提香菇多糖的分离纯化及结构鉴定[J]. 现代食品科技, 2014(9): 79-84. DOI:10.13982/j.mfst.1673-9078.2014.09.014.
[26]XIE H Q, ZHOU C S, SHAO-LONG D U, et al. Isolation and identification of three lentinans obtained by ultrafiltration from Lentinus edodes[J]. Natural Product Research & Development, 2007,19(3): 369-373. DOI:10.16333/j.10016880.2007.03.003.
[27]杨焱. 桑黄多糖的分离纯化、结构鉴定和生物活性的研究[D]. 无锡:江南大学, 2007: 25-33.
[28]卫强, 任定美, 李四聪, 等. 皖南山区红豆杉多糖提取、纯化方法及单糖组成分析[J]. 食品科学, 2017, 38(16): 190-197. DOI:10.7506/spkx1002-6630-201716030.
[29]杨立红, 黄清荣, 冯培勇, 等. 黄伞菌丝体多糖的分离鉴定及其抗氧化性研究[J]. 食品科学, 2009, 30(23): 131-134. DOI:10.3321/j.issn:1002-6630.2009.23.028.
[30]蔡庆, 范雪荣, 王强, 等. 乳化剂对淀粉浆料糊化和流变特性的影响[J]. 棉纺织技术, 2016, 44(2): 19-23. DOI:10.3969/j.issn.1001-7415.2016.02.006.
[31]周剑敏, 汤晓智, 南娉娉. 香菇粉对小麦面团热机械学和动态流变学特性的影响研究[J]. 中国粮油学报, 2014, 29(7): 7-11.
[32]FABEK H, MESSERSCHMIDT S, BRULPORT V, et al. The effect of in vitro digestive processes on the viscosity of dietary fibres and their influence on glucose diffusion[J]. Food Hydrocolloids, 2014, 35(3):718-726. DOI:10.1016/j.foodhyd.2013.08.007.
[33]REGAND A, CHOWDHURY Z, TOSH S M, et al. The molecular weight,solubility and viscosity of oat beta-glucan affect human glycemic response by modifying starch digestibility[J]. Food Chemistry, 2011, 129(2): 297-304. DOI:10.1016/j.foodchem.2011.04.053.
[34]吴佳, 谢笔钧. 燕麦β-葡聚糖对α-淀粉酶的体外作用[J]. 营养学报,2011, 33(6): 612-615. DOI:10.13325/j.cnki.acta.nutr.sin.2011.06.010.
