口腔鳞状细胞癌组织中EGFR的表达和突变的意义及对预后的影响
2018-05-22刘海波郑维银
刘海波,郑维银
口腔鳞癌的发生及发展是一个多基因参与的复杂过程。随着分子靶向药物临床应用于治疗头颈部鳞癌(HNSCC),表皮细胞生长因子受体(EGFR)逐渐成为一个热门靶点被国内外学者研究,近年来研究表明EGFR在血管生成、细胞增殖分化、肿瘤的发生及发展过程中起重要作用[1]。EGFR出现过表达可能跟肿瘤的分化、转移及临床预后、总生存期等因素相关,这对判断术后癌症的复发有重要意义[2]。定位于EGFR酪氨酸激酶的ATP结合位点的编码区(通常指18-21位外显子)若出现一个或一段的碱基缺失、替换等基因突变,可以刺激细胞不停地生长,最终也可能导致癌症的发生发展,甚至出现转移[3]。因此,本研究探讨了EGFR过表达及突变对各临床病理因素的影响和患者预后的关系,可供临床参考。
1 材料和方法
1.1 主要的材料和设备 微量核酸分光光度计(凯奥K5500);荧光PCR仪(ABI Prism7500);FFPE DNA Kit(Spin Columns)和人类EGFR基因突变检测试剂盒(安徽达健医学科技有限公司);一抗EGFR人源(Abcam),SABC二抗(武汉博士德生物工程有限公司);正置显微镜(Leica,DM3000)。
1.2 一般资料 收集成都军区总医院附属口腔医院2012年1月至2013年1月手术切除口腔鳞癌标本42例,患者手术前均经过病理活检证实为口腔鳞状细胞癌,排除手术前进行放化疗及其他治疗的患者或术前存在远处转移的患者。其中男性27例,女性15例,年龄34-83岁,平均年龄59.6岁,患者具体资料见表1。同时收集正常的口腔粘膜组织10例作为对照。
1.3 免疫组化染色 将收集的组织进行石蜡包埋,制成4μm石蜡切片,按照常规免疫组化SP法进行染色,使用PBS缓冲液代替一抗作为阴性对照,阳性对照为试剂公司提供EGFR阳性标本。使用十三点评分法对免疫组化结果进行半定量分析,每例标本在400倍显微镜下随机选出10个不重叠视野进行阳性细胞计数,按照视野中阳性细胞率进行分级:0级=阳性细胞率<5%;1级=阳性细胞率5%-24%;2级=阳性细胞率25%-49%;3级=阳性细胞率50%-74%;4级=阳性细胞率≥75%;按照染色强度进行评价:1级=淡黄色;2级=黄棕色;3级=棕褐色。将阳性细胞率分级数乘以染色强度的分级数得到最终评分:≤1为阴性;2-4为低表达;≥5为过表达(图1)。
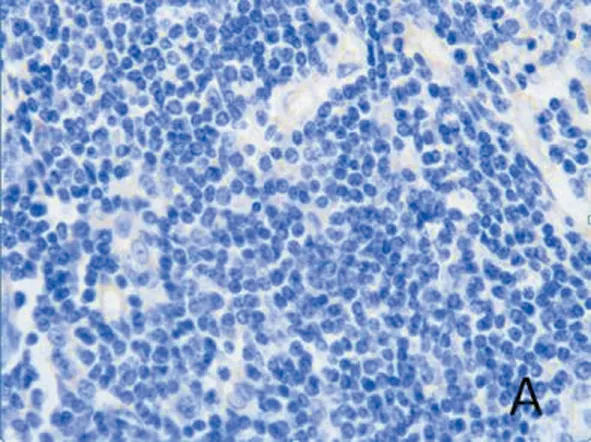

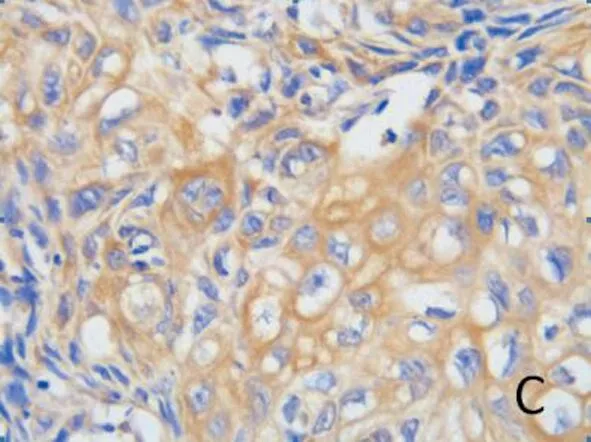
图1 A.EGFR阴性(×400);B.EGFR低表达(×400);C.EGFR过表达(×400)
1.4 基因突变检测 将表1中12例局部晚期口腔鳞癌石蜡包埋组织每例切片5-10片(5μm厚),按照石蜡包埋组织DNA提取试剂盒说明书上进行操作,提取的DNA溶液于-20℃保存,使用微量分光光度计进行DNA浓度和纯度测试,DNA纯度正常值OD260/OD280比值应在1.7-1.9之间,OD260/OD230≥1.7,DNA样本含量需大于5ng/μl。确保标本DNA溶液浓度及纯度正常后,按照EGFR基因突变检测试剂盒说明书上步骤运用42位点ARMS荧光PCR法,将稀释后的标本溶液进行PCR扩增,检测分析标本EGFR基因突变情况(图2)。


图2 EGFR存在突变(A);EGFR未存在突变(B)
1.5 随访 通过查询病例、电话等方式对所有患者进行术后回访,其中有随访结果38例,随访年限为5年,分别记录患者是否复发、生存时间和生存结局。
1.6 统计学方法 应用SPSS17.0统计软件进行统计学分析,单因素分析采用χ2检验及Fisher确切概率法检验,生存分析采用Kaplan-Meier法和Log rank 检验,P<0.05具有统计学差异。
2 结 果
2.1 EGFR表达与口腔鳞癌患者临床及病理因素之间的关系 42例口腔鳞癌组织中,过表达23例,低表达14例,总表达率88.1%,10例正常黏膜组织中EGFR无表达或仅有少量表达,两者之间有明显差异(P<0.05)。EGFR表达与性别、分化程度、临床分期、淋巴结转移均无显著差异(P>0.05),仅与年龄存在相关性(P=0.027),且年龄<60岁的患者阳性表达率显著高于≥60岁的患者(表1)。
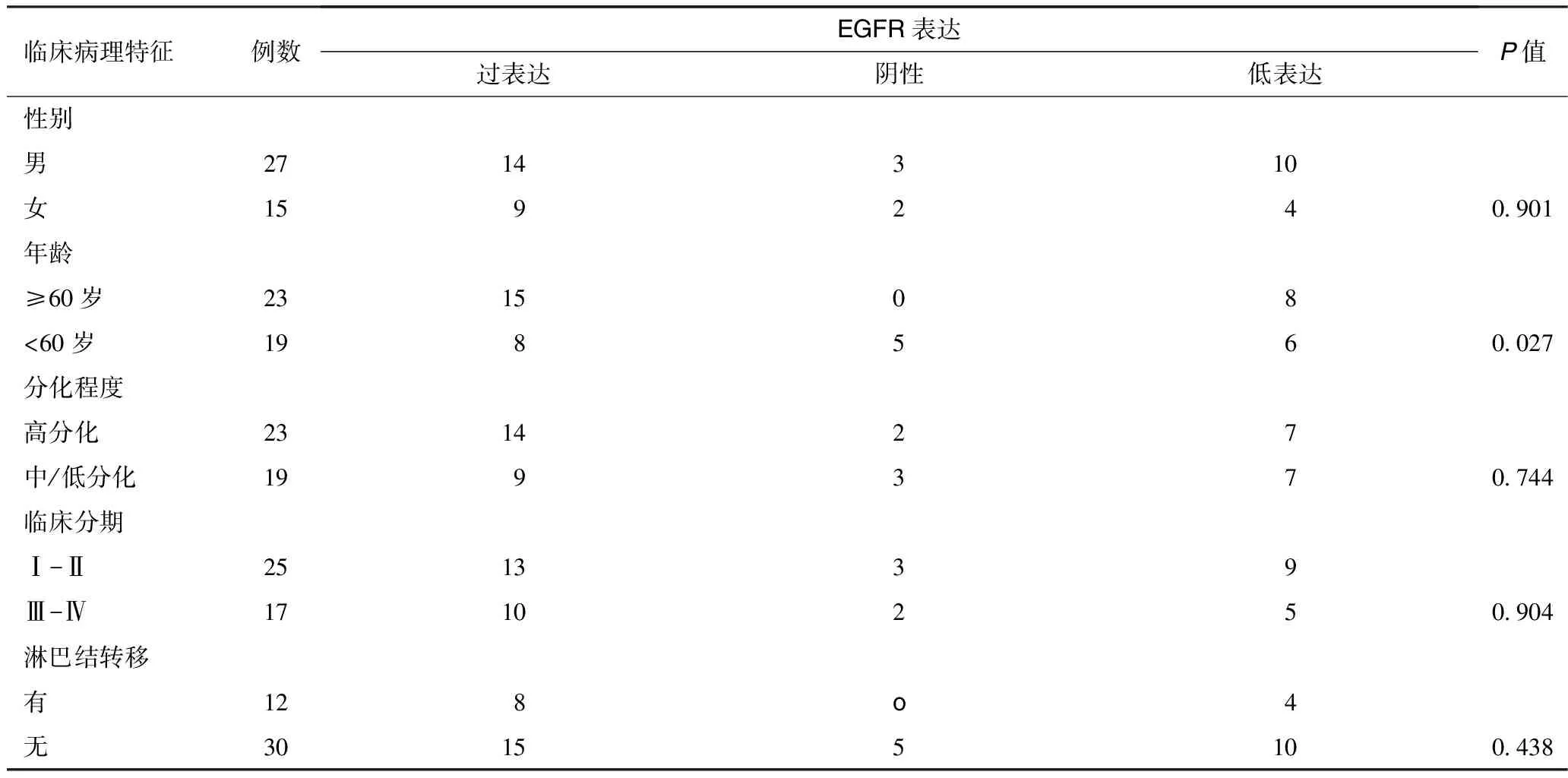
表1 EGFR表达与临床病理特征的关系
2.2 EGFR表达与口腔鳞癌患者预后的关系 EGFR表达与肿瘤无复发生存率和总体生存率的关系(P>0.05),EGFR表达强弱与患者预后无显著相关性(图3)。

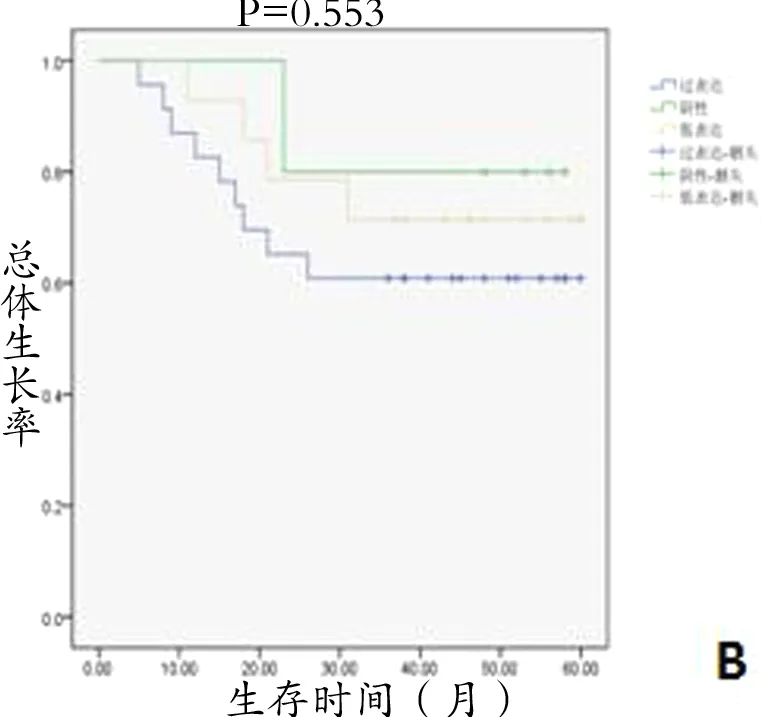
图3 EGFR表达与无肿瘤复发生存率
2.3 EGFR基因突变与局部转移的口腔鳞癌患者的关系 在12例出现局部淋巴结转移的口腔鳞癌患者组织中,EGFR酪氨酸激酶区域(18-21号外显子)均未发生基因突变。
3 讨 论
本研究选取42例不同分化程度的口腔鳞癌组织和10例正常口腔黏膜组织,EGFR在口腔鳞癌组织中表达率达88.1%,而在正常口腔黏膜组织未出现表达或仅少量表达(阳性细胞率<5%),这与国内外大多数研究结果相一致[4]。在EGFR表达与临床病理特征的关系上,EGFR表达并未与性别、分化程度、临床分期、是否淋巴结转移相关,而仅在年龄上存在显著差异,研究结果跟马捷等[5]相一致,然而,吴润叶等[6]研究结果并未在年龄上存在差异,究其结果可能与(1)检测EGFR表达的方法(2)免疫组化评判标准(3)样本量等因素相关。EGFR表达与预后的关系并未出现显著相关,但从其生存函数曲线图中可以看出EGFR表达强度越高,出现复发和死亡几率越大,此外,国外的许多针对EGFR表达与预后关系的大样本研究并没有一个统一的结果[7]。关于EGFR突变的研究多见于非小细胞肺癌,而EGFR基因突变也是影响表皮生长因子酪氨酸激酶抑制剂(EGFR-TKI)分子靶向药物治疗效果的关键,Lai等[8]研究报道了肺鳞癌的EGFR基因突变率为14.5%,但国内外关于口腔鳞癌的EGFR酪氨酸激酶区域(18-21号外显子)基因突变的研究并不多见,通过对口腔鳞癌组织EGFR突变的研究有助于了解口腔鳞癌发生的分子机制,并对开发新型EGFR-TKI分子靶向药物临床用于治疗口腔鳞癌有指导意义。但是,本实验研究的12例局部转移的口腔鳞癌组织中,并未出现18-21外显子的突变,这与Temam等[9]的研究结果一致,但也可能跟样本量太少有关,同时本实验也说明EGFR蛋白的表达和基因突变之间没有关联。
综上所述,口腔鳞癌发生及发展是一个复杂的过程,EGFR是一个极具研究价值的分子靶点,对EGFR蛋白进行检测不但可以从分子水平了解肿瘤发生、发展的过程,而且还可以有效指导分子靶向药物的使用。临床上常用的分子靶向药物分为单克隆抗体、酪氨酸酶抑制剂、新生血管抑制剂、转录因子为靶点的抗肿瘤药物、以DNA拓扑酶为靶点的抗肿瘤药物等。目前国内外批准应用于口腔鳞癌的分子靶向药物仅有西妥昔单抗(Cetuximab)一种[10],且Cetuximab作为单克隆抗体临床用于治疗头颈部鳞癌,其适应症为局部晚期头颈部鳞癌或出现复发转移的头颈部鳞癌,许多研究均表明EGFR表达情况对Cetuximab的疗效及患者的预后有较大影响。随着临床研究的不断进行和对EGFR分子机制的深入研究,关于EGFR蛋白的检测方法和评判标准会更加统一,相信未来会有更多以EGFR为靶点的分子靶向药物应用于临床,从而使口腔鳞癌患者从中受益。
【参考文献】
[1]POMERANTZRG,GRANDISJR.Theroleofepidermalgrowthfactorreceptorinheadandnecksquamouscellcarcinoma[J].CurrOncolRep, 2003, 5(2): 140-146.
[2]PGONCZY,CECHEVERRI,KOEGEMA,etal.Functionalgenomicanalysisidentifiedepidermalgrowthfactorreceptoractivationasthemostcommongeneticeventinoralsquamouscellcarcinoma[J].CancerRes, 2009, 69(6) : 2568- 2576.
[3] 武晓楠.表皮生长因子受体基因在多种肿瘤中的突变情况及临床意义[J].中国全科医学,2008,11(7A):1197-1201.
[4]SACCOASSUNTINAG,WORDENFRANCISP.Molecularlytargetedtherapyforthetreatmentofheadandneckcancer:areviewoftheErbBfamilyinhibitors[J].OncoTargetsTher, 2016, 9:1927-1943.
[5] 马捷,刘莹,朱东旺,等.EGFR在局部晚期口腔鳞癌中的表达及与TPF诱导化疗的关系[J].中国口腔颌面外科杂志,2013,11(3):209-214.
[6] 吴润叶,高黎,杨伟志,等.头颈部癌表皮生长因子受体表达及对预后判断价值[J].肿瘤学杂志,2007,13(5):384-387.
[7]JWOO,ELAU,RKAY,etal.Prognosticvalueofepidermalgrowthfactorreceptorexpressioninpatientswithadvancedstagenasopharyngealcarcinomatreatedwithinductionchemotherapyandradiotherapy[J].IntJRadiatOncolBiolPhys, 2004, 59(1)11-20.
[8]YLAI,ZZHANG,JLI,etal.EGFRmutationsinsurgicallyresectedfreshspecimensfrom697consecutiveChinesepatientswithnon-smallcelllungcancerandtheirrelationshipswithclinicalfeatures[J].IntJMolSci, 2013, 14(12): 24549.
[9]TEMAMSTEPHANE,KAWAGUCHI,HIDETOSHI,etal.Epidermalgrowthfactorreceptorcopynumberalterationscorrelatewithpoorclinicaloutcomeinpatientswithheadandnecksquamouscancer[J].JClinOncol, 2007, 25(16): 2164-2170.
[10]DAIW,LIY,ZHOUQ,etal.Cetuximabinhibitsoralsquamouscellcarcinomainvasionandmetastasisviadegradationofepidermalgrowthfactorreceptor[J].JournalofOralPathology&Medicine, 2014, 43(4):250-257.
