泽泻HPLC-UV指纹图谱研究
2018-05-18张丽娜薛志峰韩鹏军皮佳鑫祁东利刘志东
张丽娜,张 兵,薛志峰,韩鹏军,皮佳鑫,李 楠,祁东利*,刘志东*
(1.天津中医药大学,现代中药发现与制剂技术教育部工程中心,天津 300193;2.天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验室培育基地,天津 300193)
中药泽泻为泽泻科植物泽泻Alismaorientale(Sam) Juzep.的干燥块茎,性寒,味甘、淡,归肾、膀胱经,具有利水渗湿、泄热、化浊降脂等功效,常用于小便不利、水肿胀满、泄泻尿少、痰饮眩晕、热淋涩痛和高血脂症[1]。泽泻的化学成分主要有三萜类化合物、倍半萜类化合物、二萜类化合物、多糖和其他成分[2-5],其中三萜类化学成分均为原萜烷型四环三萜,主要包括泽泻醇A、B、C、D、E、F、G、H、I、J、K、L、M、N、O及其同系物等,具有降血脂[6-9]、抗动脉粥样硬化[10-12]和保肝[13]等药理活性;泽泻中倍半萜类化学成分主要是愈创木烷型(环氧泽泻烯)、吉玛烷型(半萜吉玛烯C、吉玛烯D)、桉叶型(桉烯二醇)和O-plopanane型等[14-16],其中以环氧泽泻烯为主的愈创木烷型化合物抑制核因子κB (NF-κB) 活性,抑制诱导型一氧化氮合酶(iNOS)表达,抑制一氧化氮的产生,具有抗炎活性[17-20],该类成分可能是泽泻治疗热淋涩痛的主要物质。泽泻质量分析多用HPLC指纹图谱技术来研究不同批次泽泻的质量差异,大多数报道主要指认原萜烷型三萜化合物。本文建立了泽泻的HPLC-UV指纹图谱法,对11批泽泻进行指纹图谱研究,成分指认兼顾原萜烷型三萜成分和倍半萜类成分,以期为全面评价泽泻的质量提供理论依据。
1 仪器与试药
1.1仪器 安捷伦1200高效液相色谱仪(美国Agilent公司);XP205型十万分之一天平(瑞士梅特勒-托利多仪器有限公司);KQ-300B型超声波清洗仪(昆山市超声仪器有限公司);Mill-QⅡ型超纯水机(美国Millipore公司);FW100型万能粉碎机(天津市泰斯特仪器有限公司)。
1.2试药 环氧泽泻烯对照品(购自中国食品药品检定研究院,质量分数≥98%);23-乙酰泽泻醇B对照品(购自天津中新药业有限公司,质量分数≥98%);甲醇、乙腈均为色谱纯(购自Fisher Scientific公司);泽泻由正大青春宝药业有限公司提供,按照《中国药典》2015年版一部方法检验,鉴定为泽泻科植物泽泻Alismaorientale(Sam) Juzep.块茎的干燥饮片,产地和批号见表1。
表1泽泻的编号、产地及批次信息
Tab.1 Producing places and batches ofRhizomaalismatis

编号产地批号编号产地批号S1四川14010S7江西14001S2四川14011S8江西14002S3四川14012S9江西14003S4福建14007S10浙江14004S5福建14008S11浙江14005S6福建14009
2 方法与结果
2.1供试品溶液的制备 取各批次泽泻适量,粉碎,过60目筛,精密称取2 g粉末,置于25 mL量瓶中,加乙腈超声(400 W,40 kHz)30 min,放冷至室温,定容,摇匀,过0.45 μm有机滤膜,续滤液作为供试品溶液。
2.2对照品溶液的制备 精密称取环氧泽泻烯对照品和23-乙酰泽泻醇B对照品适量,置于10 mL量瓶中,加甲醇定容至刻度,摇匀,配制成环氧泽泻烯和23-乙酰泽泻醇B质量浓度均为0.2 mg·mL-1的对照品溶液,过0.45 μm有机滤膜,续滤液作为对照品溶液。
2.3色谱条件 色谱柱Agilent ZORBAX Eclipse Plus C18(250 mm×4.6 mm,5 μm)。流动相:乙腈(B)-水(A),梯度洗脱(0~5 min,35%B;5~10 min,35%B~55%B;10~15 min,55%B~70%B;15~20 min,70%B~75%B;20~40 min,75%B)。流速:1 mL·min-1;柱温:30 ℃;进样量:10 μL;检测波长:210 nm。
2.4方法学考察
2.4.1专属性考察 取2.1项下制备的供试品溶液(批号14010)、2.2项下制备的23-乙酰泽泻醇B对照品溶液和环氧泽泻烯对照品溶液以及空白乙腈各10 μL,注入高效液相色谱仪,按照2.3项下色谱条件,连续进样3次,记录色谱图,见图1。
2.4.2精密度考察 取2.1项下制备的供试品溶液(批号14010),精密吸取10 μL,注入高效液相色谱仪,按照2.3项下色谱条件,连续进样6次,记录色谱图,结果表明,10个共有峰相对保留时间的RSD值在0.01%~0.25%,相对峰面积的RSD值在0.89%~5.55%,结果表明,仪器精密度良好。

图1HPLC图
a.空白乙腈;b.23-乙酰泽泻醇B对照品;c.环氧泽泻烯对照品;d.样品。
Fig.1 HPLC chromatograms
a.blank acetonitrile;b.23-acetate alisol B reference substance;c.alismoxide reference substance;d.sample.
2.4.3重复性考察 取同一批样品(批号14010),按照2.1项下方法制备供试品溶液6份,分别精密吸取10 μL,注入高效液相色谱仪,按照2.3项下色谱条件进样测定,记录色谱图,结果表明,10个共有峰相对保留时间的RSD值均小于0.25%,相对峰面积的RSD值在1.34%~4.62%,结果表明,该方法重复性良好。
2.4.4稳定性考察 取同一供试品溶液(批号14010),分别在0,4,8,12,24和48 h进样6次,按照2.3项下色谱条件进样,注入高效液相色谱仪,进行测定,结果表明,10个共有峰相对保留时间的RSD值在0.01%~0.34%,相对峰面积的RSD值在0.43%~7.76 %,结果表明,供试品溶液在48 h内稳定性较好。
2.5指纹图谱的建立及相似度评价
2.5.1指纹图谱的建立 取11批泽泻,按照2.1项下方法制备供试品溶液,分别精密吸取10 μL,注入高效液相色谱仪,按照2.3项下色谱条件进样分析,所得泽泻指纹图谱共有10个共有峰,其中峰1和10分别是环氧泽泻烯和23-乙酰泽泻醇B,色谱图见图2。计算11个批次10个峰的相对保留时间RSD值在0.011 2%~0.231 7%,相对峰面积RSD值在8.5%~86.7%。
2.5.2相似度评价 用国家药典委员会提供的《中药色谱指纹图谱相似度评价系统》(2012.130723版)对11批泽泻样品高效液相的分析结果进行相似度评价,3号峰峰面积最大且稳定,故选择3号峰作为参比峰(S),四川泽泻14010(S1)作为参照,利用中位数法,时间窗设为1 min,进行多点校正,Mark峰匹配,生成对照指纹图谱R,以对照指纹图谱R作为参照图谱,11批泽泻指纹图谱与之进行相似度比较和评价,S1~S11泽泻样品相似度结果分别是0.997,0.972,0.991,0.941,0.994,0.860,0.995,0.967,0.950,0.952和0.969,各批次泽泻相似度较高。指纹图谱见图3。
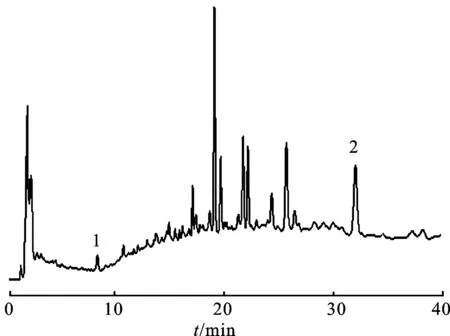
图2泽泻指纹图谱
1.环氧泽泻烯;2.23-乙酰泽泻醇B。
Fig.2 Fingerprint chromatogram ofRhizomaalismatis
1.alismoxide;2.23-acetate alisol B.

图3泽泻的指纹图谱叠加图和对照指纹图谱R
Fig.3 Fingerprint ofRhizomaalismatisand reference fingerprintR
3 讨论
3.1检测波长 优化本研究在泽泻饮片指纹图谱中指认原萜烷类化合物23-乙酰泽泻醇B和倍半萜类化合物环氧泽泻烯,从两类具有活性化合物的分析角度出发,进行泽泻指纹图谱研究,可相对全面地评价泽泻的质量差异。3D全波长(208~400 nm)扫描结果见图4,这两类化合物均为末端吸收,故选择210 nm作为检测波长。
3.2环氧泽泻烯的指认 本研究采用HPLC-UV法进行泽泻的指纹图谱研究,首次使用愈创木烷型化合物环氧泽泻烯对照品对泽泻指纹图谱色谱峰进行指认,实验方法学考察结果表明,此方法重复性好、精密度和稳定性高,适用于泽泻饮片的质量评价研究。研究结果显示,11批泽泻药材中环氧泽泻烯峰面积波动较小,无明显差异,说明环氧泽泻烯对不同产地泽泻指纹相似度影响较小。

图43D扫描图谱
Fig.4 3D HPLC chromatograms of scanning atlas
3.323-乙酰泽泻醇B的指认 文献报道,23-乙酰泽泻醇B在新鲜植物中含量很高,是植物体内存在的主要形式,而23-乙酰泽泻醇A、23-乙酰泽泻醇G和23-乙酰泽泻醇E等化合物在鲜品中没有或含量很低[21]。从生物途径角度来看,这些化合物均是23-乙酰泽泻醇B的次级代谢产物[3,5]。不同产地[22-23]、采收期[24-25]和炮制加工方法[22,26-27]对植物体内代谢酶的水平和活性有影响,从而影响23-乙酰泽泻醇B向泽泻醇A、泽泻醇A单乙酸酯和泽泻醇C等化合物的代谢转化过程[6],造成原萜烷型四环三萜类化合物的含量和指纹差异。实验观察到了这种指纹差异,S6(福建)药材的相似度为0.860,低于其他产地药材的相似度。由图3可知,S6药材中8和10号峰明显大于其他药材对应峰,而10号峰被指认为23-乙酰泽泻醇B,说明不同产地药材中23-乙酰泽泻醇B的生物合成水平与代谢转化过程存在差异。
23-乙酰泽泻醇B及其次级代谢产物在降血脂活性方面有显著差异,其中24-乙酰泽泻醇A降胆固醇作用最强,23-乙酰泽泻醇C、泽泻醇A和23-乙酰泽泻醇B次之,泽泻醇B未见抑制血脂升高作用[28]。结果表明,23-乙酰泽泻醇B的代谢转换过程研究对泽泻质量控制具有重要意义。本文根据泽泻药材的药理作用和相关活性成分,建立了基于愈创木烷型倍半萜成分和原萜烷型四环三萜类化合物为指认成分的指纹图谱研究,发现了部分产地泽泻的相似度较低,指出了23-乙酰泽泻醇B的代谢转化差异是造成药材指纹图谱相似度低的原因之一,为全面评价泽泻药材的质量奠定了理论基础。23-乙酰泽泻醇B代谢转换过程的差异引起泽泻药材的药理作用变化和质量优劣有待进一步研究。
参考文献:
[1] 国家药典委员会.中国药典:2015版:一部[S].北京:中国医药科技出版社,2015:229.
[2] Shu Z,Pu J,Chen L,et al.Alisma orientale:ethnopharmacology,phytochemistry and pharmacology of an important traditional Chinese medicine[J].Am J Chin Med,2016,44(2):227-251.
[3] 朱玉岚,彭国平.泽泻的萜类化学成分研究进展[J].天然产物研究与开发,2006,18(2):348-351.
[4] Tian T,Chen H,Zhao Y Y.Traditional uses,phytochemistry,pharmacology,toxicology and quality control ofAlismaorientale(Sam.) Juzep:a review[J].J Ethnopharmacol,2014,158:373-387.
[5] 肖飞艳,冯育林,杨世林,等.泽泻化学成分的研究进展[J].中药新药与临床药理,2009,20(5):491-495.
[6] 程志红,萧伟,王振中,等.泽泻调血脂活性成分及其药理和临床应用研究进展[J].中草药,2015,46(22):3420-3426.
[7] 黄珍,万丽,范成杰.泽泻中泽泻烯醇的鉴定和含量测定[J].华西药学杂志,2010,25(5):601-602.
[8] Imai Y,Matsumura H,Aramaki Y.Hypocholesterolemic effect of alisol A-24-monoacetate and its related compounds in rats[J].Jpn J Pharmacol,1970,20(2):222-228.
[9] Lin H R.Triterpenes fromAlismaorientalisact as farnesoid X receptor agonists[J].Bioorg Med Chem Lett,2012,22(14):4787-4792.
[10]Dan H,Wu J,Peng M,et al.Hypolipidemic effects ofAlismatisrhizomeon lipid profile in mice fed high-fat diet[J].Saudi Med J,2011,32(7):701-707.
[11]Adams M,Gschwind S,Zimmermann S,et al.Renaissance remedies:antiplasmodial protostane triterpenoids fromAlismaplantago-aquaticaL. (Alismataceae)[J].J Ethnopharmacol,2011,135(1):43-47.
[12]秦建国,王亚红,梁晋普,等.泽泻萜类化合物对ApoE基因敲除动脉粥样硬化小鼠肝脏基底膜HSPG的调节作用[J].中华中医药学刊,2007,25(4):696-698.
[13]Meng Q,Chen X L,Wang C Y,et al.Alisol B 23-acetate protects against ANIT-induced hepatotoxity and cholestasis,due to FXR-mediated regulation of transporters and enzymes involved in bile acid homeostasis[J].Toxicol Appl Pharmacol,2015,283(3):178-186.
[14]田婷,陈华,冯亚龙,等.泽泻药理与毒理作用的研究进展[J].中药材,2014,37(11):2103-2108.
[15]Kim K H,Kwun M J,Choi J Y,et al.Therapeutic effect of the tuber ofAlismaorientaleon lipopolysaccharide-induced acute lung injury[J].Evid Based Complement Alternat Med,2013,2013:863892.
[16]徐硕,夏路风,金鹏飞,等.泽泻的化学成分及生物活性研究进展[J].中国医药导报,2015,12(27):47-51.
[17]Peng G P,Tian G,Huang X F,et al.Guaiane-type sesquiterpenoids fromAlismaorientalis[J].Phytochemistry,2003,63(8):877-881.
[18]胡雪艳,陈海霞,高文远,等.泽泻化学成分的研究[J].中草药,2008,39(12):1788-1790.
[19]Shin M H,Yu J P,Kim K S,et al.The anti-inflammatory effects ofAlismaherb extract on allergic asthma mouse model[J].Mol Cell Toxicol,2014,10(2):197-206.
[20]Matsuda H,Kageura T,Toguchida I,et al.Effects of sesquiterpenes and triterpenes from the rhizome ofAlismaorientaleon nitric oxide production in lipopolysaccharide-activated macrophages:absolute stereostructures of alismaketones-B 23-acetate and -C 23-acetate[J].Bioorg Med Chem Lett,1999,(9):3081-3086.
[21]龚树生,张建军,曹广智,等.泽泻的历史及生物活性成分研究进展[J].山西中医学院学报,2000,1(1):28-30.
[22]罗张炎,周爱存,张朝凤,等.HPLC同时测定泽泻中4种泽泻醇成分的含量[J].中国中药杂志,2010,35(24):3306-3309.
[23]李行诺,马旭,楚楚,等.泽泻指纹图谱研究[J].浙江工业大学学报,2013,41(2):143-146.
[24]刘红昌,杨文钰,陈兴福.不同采收期泽泻化学成分动态变化的研究[J].中国中药杂志,2007,32(17):1807-1809.
[25]文红梅,李伟,彭国平,等.泽泻不同采收期23-乙酰泽泻醇B含量变化[J].中药材,1998,21(12):595-596.
[26]曹柳,李青苗,方清茂,等.3种炮制方法对泽泻中4种三萜类成分的影响[J].中成药,2016,38(9):1994-1998.
[27]郑云枫,朱玉岚,彭国平.泽泻炮制过程中23-乙酰泽泻醇B的转化[J].中草药,2006,37(10):1479-1482.
[28]彭贤,黄舒,郦皆秀,等.泽泻属植物化学成分与药理活性[J].国外医药·植物药分册,2000,15(6):245-247.
