头发诱导真菌产生蛋白的初步研究
2018-05-18黎晓丽赖维刘丽陈剑
黎晓丽 ,赖维 ,刘丽 ,陈剑
(1广州市妇女儿童医疗中心,广东 广州510623;2中山大学附属第三医院,广东 广州 510630;3河南省濮阳市油田总医院,河南 濮阳 457001)
头癣是一类真菌感染头皮、毛发的疾病,成人、儿童均可发病。头癣传染性强,呈世界性分布,散发或流行,可造成永久性脱发和头皮瘢痕,破坏美观,影响患者心理和社交[1]。头癣按病原菌种类可分为3类:黄癣、白癣、黑点癣。真菌虽然种类繁多,但能致头癣的真菌较少,如皮肤癣菌中部分毛癣菌和小孢子菌是头癣主要致病菌;皮肤癣菌中的絮状表皮癣菌,以及霉菌、念珠菌不易致头癣[2-3]。目前为止,头癣确切的发病机制及致病过程尚不清楚。
近年由于饲养家庭宠物及经济动物的增多,以及广谱抗生素、免疫抑制剂、生物制剂等药物的运用,头癣发病率有所回升[4]。既往认为真菌致头癣可能与其形态转变和宿主免疫有关[5],随着对蛋白酶作为真菌毒力因子之一的研究深入,推测头癣致病可能与蛋白酶有关,因此,本研究将真菌分为2组:头癣致病菌组和非致病菌组,采用体外液体诱导培养的方法,初步了解真菌在体外侵袭毛发后所致毛发的改变和所释放出的总蛋白量,释放出的蛋白作为蛋白酶分解的产物,与释放的蛋白酶正相关,通过对比总蛋白量初步判定各组蛋白酶的活性大小,为阐明头癣发病机制奠定基础。
1 材料与方法
1.1 实验分组 致病菌组:断发毛癣菌、许兰毛癣菌、石膏样小孢子菌、须癣毛癣菌,红色毛癣菌。
非致病菌组:短帚霉、絮状表皮癣菌。
对照组:①只加缓冲液及头发,不加真菌;②只加缓冲液及真菌,不加头发。毛发为未焗油的健康儿童头发,经高压消毒灭菌。
1.2 诱导缓冲液MgSO4(0.5g/L),K2HPO4(0.46g/L),KH2PO4(1.0 g/L),氯霉素注射液0.1 g/L,pH为7.0。
1.3 受试菌株的培养 将受试菌株在沙堡培养基上培养至菌落成熟,挑取适量菌配成浓度为5×106CFU/mL的菌悬液(产孢多菌-断发毛癣菌、红色毛癣菌、须癣毛癣菌、石膏样小孢子菌、短帚霉只取孢子;产孢少菌-絮状表皮癣菌、许兰毛癣菌取菌丝),取5 mL接种于含头发0.2 g的液体培养基(每瓶含25 mL缓冲液),25℃培养20周。
1.4 培养后上清液BCA法检测所含的总蛋白量
1.4.1 主要试剂盒、仪器 BCA蛋白定量标准试剂盒,酶标仪,光学显微镜。
1.4.2 实验主要步骤
1.4.2.1 观察培养后真菌菌量增长情况,光学显微镜下观察20周后各组头发改变。
1.4.2.2 配制BSA标准溶液-配制BCA工作液-加入标准蛋白样品及待测样品-酶标仪测定OD值-根据标准曲线计算蛋白浓度。
1.5 统计学处理 两独立样本比较的秩和检验,统计软件为SPSS 22.0。
2 结果
2.1 培养后真菌生长情况 红色毛癣菌、断发毛癣菌、石膏样小孢子菌、须癣毛癣菌:菌丝多,包饶毛发。絮状表皮癣菌、短帚霉、许兰毛癣菌:菌丝少,不包饶毛发。
2.2 各组毛发的变化 ①断发毛癣菌:大部分毛小皮掀起,毛刷状。②许兰毛癣菌:毛发外观基本完好,极少毛小皮掀起。③石膏样小孢子菌:部分毛小皮掀起,毛刷状,部分有穿孔,部分形态完全破坏。④须癣毛癣菌:部分毛小皮掀起,毛刷状,部分有穿孔,部分形态完全破坏。⑤红色毛癣菌:部分毛小皮掀起,毛刷状。⑥短帚霉:少数毛小皮掀起。⑦絮状表皮癣菌:少数毛小皮掀起。
2.3.1 20周后所得蛋白浓度 见表1。
2.3.2 秩和检验头癣致病菌组和非致病菌组总蛋白量,2组比较差异无统计学意义(P>0.05)。

图1 20周后头发变化情况

表1 20周后所得蛋白浓度g/L
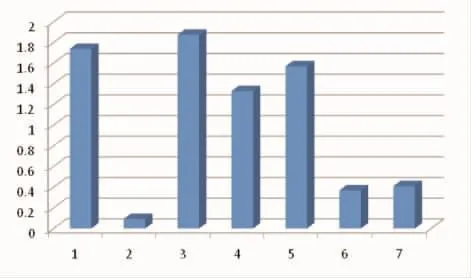
图2 诱导后所得总蛋白量对比图(单位:g/L)
3 讨论
1963年Mercer等[6]发现感染头发的须癣毛癣菌菌丝顶端的穿透器官可分泌出某种物质破坏头发的二硫键,从而逐渐消化头发,现这种物质被证实为蛋白酶。蛋白酶是皮肤癣菌致病的重要毒力因子,与其获得营养、扩大侵袭及诱导宿主免疫相关[7-8]。蛋白酶可分为酸、碱两类酶,多种真菌均可产生蛋白酶,蛋白酶的产生也需要底物的诱导,角蛋白底物诱导真菌产生蛋白酶会因底物或真菌种类的不同而不同[9]。Okafor等[10]曾对5种皮肤癣菌进行释放蛋白量的测定,结果显示所有受试皮肤癣菌均能降解头发,以石膏样小孢子菌最强,奥杜央小孢子菌最弱。Katiyar等[11]对比分离出的12种真菌以头发诱导30 d后释放的蛋白量,发现皮肤癣菌释放蛋白量和对头发破坏程度均比枝顶孢霉高。本实验以儿童头发为唯一氮源,采用体外液体培养方法对比释放的总蛋白量,20周后所测得的蛋白是因蛋白酶分解头发角蛋白而来,总量与蛋白酶活性成正相关,通过对比总蛋白量可初步对比真菌蛋白酶的活性,结果显示上清液中总蛋白量有差异,表明各种真菌诱导后蛋白酶活性不同,与既往国外实验结果一致;结合另外两个方面(毛发改变及真菌菌量变化)对比不同真菌对头发的降解力,证实了相同底物对蛋白酶水解的抵抗力有差异。
实验发现,第1组中许兰毛癣菌蛋白量、毛发改变在所有受试菌中最小,并且该菌不能从毛小皮处穿入头发,推测黄癣致病与毛干诱导的蛋白酶无关,而黄癣患者真菌镜检可见到发内及痂内均有孢子和菌丝,黄癣菌可能是先经皮肤或毛囊处感染,随着头发向外生长,真菌也被带出毛囊。絮状表皮癣菌和短帚霉蛋白量均低,毛发破坏轻,表明其对头发的侵袭力差,所以临床表现为不致头癣。另外,头癣致病菌除黄色毛癣菌外,均可将毛干分解为可溶性蛋白,笔者推测蛋白酶与黑点癣、白癣的发病有关,这一点尚有待扩大样本量来进一步证实。
总之,通过笔者以上研究发现,真菌在体外能分解头发使其释放出可溶性蛋白供真菌生长繁殖。各种真菌对头发的分解力有差异,头癣非致病菌对头发分解力均差,但并非所有头癣致病菌都显示强的头发分解能力,比如许兰黄癣菌,推测真菌蛋白酶可能参与某些类型头癣致病,但并不是唯一决定因素。近年来研究发现,由于角蛋白富含胱氨酸二硫键,其水解除了蛋白酶,还需半胱氨酸双加氧酶及亚硫氨酸盐流出泵的参与,前者还参与酵母形态到菌丝形式的过渡,并且是半胱氨酸氧化成半胱氨酸磺酸的关键,对亚硫酸盐的产生和分泌有重要作用,亚硫酸盐作为还原剂,可将部分角蛋白的胱氨酸二硫键裂解,因此半胱氨酸双加氧酶作为皮肤癣菌的另一致病因子成为一项研究热点[12-13]。真菌头癣致病的具体过程,其如何感染、生存,以及与宿主免疫、内环境的关系,值得进一步研究。
参考文献:
[1] 丁菲,李红宾.头癣的流行病学研究与治疗现状[J] .中国麻风皮肤病杂志 2011,27(7):492-494.
[2] Hamroune Z,Mazouz A,Benelmouffok AB,et al.Evolution of tineacapitis observed in mycology laboratory of institute Pasteur of Algeria from1995 to 2015[J] .J Mycol Med,2016,26:337-344.
[3] 毛叶红,何蒙文,郑岳臣,等.1960~2015年湖北及周边地区头癣病原菌变化情况分析[J] .中国真菌学杂志,2017,12(2):98-101.
[4] Khosravi AR,Shokri H,Vahedi G.Factors in etiology and predisposition of adult tinea capitis and review of published literature[J] .Mycopathologia,2016,181:371-378.
[5] Okuda C,Ito M,Sato Y,et al.Trichophyton rubrum invasion of human hair apparatus in tinea capitis and tinea barbae:light-and electron microscopic study[J] .Arch Dermatol Res,1991,283:233-239.
[6] Mercer E,Verma BS.Hair digested by Trichophyton mentagrophytes.An electron microscope examination[J] .Arch Dermatol,1963,87:357-360.
[7] Giudice M,Reis M,Rittner GM,et al.Isolation of Microsporum gypseum in soil samples from different geographical regions of brazil,evaluation of the extracellular proteolytic enzymes activities(keratinase and elastase) and molecular sequencing of selected strains[J] .Braz J Microbiol,2012,43:895-902.
[8] Kaufman G,Horwitz B,Duek L,et al.Infection stages of the der-matophyte pathogen Trichophyton:microscopic characterization and proteolytic enzymes[J] .Med Mycol,2007,45:149-155.
[9] Apprich V,Sperqser J,Rosenqarten R,et al.In vitro degradation of equine keratin by dermatophytes and other keratinophilic fungi[J] .Vet Microbiol,2006,114:352-358.
[10] Okafor JI,Ada N.Keratinolytic activity of five human isolates of the dermatophytes[J] .J Commun Dis,2000,32:300-305.
[11] Katiyar S,Kushwaha RK.Invasion and biodegradation of hair by house dust fungi[J] .Bio Biodegradation,2002,50:89-93.
[12] Grumbt M,Monod M,Yamada T,et al.Keratin degradation by dermatophytes relies on cysteine dioxygenase and a sulfite efflux pump[J] .J Invest Dermatol,2013,133:1550-1555.
[13] Kasperova A,Kunert J,Raska M.The possible role of dermatophyte cysteine dioxygenase in keratin degradation[J] .Med Mycol,2013,51:449-454.
