Calreticulin通过诱导细胞EMT促进鼻咽癌迁移和侵袭*
2018-05-17朱军辉张和良李承松罗招阳张志伟
朱军辉, 金 明, 邱 浩, 张和良, 马 为, 肖 玄, 李承松, 罗招阳, 张志伟△
(南华大学 1医学院肿瘤研究所, 肿瘤细胞与分子病理学湖南省重点实验室; 2医学院临床医学系, 湖南 衡阳 421001)
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国南方及东南亚地区常见的恶性肿瘤[1]。NPC细胞侵袭与转移是导致患者复发与预后差的最主要原因,在NPC中上皮-间充质转化(epithelial-mesenchymal transition,EMT)是其侵袭和转移的重要环节[2]。EMT与恶性肿瘤的侵袭和转移密切相关。EMT的发生常伴随多个细胞分子标志物改变,如上皮细胞标志物上皮型钙黏蛋白(E-cadherin)的下调和间质细胞标志物波形蛋白(vimentin)的表达上调等[3]。前期我们通过蛋白组学方法筛选鉴定出EMT相关蛋白质——钙网蛋白(calreticulin,CRT)[4]。CRT是一种内质网常驻蛋白,在包括乳腺癌、胃癌在内的多种恶性肿瘤中表达上调,其表达水平与肿瘤的迁移侵袭密切相关[5]。本文检测CRT在鼻咽癌组织中的表达情况,并探究CRT表达对鼻咽癌细胞EMT及迁移侵袭的影响。
材 料 和 方 法
1 病例资料
收集湖南省肿瘤医院病理科44例鼻咽癌组织、24例鼻咽部息肉增生及炎症、30例鼻咽部乳头状瘤组织,另有8例鼻咽癌组织来自南华大学附属第二医院病理科,3例鼻咽部炎症黏膜来自南华大学病理教研室。鼻咽癌组织中鳞状细胞癌45例,基底细胞癌3例,腺样囊性癌2例,未分化癌2例;患者年龄32~79岁,平均年龄52.5岁,其中男性37例,女性15例;I期20例(38.5%);II~III期32例(61.5%)。鼻咽部非癌组织中,男性41例,女性16例,年龄31~77岁,平均年龄55.3岁。
2 实验材料
鼻咽癌CNE2细胞由南华大学肿瘤研究所提供。用含10%胎牛血清(杭州四季青)的RPMI-1640(HyClone)培养。
CRT基因小干扰RNA(CRTsmall interfering RNA,si-CRT)购自广州锐博公司;抗CRT抗体购自CST;基质金属蛋白酶(matrix metalloproteinase,MMP)-9和转化生长因子(transforming growth factor,TGF)-β抗体购自Epitomics;抗E-cadherin和vimentin抗体购自中杉金桥公司;S-P法免疫组织化学染色试剂盒购于福建迈新生物公司。
3 实验方法
3.1免疫组化检测calreticulin的表达 按免疫组化S-P法对鼻咽癌组织和鼻咽部良性病变组织切片行抗原修复,I 抗 calreticulin(1∶500)4 ℃孵育过夜。DAB显色。复染、冲洗、分化、返蓝、脱水、封片。随机选取每张切片的4个视野(×400),IPP 6.0软件计算每个视野的阳性细胞数及细胞总数,每个视野随机计数100个细胞,计算阳性细胞百分率,用分值表示:不表达为0分,≤10%为1分,10%~50%为2分,≥50%为3分。染色强度无色为1分,黄色为2分,棕褐色为3分。采用积分综合计量,总分值=着色强度分值×着色细胞分值。总分值为0表示阴性表达,1~3分为阳性表达。着色癌细胞数>5%判断为阳性。
3.2细胞瞬时转染实验 将生长状态良好的CNE2细胞以每孔2×105接种至6孔板中,培养24 h后进行转染,同时转染阴性对照siRNA (si-control)为对照组。转染24 h后于荧光显微镜下观察转染效率。瞬时转染48 h后用倒置显微镜观察细胞形态的变化,收集蛋白用于后续实验。
3.3Western blot检测蛋白水平 收集细胞,充分裂解,提取细胞总蛋白,测定蛋白浓度。将蛋白进行8% SDS-PAGE分离(β-actin为10%分离胶),将分离的蛋白质转至PVDF膜上,脱脂牛奶封闭, I抗[calreticulin(1∶4 000),E-cadherin和MMP-9(1∶1 500),TGF-β(1∶1 500),vimentin(1∶2 000),β-actin(1∶1 500)]孵育过夜,洗膜,II 抗(1∶2 000)室温孵育2 h,洗膜、发光、压片、曝光、显影与定影,进行蛋白质表达的灰度分析,以β-actin为内参照计算待测蛋白质的相对表达量。
3.4Transwell迁移实验 纤维连接蛋白(10 mg/L)处理Transwell小室底部膜30 min。随后在小室上部(每组置3复孔)加入无血清的细胞悬液200 μL(细胞密度为2×108/L)。24孔板下室加入500 μL无血清的DMEM培养液,37 ℃、5% CO2细胞培养箱培养24 h,清洗小室、4%多聚甲醛固定。Transwell小室底部膜切割下来,30%甘油封片。0.1%结晶紫对下室的每孔进行染色。倒置显微镜下对微孔过滤器下层的每个样本中央及周边进行计数,用400倍显微观察,同时随机选择10个视野观察迁移细胞进行计数及统计分析。
3.5Transwell侵袭实验 将Transwell小室的上室面用Matrigel (1 g/L;BD)包被,37 ℃温箱放置1 h使Matrigel形成凝胶。其余步骤及计数方法基本同Transwell迁移实验,以侵入微孔过滤器下的侵袭细胞的平均数表示细胞的侵袭能力。
4 统计学处理
用SPSS 18.0统计软件进行数据处理和统计分析。数据采用均数±标准差(mean±SD)表示,t检验作2组之间的比较,相关性检验用Spearman秩相关分析,以P<0.05 表示差异有统计学意义。
结 果
1 Calreticulin在鼻咽癌组织中的表达情况
S-P免疫组化法结果表明:calreticulin在鼻咽癌组织的阳性表达率(43/52,82.69%)较鼻咽部良性病变组织的阳性表达率(11/57,19.29%)显著增高(P<0.05),见图1。

Figure 1. The expression of calreticulin in nasopharyngeal carcinoma tissues and benign tissues detected by the me-thod of immunohistochemistry (×400). A: benign tissue; B: nasopharyngeal carcinoma tissue.
图1Calreticulin在鼻咽癌组织及良性病变组织中的表达情况
2 Calreticulin在鼻咽癌组织中表达的意义
本研究发现,在52例鼻咽癌样本中,临床分期为II~III期和淋巴结发生转移的鼻咽癌组织中calreticulin的表达阳性率均分别高于临床分期为I期和未发生淋巴结转移的鼻咽癌组织(P<0.05)。相关分析显示CRT表达与鼻咽癌临床分期及淋巴结转移呈正相关,但是calreticulin阳性率在不同性别和不同年龄的患者当中并无差别,见表1。
表1Calreticulin与临床病理参数的关系
Table 1. The relationship between calreticulin and clinicopathological parameters

ClinicopathologicalparametersnCalreticulinexpressionrPSex Male3731(83.78%)0.0870.450 Female1512(80.00%)Age ≥601411(78.57%)0.0750.574 <603832(84.21%)Clinicalstage I2012(60.00%)0.4570.013 II~III3231(96.87%)Lymphaticmetastasis Yes3332(96.96%)0.3820.018 No1911(57.89%)
3 Calreticulin低表达对CNE2细胞形态的影响
转染si-control的对照组细胞为扁长梭形和纺锤体样形态,细胞排列较松散;转染si-CRT 48 h后部分细胞由原来的长梭形和纺锤体样转变为椭圆形和鹅卵石样形态,细胞排列紧密,见图2。
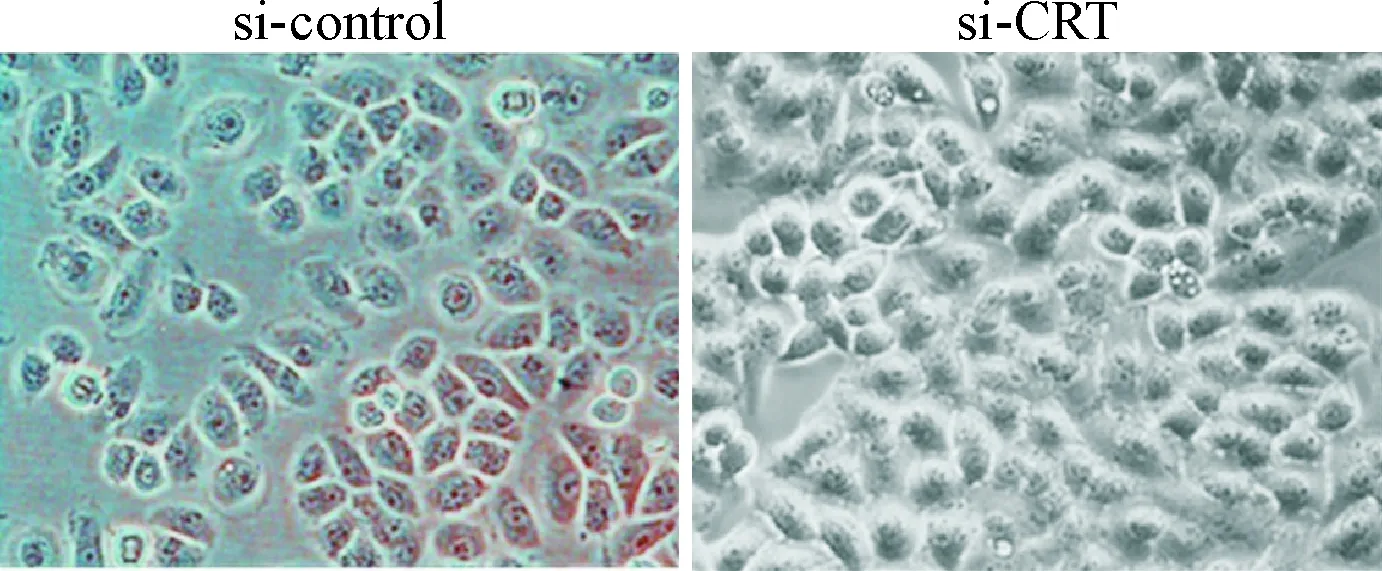
Figure 2. The morphological changes of the CNE2 cells (48 h after transfection, ×200).
图2si-CRT转染48h后光镜下观察CNE2细胞形态学的变化
4 CRT低表达对vimentin、MMP-9、TGF-β和E-cadherin表达的影响
转染si-CRT 48 h后,Western blot结果显示,敲降CRT表达后,与对照组相比,CNE2细胞中E-cadherin蛋白的表达显著上调(P<0.05),而vimentin、MMP-9和TGF-β蛋白的表达显著下调(P<0.05),见图3。
5 CRT低表达对CNE2细胞迁移与侵袭的影响
转染si-CRT 48 h后,Transwell迁移和侵袭实验结果显示calreticulin低表达组迁移细胞和侵袭细胞数目减少,迁移率和侵袭率低于对照组,提示calreticulin低表达后CNE2细胞的迁移和侵袭能力明显降低(P<0.05),见图4。
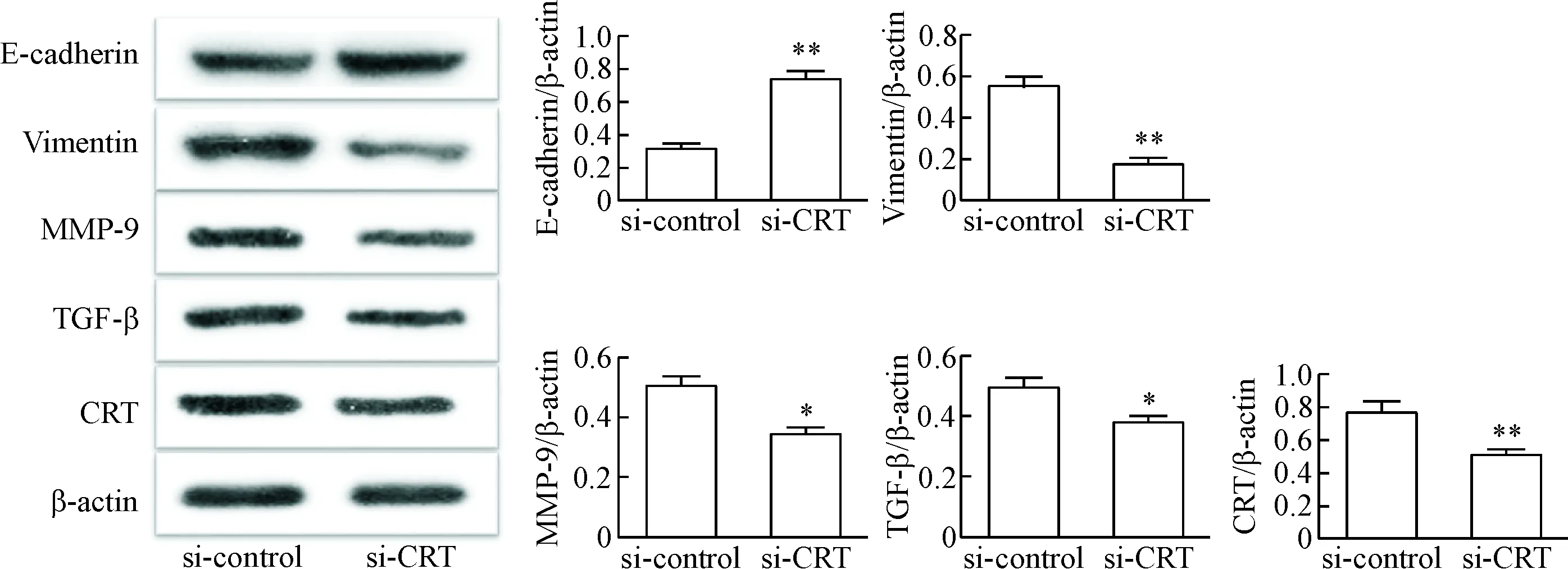
Figure 3. Western blot results for determining EMT-related proteins (48 h after transfection).*P<0.05,**P<0.01vssi-control group.
图3EMT相关蛋白的Westernblot检测结果

Figure 4. The migration and invasion abilities of CNE2 cells detected by Transwell assay (48 h after transfection, ×400).**P<0.01vssi-control group.
图4Transwell迁移和侵袭实验结果
讨 论
大量研究表明CRT在人类多种疾病,尤其是恶性肿瘤中异常表达。在乳腺癌[6]和胃癌[7]的研究中发现CRT 呈过表达,且CRT的表达水平与它们的临床分期和淋巴结转移呈正相关。Lee等[8]研究也发现,CRT表达上调与肿瘤大小和远端转移有关。在胰腺癌中CRT通过MEK/ERK信号通路的激活来促进肿瘤细胞迁移和侵袭[8]。可见CRT在多种肿瘤中存在表达上调,CRT表达与肿瘤进展、迁移、侵袭密切相关。综合上述研究结果,我们推测CRT与鼻咽癌细胞EMT密切相关。
本研究采用免疫组织化学方法检测鼻咽癌和鼻咽良性病变组织中CRT蛋白的表达,发现鼻咽癌组织中CRT蛋白表达明显增高,其表达与鼻咽癌临床分期及淋巴转移呈正相关,表明CRT蛋白可能参与鼻咽癌的发生发展过程,CRT表达与不良预后相关。有趣的是在神经母细胞瘤中,CRT高表达与更好的病理学分化类型相关,CRT阳性患者5年生存率远高于CRT阴性患者[9];在浆液性卵巢癌中,CRT表达阳性的患者对化疗更为敏感[10]。因此,CRT的功能具有双重性,对肿瘤形成和进展的影响可能取决于不同的细胞类型和临床阶段。
肿瘤细胞浸润和转移涉及许多不同的过程,EMT作为其中关键的步骤,被认为鼻咽癌侵袭和转移的重要环节[2]。先前的研究已经表明在胃癌、胰腺癌、前列腺癌和卵巢癌中CRT过表达有助于肿瘤的转移。目前缺乏CRT直接调控EMT的证据。整合素依赖路径可能是其中的一种,CRT是少数可以直接与整合素α亚基结合的胞质蛋白,在钙网蛋白高表达的上皮间质转化样细胞中,整合素依赖的细胞黏附明显受到了影响,CRT可能通过与整合素α的结合影响EMT的发生[11]。有研究表明表达不同水平的钙网蛋白,对细胞外基质(extracellular matrix,ECM)蛋白尤其是纤连蛋白的合成影响显著,钙网蛋白通过调节纤连蛋白表达和ECM沉积介导细胞黏附[12]。EMT发生时常伴随ECM蛋白的改变,如纤连蛋白的上调,这表明CRT可能通过调控ECM的表达影响EMT。另外,CRT通过调控多条信号通路介导EMT的发生。TGF-β信号通路是诱导EMT发生的经典通路,最新的研究表明,CRT能够与TGF-β受体Ⅰ和Ⅱ相互作用,在CRT的存在下,TGF-β通过介导糖原合成酶激酶3β的失活,促进Snail2/Slug对E-cadherin的抑制[13]。在Madin-Darby犬肾细胞中过表达CRT后,转录因子Slug与E-cadherin启动子区域的E盒顺式作用元件结合增强,E-cadherin的表达下调,即CRT通过Slug/E-cadherin通路诱导EMT的发生[14]。另外,CRT还能与内质网蛋白57相互作用形成复合体,而内质网蛋白57参与调控EMT相关受体EGFR的内化和磷酸化,EGFR诱导EMT的信号通路可能是CRT调控EMT的一种路径[15-17]。我们前期构建了CRT高表达载体,观察到CNE2细胞过表达CRT后发生EMT改变,其迁移侵袭能力增强[18]。本研究通过构建si-CRT干扰载体抑制CNE2细胞中CRT表达后,鼻咽癌细胞的迁移和侵袭能力减弱,CNE2细胞的EMT受到抑制。
综上所述,本研究结果初步证实与大多数实体肿瘤一样,鼻咽癌组织中CRT高表达,且与临床分期和淋巴结转移呈正相关。CRT可通过诱导EMT的发生促进鼻咽癌的恶性表型转化。目前,CRT促肿瘤细胞侵袭和转移的分子机制,以及相关信号通路等尚不清楚,其在鼻咽癌治疗中的应用价值有待进一步深入研究。
[参 考 文 献]
[1] Si Y, Lan G, Deng Z, et al. Distribution and clinical significance of circulating tumor cells in nasopharyngeal carcinoma[J]. Jpn J Clin Oncol, 2016, 46(7):622-630.
[2] Cai LM, Lyu XM, Luo WR, et al. EBV-miR-BART7-3p promotes the EMT and metastasis of nasopharyngeal carcinoma cells by suppressing the tumor suppressor PTEN[J]. Oncogene, 2015, 34(17):2156-2166.
[3] Nieto MA, Huang RY, Jackson RA, et al. EMT: 2016[J]. Cell, 2016, 166(1):21-45.
[4] 张志伟,张 琼,刘洁琼,等. EB病毒LMP1促鼻咽上皮细胞增殖的蛋白分子鉴定[J]. 中国病理生理杂志, 2010, 26(2):287-292.
[5] Lu YC, Weng WC, Lee H. Functional roles of calreticulin in cancer biology[J]. Biomed Res Int, 2015, 2015:526524.
[6] Lwin ZM, Guo C, Salim A, et al. Clinicopathological significance of calreticulin in breast invasive ductal carcinoma[J]. Mod Pathol, 2010, 23(12):1559-1566.
[7] Chen CN, Chang CC, Su TE, et al. Identification of calreticulin as a prognosis marker and angiogenic regulator in human gastric cancer[J]. Ann Surg Oncol, 2009, 16(2):524-533.
[8] Lee HH, Lim CA, Cheong YT, et al. Comparison of protein expression profiles of different stages of lymph nodes metastasis in breast cancer[J]. Int J Biol Sci, 2012, 8(3):353-362.
[9] Hsu WM, Hsieh FJ, Jeng YM, et al. Calreticulin expression in neuroblastoma: a novel independent prognostic factor[J]. Ann Oncol, 2005, 16(2):314-321.
[10] Vaksman O, Davidson B, Tropé C, et al. Calreticulin expression is reduced in high-grade ovarian serous carcinoma effusions compared with primary tumors and solid metastases[J]. Hum Pathol, 2013, 44(12):2677-2683.
[11] Ihara Y, Inai Y, Ikezaki M. Alteration of integrin-depen-dent adhesion and signaling in EMT-like MDCK cells established through overexpression of calreticulin[J]. J Cell Biochem, 2011, 112(9):2518-2528.
[12] Papp S, Fadel MP, Kim H, et al. Calreticulin affects fibronectin-based cell-substratum adhesion via the regulation of c-Src activity[J]. J Biol Chem, 2007, 282(22):16585-16598.
[13] Karimzadeh F, Opas M. Calreticulin is required for TGF-β-induced epithelial-to-mesenchymal transition during cardiogenesis in mouse embryonic stem cells[J]. Stem Cell Rep, 2017, 8(5):1299-1311.
[14] Hayashida Y, Urata Y, Muroi E, et al. Calreticulin represses E-cadherin gene expression in Madin-Darby canine kidney cells via Slug[J]. J Biol Chem, 2006, 281(43):32469-32484.
[15] Liu XL, Zhang XT, Meng J, et al. ING5 knockdown enhances migration and invasion of lung cancer cells by inducing EMT via EGFR/PI3K/Akt and IL-6/STAT3 signaling pathways[J]. Oncotarget, 2017, 8(33):54265-54276.
[16] Gaucci E, Altieri F, Turano C, et al. The protein ERp57 contributes to EGF receptor signaling and internalization in MDA-MB-468 breast cancer cells[J]. J Cell Biochem, 2013, 114(11):2461-2470.
[17] Xu Q, Chen C, Lin A, et al. Endoplasmic reticulum stress-mediated membrane expression of CRT/ERp57 induces immunogenic apoptosis in drug-resistant endometrial cancer cells[J]. Oncotarget, 2017, 8(35):58754-58764.
[18] 金 明. 钙网蛋白对鼻咽癌细胞EMT的影响[D]. 衡阳: 南华大学, 2016.
