右美沙芬抗抑郁作用及其机制研究*
2018-05-17周凤玲朱凡河
林 娜, 柳 洋, 祁 晖, 周凤玲, 朱凡河
(1济宁医学院基础医学院, 山东 济宁 272067; 2青岛市第九人民医院, 山东 青岛 266000; 3济宁市第一人民医院心电图室, 山东 济宁 272002)
抑郁症是一种非常严重的精神疾病,其高发性已经使其成为危害公共健康的主要精神疾病[1]。目前常用的抗抑郁药由于神经适应并未达到预期治疗效果,如三环类抗抑郁药只能对60%~70%的抑郁症患者产生疗效,因此研发有效抗抑郁症药物及探究其机制已经成为目前精神疾病研究的重点[2]。
大量研究表明谷氨酸参与抑郁症的病理生理过程[3]。对自杀的抑郁症患者解剖发现,死者额叶皮层谷氨酸水平较高[4],并且海马内N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体亚型1活性改变[5]。有研究表明,NMDA受体拮抗剂氯胺酮具有治疗抑郁症的潜在作用[6]。临床研究发现,抑制NMDA受体活性的药物能够抗抑郁[7],长期应用药物治疗抑郁症能够引起NMDA受体活性改变[6]。
与氯胺酮相类似的是镇咳剂右美沙芬(dextromethorphan,DXM),也能够抑制NMDA受体活性[8]。目前抗抑郁效果最好的药物是氯胺酮,但是由于氯胺酮有致幻性等严重副作用,并且极易分解,只能静脉输注,所以使用较为受限[6]。由于DXM能够与NMDA受体信号相互作用[9],并且通过5-羟色胺转运体和sigma-1受体等产生作用[8],所以DXM具有比氯胺酮更强的抗抑郁作用[9]。且与氯胺酮相比,已经上市几十年的止咳药DXM更为安全且方便。有研究表明,DXM具有抗抑郁作用,能够促进强迫游泳实验(forced swimming test,FST)中小鼠的活动[10],而FST是评价抗抑郁药物的经典方法[11]。
NMDA受体能够激活一氧化氮合酶(nitric oxide synthase,NOS)从而促进L-精氨酸(L-arginine, L-ARG)转化为一氧化氮(nitric oxide,NO)[12]。NO广泛参与如癫痫、神经可塑性、瘙痒、疼痛和抑郁等多种生理和病理过程[13]。研究表明NOS抑制剂能够抗抑郁[13]。NO能够调节可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC)活性,鸟苷酸环化酶是一种能够催化三磷酸鸟苷(guanosine triphosphate,GTP)转化为环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)的酶。cGMP是中枢和外周循环中重要的第二信使,具有多种功能[14]。动物实验发现抑制NOS和sGC等蛋白的转化能够产生抗抑郁的作用[15]。尽管已经有研究表明DXM能够促进FST中小鼠的活动,但是尚不明确其作用机制[16]。
本研究拟采用不同行为实验探究DXM抗抑郁的机制,为抑郁症治疗提供新的研究方向。
材 料 和 方 法
1 实验动物与药物
成年雄性昆明小鼠,动物许可证编号为SCXK(鲁)2008-0002,饲养于室温(25±2) ℃,12 h循环光照,自由饮食的环境。右美沙芬、抗抑郁药氟西汀(fluoxetine, FLU)、NMDA受体拮抗剂MK-801(MK)、NMDA受体激动剂NMDA、NO前体L-ARG、内皮型NOS(endothelial NOS,eNOS)抑制剂Nω-硝基-L-精氨酸甲酯(Nω-nitro-L-arginine methyl ester, L-NAME)、诱导型NOS(inducible NOS,iNOS)抑制剂氨基胍(aminoguanidine, AG)和磷酸二酯酶5(phosphodiesterase 5, PDE5)抑制剂西地那非(sildenafil)均溶于生理盐水(normal saline, NS),神经元型NOS(neuronal NOS,nNOS)抑制剂7-硝基吲唑(7-nitroindole, 7-NI)溶于Tween-80。
2 实验分组及方法
2.1抑郁小鼠模型构建 每天8:00~12:00和18:00~20:00对小鼠进行束缚加噪声刺激(25 Hz),小鼠束缚装置为50 mL离心管,头尾分别留有直径约5 mm的圆孔,一端供小鼠呼吸,另一端便于小鼠尾巴活动,连续刺激5 d,构建抑郁小鼠模型[17]。
2.2DXM对抑郁小鼠行为的影响 随机选取50只抑郁小鼠,分为5组,每组10只,在实验开始前分别向小鼠腹腔注射DXM (3、10和30 mg/kg)[10]、NS以及氟西汀(20 mg/kg)。给药30 min后进行动物强迫游泳实验[18]、悬尾实验(tail suspension test,TST)[16]、以及旷场实验(open field test,OFT)[18]。实验结束后小鼠断头取脑,以ELISA法分别测定总NOS、iNOS、eNOS以及nNOS的含量。
2.3DXM对抑郁小鼠脑NMDA受体活性的影响 随机选取40抑郁只小鼠,分为4组,每组10只,分别向小鼠腹腔注射DXM (3、10和30 mg/kg)[10]和NS,注射后30 min处死小鼠取脑,放射标记受体测定法测定NMDA受体活性,以[3H]标记的MK801为标记配体。小鼠取脑加入50 mmol/L的TAB后高速分散器离心3次,制成含NMDA受体的突触粗膜悬液,用缓冲液稀释后调整蛋白浓度为(1~2)×106μg/L。取100 μL突触膜稀释液加入200 μL 50 mmol/L的TAB缓冲液。在非特异性结合管中加入100 μL 30 μmol/L的MK801和100 μL 50 mmol/L的TAB,每管加入10 μL[3H]-MK801。每个样品作平行双管。然后在30 ℃环境下孵育30 min。反应结束后,用4 ℃、50 mmol/L的TAB缓冲液5 mL,负压抽滤于纤维素滤膜,并用预冷的50 mmol/L的TAB缓冲液20 mL分3次洗涤。将滤膜转入计数杯,加入甲苯-Triton X-100闪烁液,于闪烁液计数仪上测定滤膜上的每分钟闪烁计数(min-1)。结合突触膜蛋白质浓度,计算[3H]-MK801的结合量(以每毫克蛋白质结合的[3H]-MK801的克分子数表示)。采用考马斯亮蓝法测定突触膜中的蛋白质浓度。计算公式为:特异性结合量[fmol/(mg protein)]=(样品总结合闪烁计数-非特异性结合闪烁计数)/总闪烁计数×每管配基的fmol数/样品蛋白的mg数。
2.4NMDA受体拮抗剂促进DXM抗抑郁效应 随机选取40只抑郁小鼠,分为4组,每组10只: (1)NS组:腹腔注射生理盐水15 min后再注射生理盐水;(2)DXM组:腹腔注射生理盐水15 min后再注射DXM (3 mg/kg);(3)MK组:腹腔注射MK (0.05 mg/kg)[18]15 min后再注射生理盐水;(4)MK/DXM组:腹腔注射MK (0.05 mg/kg)[18]15 min后再注射DXM (3 mg/kg)。给药30 min后进行动物强迫游泳实验[18]、悬尾实验[16]及旷场实验[18]。
2.5NMDA受体激动剂抑制DXM抗抑郁效应 随机选取40只小鼠,分为4组,每组10只:(1)NS组:腹腔注射生理盐水15 min后再注射生理盐水;(2)DXM组:腹腔注射生理盐水15 min后再注射DXM (30 mg/kg);(3)NMDA组:腹腔注射NMDA (75 mg/kg)[16]15 min后再注射生理盐水;(4)NMDA/DXM组:腹腔注射NMDA (75 mg/kg)[16]15 min后再注射DXM (30 mg/kg)。给药30 min后进行动物强迫游泳实验[18]、悬尾实验[16]及旷场实验[18]。
2.6NO前体L-精氨酸抑制DXM抗抑郁效应 随机选取40只抑郁小鼠,分为4组,每组10只:(1)NS组:腹腔注射生理盐水15 min后再注射生理盐水;(2)DXM组:腹腔注射生理盐水15 min后再注射DXM (30 mg/kg);(3)L-ARG组:腹腔注射L-ARG (750 mg/kg)[19]15 min后再注射生理盐水;(4)L-ARG/DXM组:腹腔注射L-ARG (750 mg/kg)[19]15 min后再注射DXM (30 mg/kg)。给药30 min后进行动物强迫游泳实验[18]、悬尾实验[16]及旷场实验[18]。
2.7NOS抑制剂促进DXM抗抑郁效应 随机选取100只抑郁小鼠,分为10组,每组10只:(1)NS组:腹腔注射生理盐水15 min后再注射生理盐水;(2)NS/DXM组腹腔注射生理盐水15 min后再注射DXM (3 mg/kg);(3)L-NAME组:腹腔注射L-NAME (10 mg/kg)[19]15 min后再注射生理盐水;(4)L-NAME/DXM组:腹腔注射L-NAME (10 mg/kg)[19]15 min后再注射DXM (3 mg/kg);(5)Tween-80组:腹腔注射Tween-80 15 min后再注射生理盐水;(6)Tween-80/DXM组:腹腔注射Tween-80 15 min后再注射DXM (3 mg/kg);(7)7-NI组:腹腔注射7-NI (30 mg/kg) 15 min后再注射生理盐水;(8)7-NI/DXM组:腹腔注射7-NI (30 mg/kg)[19]15 min后再注射DXM (3 mg/kg);(9)AG组:腹腔注射AG (50 mg/kg)[15]15 min后再注射生理盐水;(10)AG/DXM组:腹腔注射AG (50 mg/kg)[15]15 min后再注射DXM (3 mg/kg)。给药30 min后进行动物强迫游泳实验[18]、悬尾实验[16]及旷场实验[18]。
2.8cGMP抑制DXM抗抑郁效应 随机选取40只抑郁小鼠,分为4组,每组10只:(1)NS组:腹腔注射生理盐水15 min后再注射生理盐水;(2)DXM组:腹腔注射生理盐水15 min后再注射DXM (30 mg/kg);(3)sildenafil组:腹腔注射西地那非(5 mg/kg)[20]15 min后再注射生理盐水;(4)sildenafil/DXM组:腹腔注射西地那非(5 mg/kg)[20]15 min后再注射DXM (30 mg/kg)。给药30 min后进行动物强迫游泳实验[18]、悬尾实验[16]及旷场实验[18]。
3 统计学处理
数据统计分析使用Prism 5.0软件。实验中数据以均数±标准误(mean±SEM)表示,组间比较使用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 DXM对抑郁小鼠行为的影响
与生理盐水组相比,DXM(10、30 mg/kg)组小鼠在FST和TST中静止时间均减少且呈量效依赖关系(P<0.05或P<0.01),表现出与氟西汀(20 mg/kg)组小鼠相似的静止时间减少,见图1A、B。但在OFT中,各组小鼠运动的差异无统计学显著性,见图1C。
2 DXM对抑郁小鼠脑内NMDA受体活性的影响
与生理盐水组相比,中、高剂量DXM组小鼠脑内NMDA受体活性下降(P<0.05或P<0.01),且呈量效依赖关系,低剂量DXM组小鼠NMDA受体活性虽有下降但差异无统计学显著性,见图2。
3 NMDA受体对DXM抗抑郁作用的影响
与DXM组相比,MK/DXM组小鼠在FST和TST中静止时间明显减少(P<0.01),见图3A、B。但在OFT中,小鼠运动的差异无统计学显著性,见图3C。
与生理盐水组相比,DXM组小鼠在FST和TST中静止时间减少(P<0.01);与DXM组小鼠相比,NMDA/DXM组小鼠在FST和TST中静止时间增多(P<0.05),见图3D、E。在OFT中,各组小鼠运动的差异无统计学显著性,见图3F。
4 DXM对抑郁小鼠脑内NOS含量的影响
与生理盐水组相比,中、高剂量DXM组小鼠脑内NOS总量下降(P<0.05或P<0.01),且呈量效依赖关系,低剂量DXM组小鼠脑内NOS总量虽有下降但是无统计学意义,见图4A;与生理盐水组相比,

Figure 1. The effects of dextrometrophan (DXM) and fluoxetine (FLU, 20 mg/kg) on the behaviors of depressed mice. A: forced swimming test (FST); B: tail suspension test (TST); C: open field test (OFT). Mean±SEM.n=10.*P<0.05,**P<0.01vsNS group;#P<0.05vs10 mg/kg DXM group.
图1DXM对抑郁小鼠行为的影响
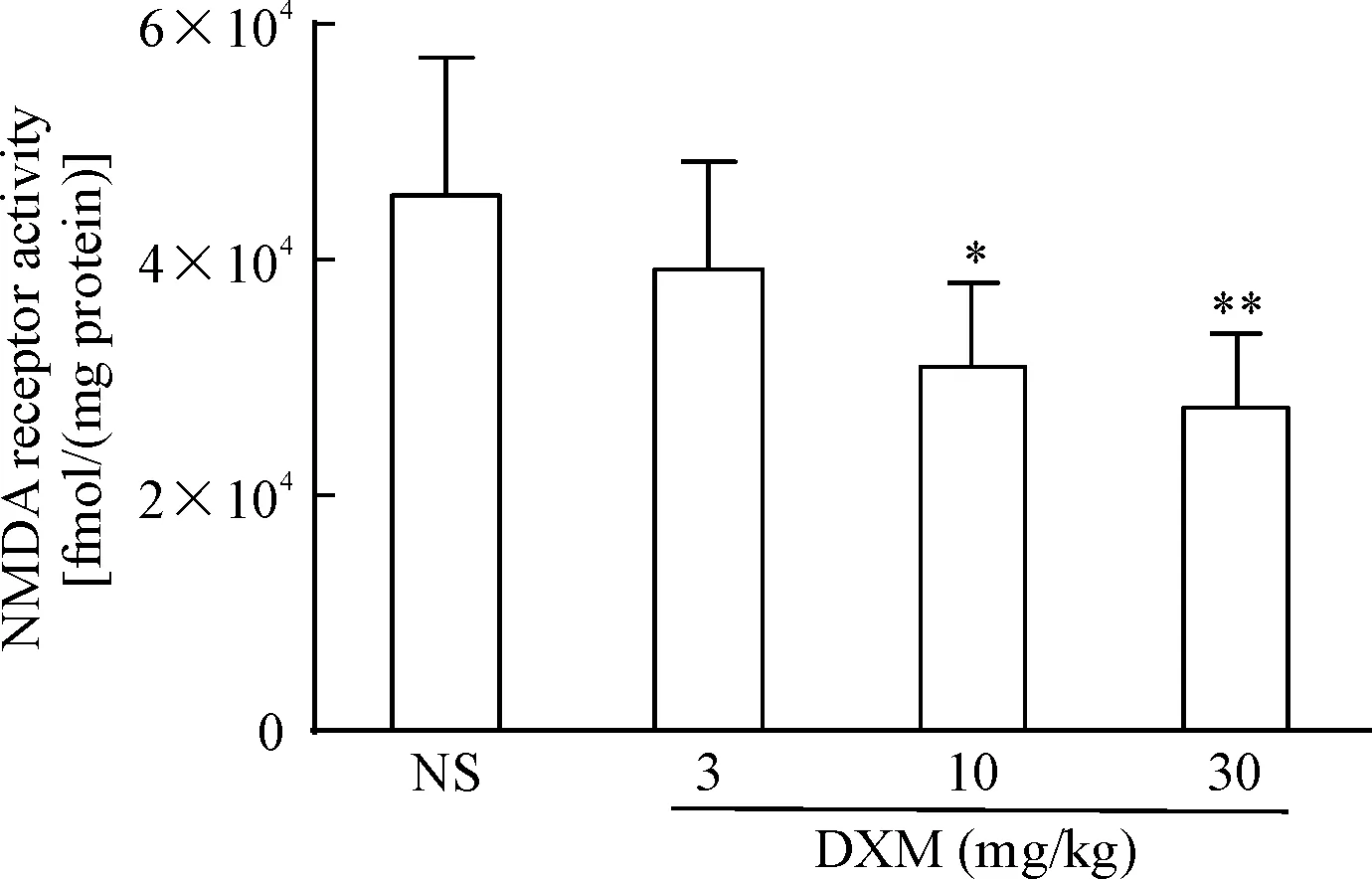
Figure 2. The effect of DXM on NMDA receptor activity in the brain of depressed mice. Mean±SEM.n=10.*P<0.05,**P<0.01vsNS group.
图2DXM对抑郁小鼠脑内NMDA受体活性的影响
中、高剂量DXM组小鼠脑内eNOS总量下降(P<0.05或P<0.01),且呈量效依赖关系,低剂量DXM组小鼠脑内eNOS总量虽有下降但差异无统计学显著性,见图4B;与生理盐水组相比,中、高剂量DXM组小鼠脑内nNOS总量下降(P<0.05或P<0.01),且呈量效依赖关系,低剂量DXM组小鼠脑nNOS总量虽有下降但差异无统计学显著性,见图4C;与生理盐水组相比,各剂量DXM组小鼠脑内iNOS总量下降虽有下降但是差异无统计学显著性,见图4D。
5 NO对DXM抗抑郁作用的影响
与生理盐水组相比,DXM组小鼠在FST和TST中静止时间减少(P<0.01);DXM组小鼠相比,L-ARG/DXM组小鼠在FST和TST中静止时间增多(P<0.01),见图5A、B。在OFT中,各组小鼠运动的差异无统计学显著性,见图5C。
6 NOS抑制剂对DXM抗抑郁作用的影响
与DXM组相比,L-NAME/DXM组小鼠在FST和TST中静止时间明显减少(P<0.01),见图6A、B。但在OFT中,小鼠运动无明显差异,见图6C。
与Tween-80/DXM组相比,7-NI/DXM组小鼠在FST和TST中静止时间明显减少(P<0.05),见图7A、B。但在OFT中,小鼠运动无明显差异,见图7C。
在FST、TST及OFT中,给予AG后各组小鼠运动无明显差异,见图8。
7 cGMP对DXM抗抑郁作用的影响
与生理盐水组相比,DXM组小鼠在FST和TST中静止时间减少(P<0.01);与DXM组相比,西地那非/DXM组小鼠在FST和TST中静止时间增多(P<0.01),见图9A、B。在OFT中,各组小鼠运动的差异无统计学显著性,见图9。
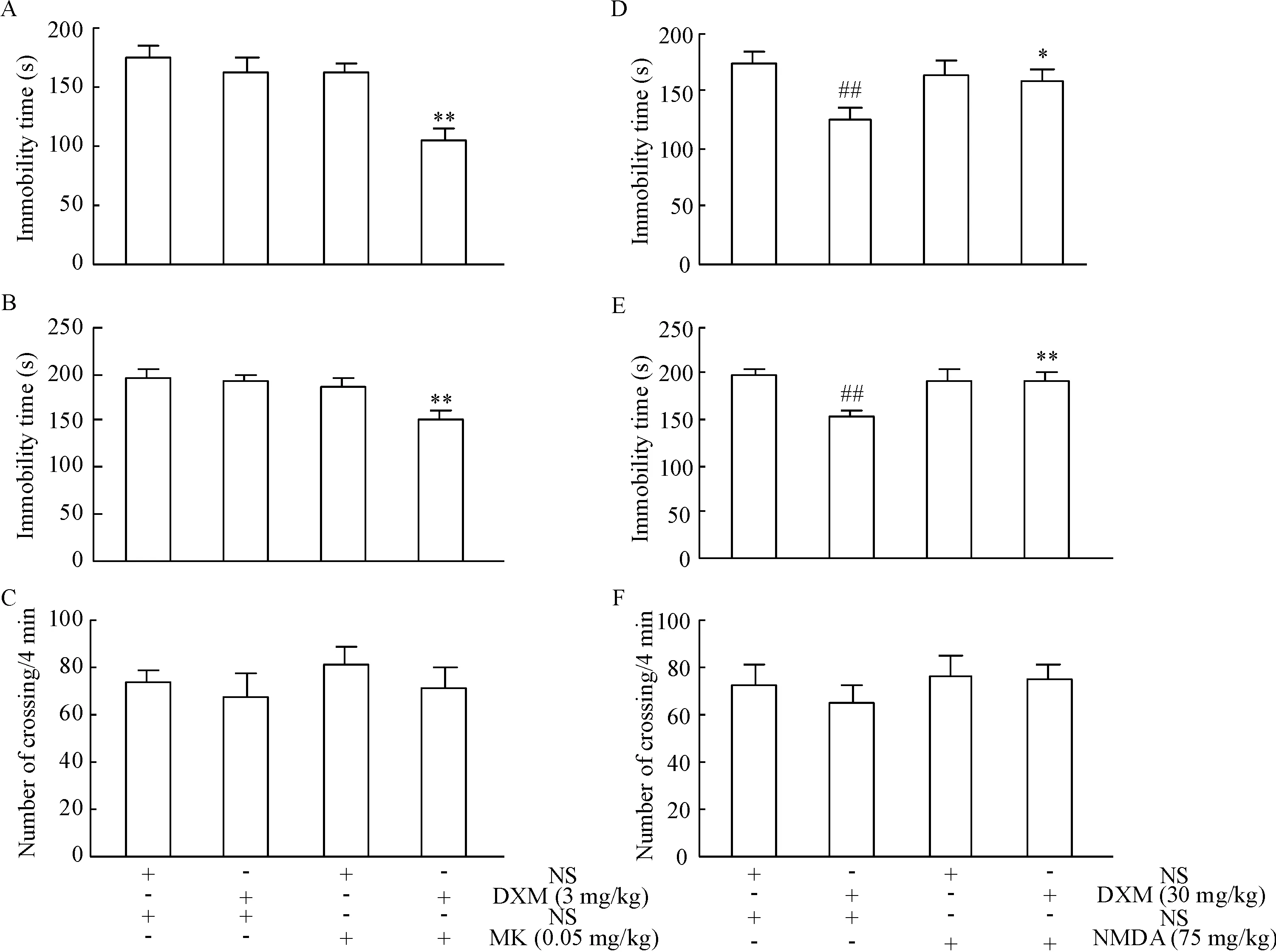
Figure 3. The role of NMDA receptor in the antidepressant effect of DXM. A~C: the effect of NMDA receptor antagonist MK-801 (MK); D~F: the effect of NMDA. A, D: FST; B, E: TST; C, F: OFT. Mean±SEM.n=10.**P<0.01vsDXM group;##P<0.01vsNS group.
图3NMDA受体对DXM抗抑郁作用的影响
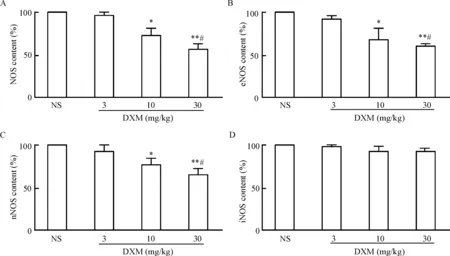
Figure 4. The effect of DXM on the content of NOS (A), eNOS (B), nNOS (C) and iNOS (D) in the brain of depressed mice. Mean±SEM.n=10.*P<0.05,**P<0.01vsNS group;#P<0.05vs10 mg/kg DXM group.
图4DXM对抑郁小鼠脑内NOS含量的影响

Figure 5. The role of NO in the antidepressant effect of DXM. A: FST; B: TST; C: OFT. Mean±SEM.n=10.##P<0.01vsNS group;**P<0.01vsDXM group.
图5NO对DXM抗抑郁作用的影响
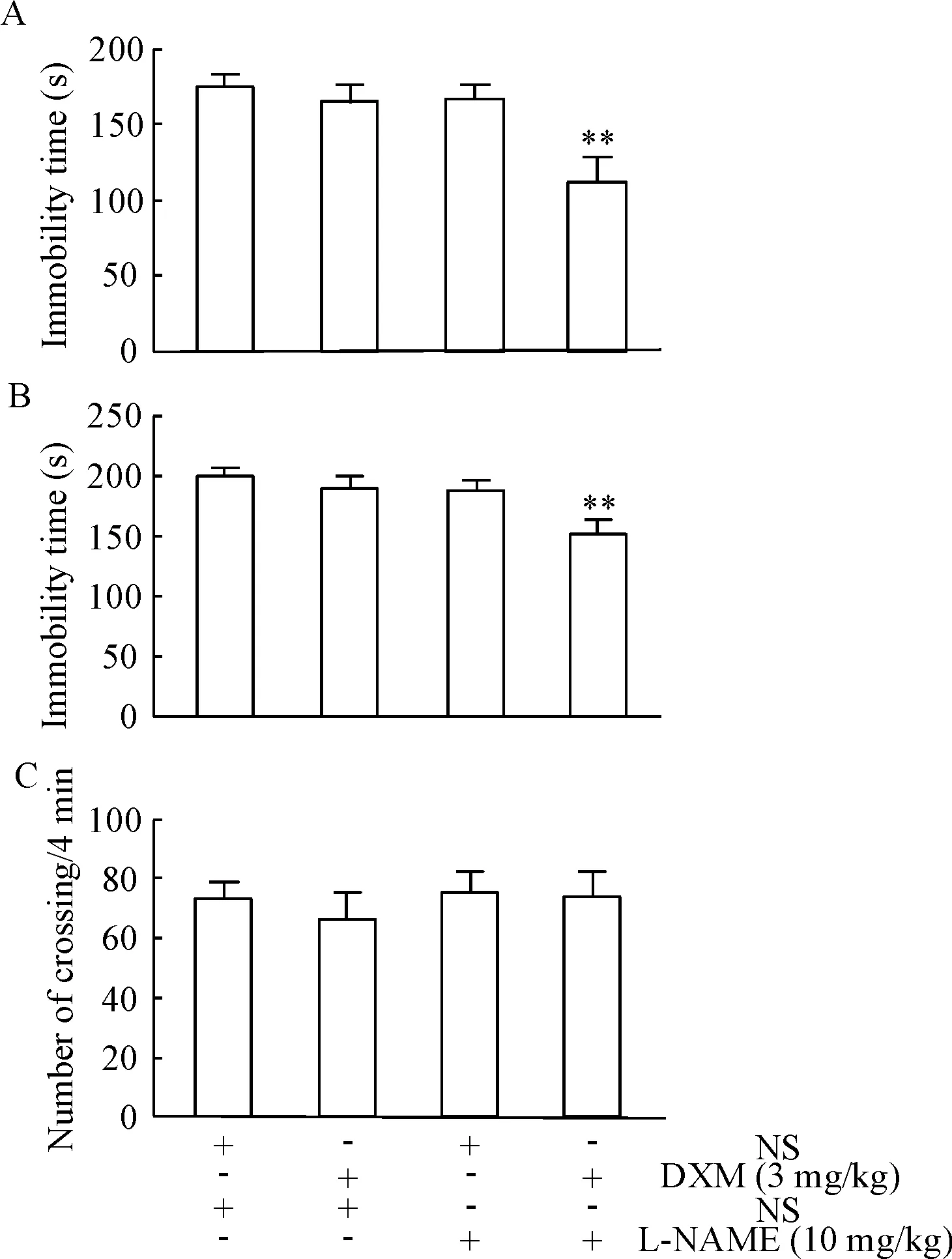
Figure 6. The role of L-NAME in the antidepressant effect of DXM. A: FST; B: TST; C: OFT. Mean±SEM.n=10.**P<0.01vsDXM group.
图6L-NAME对DXM抗抑郁作用的影响

Figure 7. The role of 7-NI in the antidepressant effect of DXM. A: FST; B: TST; C: OFT. Mean±SEM.n=10.##P<0.01vsTween-80/DXM group.
图77-NI对DXM抗抑郁作用的影响

Figure 8. The role of AG in the antidepressant effect of DXM. A: FST; B: TST; C: OFT. Mean±SEM.n=10.
图8AG对DXM抗抑郁作用的影响

Figure 9. The role of sildenafil in the antidepressant effect of DXM. A: FST; B: TST; C: OFT. Mean±SEM.n=10.**P<0.01vsNS group;##P<0.01vsDXM group.
图9西地那非对DXM抗抑郁作用的影响
讨 论
本研究发现,DXM能够减少小鼠在FST和TST中的静止时间,表现出抗抑郁的作用,并且在研究中还发现,DXM处理过的小鼠,脑内NMDA受体活性和NOS的表达下降。有研究表明NMDA受体及L-精氨酸-NO-cGMP通路参与抑郁症的病理生理过程[3, 13]。DXM的抗抑郁作用可能是通过抑制NMDA受体的活性及其下游信号传导产生的[20]。DXM主要是通过阻断钙离子的内流发挥其NMDA受体拮抗剂的作用[21],DXM的这种作用不仅仅能够缓解抑郁还能够保护神经抵抗氧化应激损伤[22]。据此我们推测DXM抗抑郁的作用是通过NMDA受体及L-精氨酸-NO-cGMP信号通路产生的。
本研究发现,NMDA受体拮抗剂MK-801能够增强DXM抗抑郁的作用,而NMDA则能够部分阻断DXM的抗抑郁作用。有研究表明NMDA受体参与抑郁症的病理生理过程[3],NMDA受体拮抗剂在抗抑郁药物作用中起关键作用[23],本研究的结果与之一致。
本研究中预先注射L-精氨酸后再注射DXM,观察DXM抗抑郁作用的改变,发现预先给予NO前体L-精氨酸能够抑制DXM的抗抑郁作用。NMDA受体突触后活化能够增加细胞质内钙离子水平,从而激活nNOS,导致NO水平升高[24],有趣的是,NO可以模拟参与抑郁症病理生理学过程的cGMP水平[16]。已上市的一些抗抑郁药物如文拉法辛,普拉克索,加巴喷丁和巴氯芬均是通过抑制NO生成产生抗抑郁作用[19]。
为了验证NOS是否参与DXM的抗抑郁作用,我们分别对抑郁小鼠脑内NOS总量及3种类型的NOS含量进行了测定,结果发现给予DXM后小鼠脑内NOS总量、eNOS含量及nNOS含量均减少,并且呈量效依赖性,但iNOS的含量无明显改变。这一实验结果与小鼠行为学研究结果相吻合,进一步证明DXM的抗抑郁作用是通过抑制eNOS和nNOS发挥作用,与iNOS无关。接着我们观察3种NOS抑制剂对DXM抗抑郁作用的影响,结果表明,eNOS抑制剂L-NAME[23]和nNOS抑制剂7-NI[23]均能够促进DXM的抗抑郁作用,而iNOS抑制剂AG[15]对DXM的抗抑郁作用无影响。与7-NI能够促进抗抑郁药物的药效相吻合,给予7-NI能够强化丙咪嗪[25]以及氟西汀[25]的抗抑郁效果。
西地那非能够增加cGMP水平[26],为了观察cGMP对DXM抗抑郁作用的影响,我们还使用了西地那非,结果显示,西地那非能够阻断DXM的抗抑郁作用,表明DXM的抗抑郁作用依赖于低水平的cGMP。cGMP受sGC及PDE5的调控[26],PDE5能够促进cGMP转换为GMP。
尽管DXM具有抗抑郁的作用,但是一次性给予大剂量(120 mg或2 mg/kg)的DXM会产生致幻效果[27],如何合理的应用于临床治疗抑郁将成为我们进一步的研究重点。现阶段的研究成果仅能说明DXM具有抗抑郁的作用,并且NMDA受体及L-精氨酸-NO-cGMP信号通路参与这一过程。
[参 考 文 献]
[1] Silva MT, Galvao TF, Martins SS, et al. Prevalence of depression morbidity among Brazilian adults: a systematic review and meta-analysis[J]. Rev Bras Psiquiatr, 2014, 36(3):262-270.
[2] Faron-Górecka A, Kumider M, Szafran-Pilch K, et al. Basal prolactin levels in rat plasma correlates with response to antidepressant treatment in animal model of depression[J]. Neurosci Lett, 2017, 647:147-152.
[3] Park M, Niciu MJ, Zarate CA Jr. Novel glutamatergic treatments for severe mood disorders[J]. Curr Behav Neurosci Rep, 2015, 2(4):198-208.
[4] El-Naggar T, Carretero ME, Arce C, et al. Methanol extract of Nigella sativa seed induces changes in the levels of neurotransmitter amino acids in male rat brain regions[J]. Pharm Biol, 2017, 55(1):1415-1422.
[5] Law AJ, Deakin JF. Asymmetrical reductions of hip-pocampal NMDAR1 glutamate receptor mRNA in the psychoses[J]. Neuroreport, 2001, 12(13):2971-2974.
[6] Golisch A, Heba S, Glaubitz B, et al. Enhancing Effects of NMDA-receptor blockade on extinction learning and related brain activation are modulated by BMI[J]. Front Behav Neurosci, 2017, 11(1):34-41.
[7] Ostadhadi S, Khan MI, Norouzi-Javidan A, et al. Involvement of NMDA receptors and L-arginine/nitric oxide/cyclic guanosine monophosphate pathway in the antidepressant-like effects of topiramate in mice forced swimming test[J]. Brain Res Bull, 2016, 122:62-70.
[8] 庞 懿, 李麟仙, 王子灿. 右甲吗喃对脑缺血的实验治疗研究[J]. 中国病理生理杂志, 1999, 15(4):28-30.
[9] Mavlyutov TA, Baker EM, Losenegger TM, et al. The sigma-1 receptor: a therapeutic target for the treatment of ALS?[J]. Adv Exp Med Biol, 2017, 964(1):255-265.
[10] Nguyen L, Matsumoto RR. Involvement of AMPA receptors in the antidepressant-like effects of dextromethorphan in mice[J]. Behav Brain Res, 2015, 295(1):26-34.
[11] Pandey DK, Devadoss T, Modak N, et al. Antidepressant & anxiolytic activities ofN-(pyridin-3-yl) quinoxalin-2-carboxamide: a novel serotonin type 3 receptor antagonist in behavioural animal models[J]. Indian J Med Res, 2016, 144(4):614-621.
[12] Maya-López M, Colín-González AL, Aguilera G, et al. Neuroprotective effect of WIN55,212-2 against 3-nitropropionic acid-induced toxicity in the rat brain: involvement of CB1 and NMDA receptors[J]. Am J Transl Res, 2017, 9(2):261-274.
[13] Pereira ML, D’ancona CA, Rojas-Moscoso JA, et al. Effects of nitric oxide inhibitors in mice with bladder outlet obstruction[J]. Int Braz J Urol, 2017, 43(2):356-366.
[14] Kuntz S, Poeck B, Strauss R. Visual working memory requires permissive and instructive NO/cGMP signaling at presynapses in theDrosophilacentral brain[J]. Curr Biol, 2017, 27(5):613-623.
[15] Jin X, Yu ZF, Chen F, et al. Neuronal Nitric Oxide Synthase in Neural Stem Cells Induces Neuronal Fate Commitment via the Inhibition of Histone Deacetylase 2[J]. Front Cell Neurosci, 2017, 11(1):66-72.
[16] 刘延辉, 夏淑轩, 刘雅芳, 等. Cdk5-CRMP 通路在七氟醚抑制新生大鼠前额叶皮层树突发育中的作用[J]. 中国病理生理杂志, 2015, 31(10):1729-1736.
[17] Haj-Mirzaian A, Kordjazy N, Haj-Mirzaian A, et al. Evidence for the involvement of NMDA receptors in the antidepressant-like effect of nicotine in mouse forced swimming and tail suspension tests[J]. Psychopharmacology (Berl), 2015, 232(19):3551-3561.
[18] Ghasemi M, Raza M, Dehpour AR. NMDA receptor antagonists augment antidepressant-like effects of lithium in the mouse forced swimming test[J]. J Psychopharmacol, 2010, 24(4):585-594.
[19] Ostadhadi S, Kordjazy N, Haj-Mirzaian A, et al. Involvement of NO/cGMP pathway in the antidepressant-like effect of gabapentin in mouse forced swimming test[J]. Naunyn Schmiedebergs Arch Pharmacol, 2016, 389(4):393-402.
[21] 孙 莉, 程 焱. 右美沙芬对培养海马神经元缺氧损伤的保护作用及对Bcl-2表达的研究[J]. 中华老年心脑血管病杂志, 2004, 6(2):123-125.
[22] 季 燕, 万 琪, 沈飞飞, 等. 不同钙离子通道阻滞剂对大鼠脑片皮层扩散性抑制的影响[J]. 中国疼痛医学杂志, 2010, 16(5):289-292.
[23] Yates JR, Gunkel BT, Rogers KK, et al. Effects ofN-methyl-D-aspartate receptor ligands on sensitivity to reinforcer magnitude and delayed reinforcement in a delay-discounting procedure[J]. Psychopharmacology (Berl), 2017, 234(3):461-473.
[24] Sarnelli G, Grosso M, Palumbo I, et al. Allele-specific transcriptional activity of the variable number of tandem repeats of the inducible nitric oxide synthase gene is associated with idiopathic achalasia[J]. United Eur Gastroenterol J, 2017, 5(2):200-207.
[25] Harkin A, Connor TJ, Walsh M, et al. Serotonergic mediation of the antidepressant-like effects of nitric oxide synthase inhibitors. Neuropharmacology[J]. Neuropharmacology, 2003, 44(5):616-623.
[26] Yoshida K, Tsunoda SP, Brown LS, et al. A unique choanoflagellate enzyme rhodopsin with cyclic nucleotide phosphodiesterase activity[J]. J Biol Chem, 2017, 292(18):7531-7541.
[27] 逄立艳, 梁 伟, 王秀娟. 右美沙芬的滥用及合理使用[J]. 中国药物依赖性杂志, 2010, 19(3):233-235.
