巴戟天寡糖单体HexB减轻HUVECs缺氧复氧损伤*
2018-05-17宋延明冯国清李倩倩察雪湘
宋延明, 冯国清, 李倩倩, 察雪湘
(郑州大学基础医学院, 河南 郑州 450001)
心肌缺血再灌注损伤(ischemic reperfusion injury,IRI)指心肌局部缺血后再灌注,心肌功能不仅没有恢复,反而使得缺血所致损伤进一步加重的现象[1]。根据文献报道,IRI涉及到多种机制[2],其中内质网应激(endoplasmic reticulum stress,ERS)诱导的细胞凋亡是其重要机制之一。ERS指内质网的稳态受到干扰,导致功能异常,最后未折叠和错误折叠的蛋白聚集在内质网上,并伴随着Ca2+平衡的失调[3-4]。缺血再灌注损伤、氧化应激或外界压力负荷增大等刺激都会诱导细胞ERS的产生,从而激活ERS相关凋亡通路[5]。
巴戟天属草科藤植物,为“四大南药”之一,具有补肾壮阳和祛风湿的功效。本研究团队对巴戟天寡糖混合物进行提纯得到菊淀粉型聚糖和呋喃糖,并经前期研究发现,巴戟天寡糖单体HexB具有促进心脏血管生长作用并可以减轻缺氧/复氧(hypoxia/reoxygenation,H/R)对血管内皮细胞造成的损伤[6-8],并经激光共聚焦实验发现HexB可结合于细胞内质网上。然而HexB的上述作用是否是通过调控内质网应激所产生,尚未经实验证实。
本实验采用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为研究对象建造H/R模型。CCK-8法检测细胞的存活率,流式细胞术检测细胞的凋亡率,Western blot法检测ERS标志分子葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)和C/EBP同源蛋白(C/EBP homology protein,CHOP)、凋亡相关蛋白caspase-12及磷酸化 c-Jun氨基末端激酶(phosphorylated c-Jun NH2-terminal kinase,p-JNK)的表达。本实验中同时利用ERS抑制剂4-苯基丁酸(4-phenylbutyric acid,4-PBA)和ERS诱导剂毒胡萝卜素(thapsigargin,TG)作为对照,进一步阐述HexB减轻H/R损伤HUVECs的机制,为以后基于此单体新药的开发提供实验依据。
材 料 和 方 法
1 细胞株
HUVECs由郑州大学生物工程系祁元明教授惠赠。
2 主要试剂和仪器
巴戟天寡糖单体HexB(纯度>95%,日本北海道大学姚闵教授协助提纯);胎牛血清购自四季青生物材料有限公司;CCK-8试剂盒购自碧云天生物技术研究所;细胞凋亡检测试剂盒购自天津三箭生物技术股份有限公司;RPMI-1640培养基、胰蛋白酶、BCA试剂盒、ECL超敏发光液和蛋白上样缓冲液购自Solarbio;TG和4-PBA购自Sigma;蛋白电泳分子量标志物购自Thermo;辣根过氧化酶标记山羊抗兔II 抗购自EarthOx;兔抗人caspase-12多克隆抗体购自武汉博士德生物工程有限公司;兔抗人CHOP单克隆抗体购自Abcam;兔抗人p-JNK、GAPDH和GRP78单克隆抗体购自CST。
BD Accuri C6型流式细胞分析仪(碧迪医疗器械有限公司);酶标仪(Bio-Rad);倒置显微镜(Nikon);CO2细胞培养箱(Thermo);Western blot电泳仪(Bio-Rad)。
3 主要方法
3.1细胞培养及分组 复苏细胞于培养瓶中,加入4 mL含10%新生牛血清的RPMI-1640培养基,并置于细胞培养箱中培养。选取第3~5代生长状态良好的细胞用于后续的实验。将细胞分为7组,对照(control)组、HexB组、H/R组、HexB+H/R组、4-PBA+H/R、TG组和HexB+TG。各药物均于H/R建模前加入细胞预处理:其中HexB(30 nmol/L)预处理24 h、4-PBA(2 mmol/L)预处理12 h、TG(2 μmol/L)预处理24 h。
3.2CCK-8法检测HUVECs活力 各组细胞以每孔1×104个的密度接种于96孔板上,每孔加入100 μL培养液,同时设置对照组与空白组,每组8个复孔。细胞处理结束后,每孔加入10 μL的CCK-8试剂。放入培养箱反应2 h后,用酶标仪在450 nm处检测吸光度(A)值,细胞存活率(%)=(A加药组-A空白组)/(A对照组-A空白组)×100%,实验重复3次。
3.3Annexin V-FITC法检测细胞凋亡率 用胰蛋白酶(不含EDTA)消化细胞,然后1 500 r/min离心5 min收集细胞,用PBS漂洗细胞2次,1 500 r/min离心5 min收集细胞于离心管中,然后每管加入500 μL的Binding Buffer重悬细胞后依次加入5 μL Annexin V-FITC和10 μL碘化丙啶 (propidium iodide,PI)混合均匀,室温避光反应10 min,用流式细胞仪检测细胞凋亡率,实验重复3次。
3.4Western blot检测GRP78、CHOP、caspase-12及p-JNK的蛋白水平 RIPA法裂解细胞,提取总蛋白,BCA试剂盒测定蛋白浓度,于-80 ℃保存。取上述蛋白进行SDS-PAGE,将电泳分离后的蛋白转移至硝酸纤维素膜上。用脱脂牛奶在37 ℃摇床上封闭2 h,加入目标蛋白 I 抗和内参照GAPDH I 抗,在4 ℃冰箱中过夜孵育,加入辣根过氧化物酶标记 II 抗在37 ℃孵育2 h后,用ECL化学发光法显示。检测条带灰度值,并计算目标蛋白条带灰度值与相应GAPDH条带灰度值之比,实验重复3次。
4 统计学处理
采用SPSS 17.0 软件进行数据处理和统计分析。数据用均数±标准差(mean±SD)表示,单因素方差分析进行多组间比较,SNK-q法进行组间两两比较,以P<0.05为差异有统计学意义。
结 果
1 各组HUVECs活力的分析
与control组相比,H/R组和TG组HUVECs的细胞活力明显降低(P<0.05);与H/R组比较,HexB+H/R和4-PBA+H/R组HUVECs的细胞活力明显升高(P<0.05);但是HexB+H/R组和4-PBA+H/R组两组间细胞活力的差异无统计学显著性;与TG组相比,HexB+TG组的细胞活力亦显著升高(P<0.05),见图1。
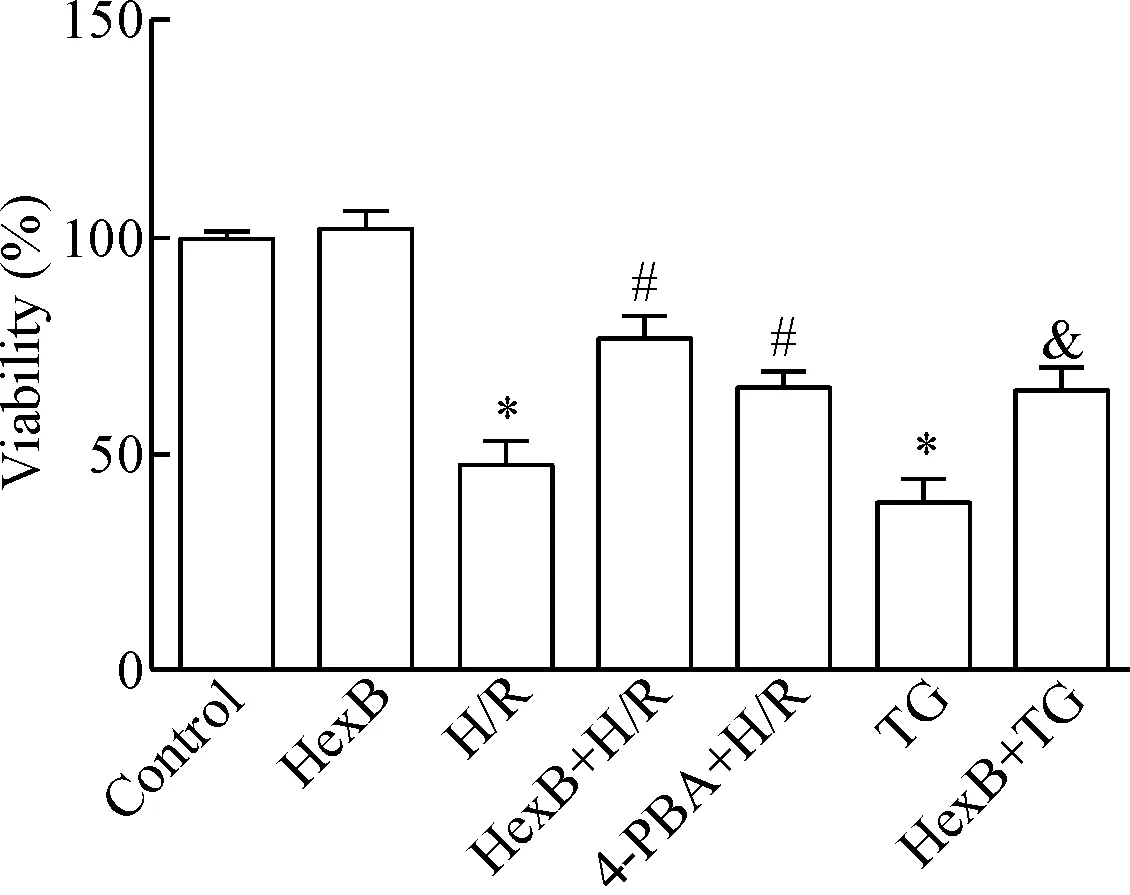
Figure 1. The viability of HUVECs with different treatments was detected by CCK-8 assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsH/R group;&P<0.05vsTG group.
图1CCK-8法检测各组HUVECs的细胞活力
2 各组HUVECs凋亡率的分析
与control组相比,H/R组和TG组的细胞凋亡率显著上升(P<0.05);与H/R组相比,HexB+H/R组和4-PBA+H/R组的细胞凋亡率明显降低(P<0.05);HexB+H/R组和4-PBA+H/R组细胞凋亡率的差异无统计学显著性;与TG组相比,HexB+TG组细胞的凋亡率明显降低(P<0.05),见图2。
3 各组GRP78、CHOP、caspase-12及p-JNK蛋白水平的分析
与control组相比,H/R组和TG组的GRP78、CHOP、caspase-12及p-JNK的蛋白水平明显升高(P<0.05);与H/R组相比,HexB+H/R组和4-PBA+H/R组的GRP78、CHOP、caspase-12及p-JNK的蛋白水平明显降低(P<0.05);HexB+H/R组和4-PBA+H/R组的GRP78、CHOP、caspase-12及p-JNK蛋白水平的差异无统计学显著性;与TG组相比,HexB+TG组GRP78、CHOP、caspase-12及p-JNK的蛋白水平明显降低(P<0.05),见图3。
讨 论
缺血再灌注损伤的机制是复杂的,研究发现其病理学过程涉及到多条凋亡相关信号转导通路,其中,线粒体凋亡途径、死亡受体凋亡途径和ERS凋亡途径被称为3大凋亡通路[1]。
内质网是整合细胞损伤和凋亡信号的重要细胞器[9],在对细胞凋亡的研究中,ERS在细胞凋亡中所扮演的角色已经逐渐清晰[10-11]。与ERS相关的凋亡通路主要有3条:CHOP、JNK以及caspase-12通路[12]。有文献指出,如果ERS反应持续时间较长,便会诱发细胞的凋亡,此时3条细胞凋亡通路即CHOP、JNK以及caspase-12凋亡途径被激活[13]。其中,CHOP和caspase-12的激活是触发内质网应激相关凋亡途径的特异性信号转导通路[14]。有研究证实通过抑制ERS相关凋亡途径可抑制H/R所诱导的细胞凋亡[15-16]。Yu等[17]和Gao[1]等通过实验也进一步证实了上述结果。
那么,HexB是否也是通过抑制ERS途径减轻H/R诱导HUVECs损伤的呢?本研究发现与对照组相比,HUVECs缺氧复氧后,细胞活力明显降低,细胞凋亡率显著升高,ERS相关蛋白GRP78、CHOP、caspase-12和p-JNK表达显著增加,说明ERS相关凋亡通路被激活并诱导细胞凋亡。
为证实HexB可以通过抑制ERS发挥保护HUVECs作用,本实验在TG诱导细胞之前,对细胞进行了HexB的预处理,结果表明,HexB可以显著抑制TG诱导的细胞凋亡及细胞活力下降,同时降低GRP78、CHOP、caspase-12和p-JNK蛋白表达。为进一步探讨HexB抑制ERS相关凋亡途径的作用,本实验在细胞缺氧复氧前,对其进行ERS抑制剂4-PBA的预处理,结果表明其可显著降低缺氧复氧诱导的细胞凋亡,并提高细胞的活力,抑制GRP78、CHOP、caspase-12和p-JNK蛋白表达。
综上所述,本研究证明HexB可以通过抑制ERS发挥保护HUVECs的作用,其作用机制与抑制ERS相关的CHOP、caspase-12和JNK凋亡通路有关。

Figure 2. The apoptotic rate of the HUVECs with different treatments anayzed by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsH/R group;&P<0.05vsTG group.
图2流式细胞术检测各组HUVECs的凋亡率变化
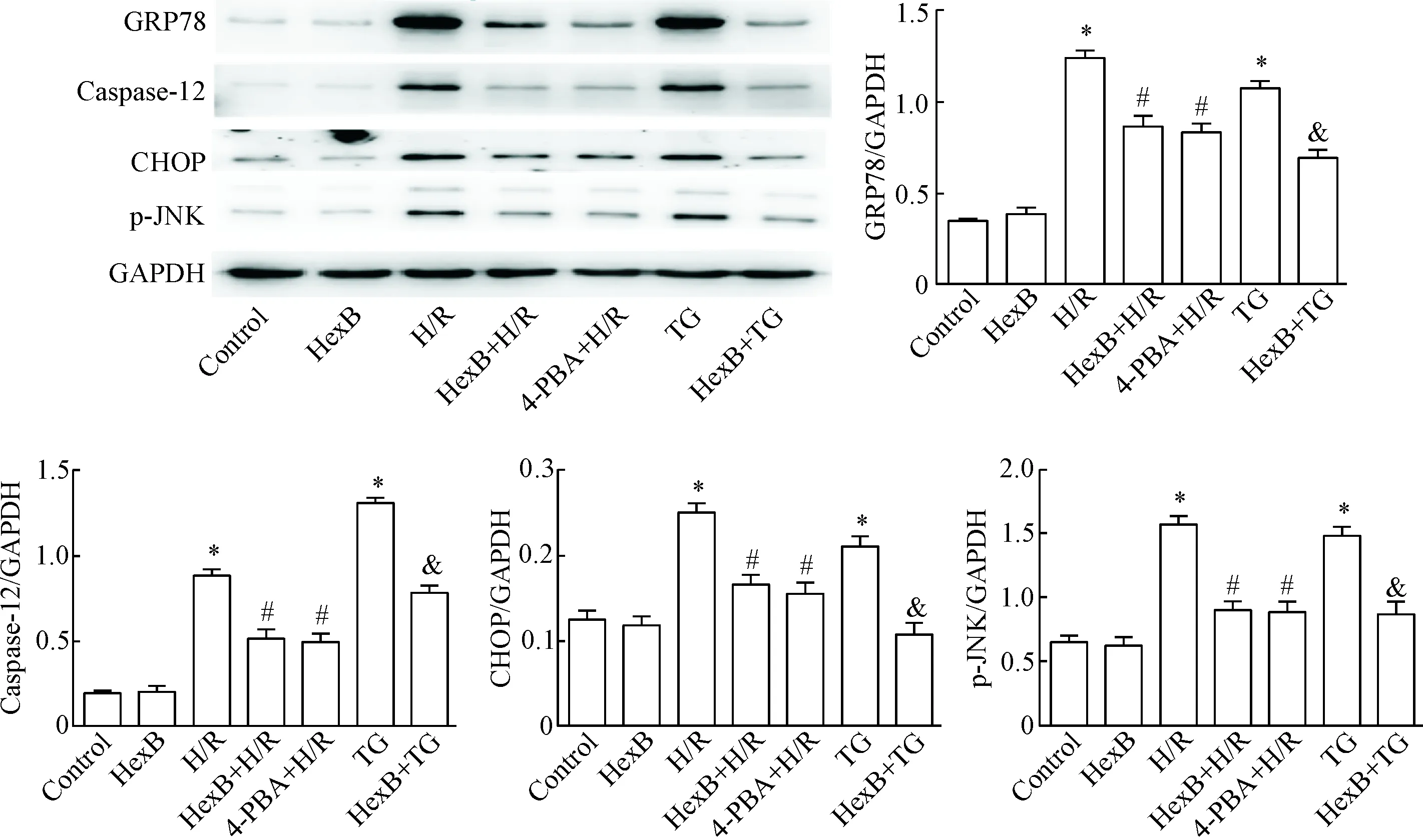
Figure 3. The protein levels of GRP78, CHOP, caspase-12 and p-JNK in the HUVECs with different treatments determined by Wes-tern blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsH/R group;&P<0.05vsTG group.
图3Westernblot检测各组HUVECs中GRP78、CHOP、caspase-12及p-JNK的蛋白水平
[参 考 文 献]
[1] Gao Y, Jia P, Shu W, et al. The protective effect of lycopene on hypoxia/reoxygenation-induced endoplasmic reti-culum stress in H9C2 cardiomyocytes[J]. Eur J Pharmacol, 2016, 774:71-79.
[2] Stamboul K, Lorin J, Lorgis L, et al. Atrial fibrillation is associated with a marker of endothelial function and oxidative stress in patients with acute myocardial infarction[J]. PLoS One, 2015, 10(7):eo131439.
[3] Logue SE, Cleary P, Saveljeva S, et al. New directions in ER stress-induced cell death[J]. Apoptosis, 2013, 18(5):537-546.
[4] Di Fazio P, Ocker M, Montalbano R. New drugs, old fashioned ways: ER stress induced cell death[J]. Curr Pharm Biotechnol, 2012, 13(11):2228-2234.
[5] Sano R, Reed JC. ER stress-induced cell death mechanisms[J]. Biochim Biophys Acta, 2013, 1833(12):3460-3470.
[6] 韩联合, 冯国清, 张贺鸣, 等. 巴戟天正丁醇提取物对乳鼠心肌细胞缺氧复氧损伤的防护作用[J]. 中国医院药学杂志, 2009, 29(17):1435-1437.
[7] 杨景柯, 冯国清, 于 爽, 等. 巴戟天寡糖促进鸡胚绒毛尿囊膜血管生成研究[J]. 中国中药杂志, 2010, 35(3):360-363.
[8] 杨景柯, 冯国清, 于 爽, 等. 巴戟天醇提取物促大鼠缺血心肌治疗性血管生成的实验研究[J]. 中国药理学通报, 2010, 26(3):367-371.
[9] Ferri KF, Kroemer G. Organelle-specific initiation of cell death pathways[J]. Nat Cell Biol, 2001, 3(11):E255-E263.
[10] Benbrook DM, Long A. Integration of autophagy, proteasomal degradation, unfolded protein response and apoptosis[J]. Exp Oncol, 2012, 34(3):286-297.
[11] Lhoták S, Sood S, Brimble E, et al. ER stress contributes to renal proximal tubule injury by increasing SREBP-2-mediated lipid accumulation and apoptotic cell death[J]. Am J Physiol Renal Physiol, 2012, 303(2):F266-F278.
[12] Wang J, Hu X, Jiang H. ER stress-induced apoptosis: a novel therapeutic target in heart failure[J]. Int J Cardiol, 2014, 177(2):564-565.
[13] Yoshida H, Matsui T, Yamamoto A, et al. XBP1 mRNA is induced by ATF6 and spliced by IRE1 in response to ER stress to produce a highly active transcription factor[J]. Cell, 2001, 107(7):881-891.
[14] Srinivasan K, Sharma SS. Augmentation of endoplasmic reticulum stress in cerebral ischemia/reperfusion injury associated with comorbid type 2 diabetes[J]. Neurol Res, 2011, 33(8):858-865.
[15] 郝小燕, 边云飞, 李茂莲, 等. 脂联素通过减轻内质网应激抑制缺氧复氧诱导的心肌细胞损伤[J]. 中国病理生理杂志, 2010, 26(6):1075-1079.
[16] 王 琛, 李玉珍, 王晓礽, 等. 西洋参茎叶总皂苷通过抑制过度内质网应激减轻大鼠心肌细胞缺氧/复氧损伤[J]. 中国病理生理杂志, 2012, 28(1):22-28.
[17] Yu W, Sheng M, Xu R, et al. Berberine protects human renal proximal tubular cells from hypoxia/reoxygenation injury via inhibiting endoplasmic reticulum and mitochon-drial stress pathways[J]. J Transl Med, 2013, 11:24.
