上调人食管癌Eca109细胞Shh-Gli1信号通路对放射抗拒性及细胞周期的影响*
2018-05-17余今菁贺昱霖刘佳琪吴清明
余今菁, 贺昱霖, 刘佳琪, 姚 菲, 刘 群, 龙 辉, 吴清明△
(武汉科技大学 1医学院, 2职业危害识别与控制湖北省重点实验室, 3附属天佑医院消化内科, 湖北 武汉 430065; 4十堰市太和医院,湖北医药学院附属医院生物医学研究所, 湖北 十堰 442000)
食管癌是一种常见的消化系统恶性肿瘤[1-2],发病率高,预后较差。对于晚期食管癌患者,放射治疗联合手术是最好的治疗手段之一[3],但放射治疗可能导致肿瘤细胞放射抗拒性的产生,从而影响放疗疗效。有研究指出,消化道肿瘤的发生与Sonic Hedgehog(Shh)信号通路的异常激活有关,食管鳞状细胞癌中存在Shh信号通路相关因子的高表达,Shh信号通路下游转录因子Gli1抑制剂能够增强食管癌细胞的放射敏感性[4-5]。
本课题组前期研究发现,食管癌放射抗拒株Eca109R细胞中Gli1与Shh蛋白表达明显高于亲本株Eca109[6],表明食管癌放射抗拒性的产生可能与Shh信号通路相关蛋白过表达有关。然而Shh信号通路如何通过其下游转录因子Gli1影响食管癌细胞放射抗拒性的机制尚不明了。因此,本实验通过上调亲本株Eca109细胞中关键因子Gli1的表达,检测食管癌细胞放射敏感性与细胞周期的变化,探究Shh信号通路相关因子与食管癌放射抗拒性及细胞周期改变之间的关联。
材 料 和 方 法
1 材料
人食管癌细胞株Eca109(十堰太和医院惠赠);DMEM培养基(Gibco);胎牛血清(杭州四季青公司);QuantiFast SYBR Green PCR试剂盒(QIAGEN);细胞周期试剂盒(联科公司);抗Gli1抗体(北京博奥森公司);过表达Gli1质粒(吉凯公司)。CO2培养箱和超净工作台(Thermo Fisher)。
2 方法
2.1细胞培养 用含10%胎牛血清的DMEM培养基,置于37 ℃、5% CO2饱和湿度的培养箱内培养。
2.2实验分组 用由Eca109细胞中扩增出的Gli1序列构建的Gli1过表达质粒转染Eca109细胞,命名为Eca109-ox-Gli1组;同时Eca109细胞转染空载质粒作为阴性对照(negative control)组;另设不做处理的亲本株Eca109细胞作为正常对照(normal control)组。
2.3过表达质粒转染 转染前一天将细胞以每孔6×105个的密度接种于6孔板内,确保第2天转染时细胞达到70%的汇合度。用125 μL Opti-MEM培养基稀释5 μL Lipofectamine 2000试剂。用125 μL Opti-MEM培养基稀释2.5 μg质粒。将稀释的质粒与稀释的Lipofectamine 2000试剂混合(1∶1比例),孵育5 min。将混合的质粒-脂质体复合物加至细胞中,再加入完全培养基,使终体积达2 mL。转染后24 h可通过荧光显微镜观察到转染成功的细胞。
2.4Real-time PCR实验 根据TRIzol说明书提取个组细胞的总RNA并定量。取总RNA 2 μg经SuperScript III Reverse Transcriptase逆转录反应得到终体积20 μL的cDNA,采用SYBR Green实时荧光定量PCR试剂盒,按说明书所述检测细胞中Gli1的mRNA表达。PCR体系为:12.5 μL SYBR Green PCR Msater Mix、5 μL RT逆转录产物、1 μL正向及反向引物。反应条件为:95 ℃ 5 min; 95 ℃ 30 s、60 ℃ 30 s,循环40次。β-actin作为内参照,采用2-ΔΔCt法分析基因相对表达量。Gli1的上游引物序列为5’-CGCCTCGAAAACCTGA-3’, 下游引物序列为5’-GGGAGCTTACATACATACGG-3’; β-actin的上游引物序列为5’-CTCCATCCTGGCCTCGCTCT-3’, 下游引物序列为5’-GCTGTCACCTTCACCGTTCC-3’。
2.5Western blot检测Gli1蛋白的表达 采用现配的含有1% PMSF的RIPA裂解液提取各组细胞总蛋白,BCA蛋白定量法检测蛋白浓度。蛋白煮沸变性,冷却至室温后上样,每孔35 μg,SDS-PAGE 2 h,转膜后5%脱脂奶粉封闭2 h,I 抗4 ℃孵育过夜,隔日用现配1×TBST洗膜3次,II抗37 ℃孵育1 h,TBST洗膜3次,采用ECL化学发光法检测蛋白的表达,计算相对灰度值。实验重复3次。
2.6集落形成实验测细胞的放射敏感性 将指数生长期细胞消化计数,制成单细胞悬液,按每孔400、400、800、1 000和1 200的密度梯度接种于6孔板,待细胞贴壁且状态良好(约12 h),每板分别以0、2、4、6和8 Gy的剂量进行细胞照射,继续培养14 d,出现肉眼可见的细胞集落时认为集落已形成,终止培养。甲醇固定,结晶紫染色,计数含50个及以上细胞的集落数,用单击多靶模型拟合细胞存活曲线,计算细胞放射敏感性参数:平均致死剂量(D0)、准阈剂量(Dq)、外推值(N值)及照射2 Gy后细胞存活分数(survival fraction at dose of 2 Cy,SF2)。实验重复3次。
2.7细胞照射 采用Varian 2300直线加速器对细胞进行6 MV的X射线放射处理,每次放射剂量为200 cGy,照射视野面积为6 cm×4 cm,照射源距细胞培养瓶80 cm,培养瓶表面覆盖1.5 cm厚的补偿块,吸收剂量率为2 Gy/min。取指数生长期Eca109细胞1瓶,用直线加速器照射1 min,放入细胞培养箱中培养,观察细胞生长状况,待细胞状态稳定,并开始逐步恢复正常生长时,可进行细胞传代,继续培养至对数生长期时,可再次进行放射处理。
2.8细胞周期检测 使用联科生物细胞周期检测试剂盒,收集1×106个细胞,离心后70 %的冷乙醇1 mL 4 ℃固定过夜。隔日弃去固定液,PBS重悬细胞15 min,室温离心5 min,弃上清。加入1 mL DNA Staining Solution,涡旋振荡10 s混匀,室温避光孵育30 min。使用流式细胞仪进行检测。
3 统计学处理
采用SPSS 17.0进行统计分析。实验所涉及的数据均采用均数±标准差(mean±SD)的形式表示,多组间比较采用单因素方差分析,应用Bonferroni校正的t检验进行组间两两比较,以P<0.05为差异有统计学意义。
结 果
1 Real-time PCR检测转染后3组细胞中Gli1的mRNA表达水平
用Real-time PCR法检测转染后3组细胞内Gli1的mRNA表达水平,以β-actin作为内参照。结果显示,Eca109-ox-Gli1组与negative control组和normal control组相比,Gli1的mRNA表达明显增高,差异有统计学意义(P<0.05),见图1。

Figure 1. The mRNA expression levels of Gli1 in the esophageal cancer cells after transfection. Mean±SD.n=3.*P<0.05vscontrol groups.
图1转染后3组细胞中Gli1mRNA表达水平的比较
2 Western blot法检测转染后3组细胞中Gli1蛋白表达
Gli1蛋白的相对分子质量是118 kD,内参照蛋白β-actin的相对分子质量是42 kD。结果显示,Eca109-ox-Gli1组较2组对照细胞的Gli1蛋白表达水平明显增高,差异有统计学意义(P<0.05),见图2。

Figure 2. The protein expression levels of Gli1 in the esophageal cancer cells after transfection. Mean±SD.n=3.*P<0.05vscontrol groups.
图2转染后3组细胞中Gli1蛋白表达水平的比较
3 上调Gli1对Eca109细胞放射敏感性的影响
转染后的3组细胞分别接受0 Gy、2 Gy、4 Gy、6 Gy和8 Gy剂量的单次照射,利用单击多靶模型拟合细胞存活曲线,可见Eca109-ox-Gli1组相比2个对照组对应剂量的细胞存活分数明显增高,差异有统计学意义(P<0.05),且D0和Dq均高于对照组,差异有统计学意义(P<0.05),见图3、表1。这表明Eca109-ox-Gli1组细胞放射敏感性明显减弱,放射抗拒性增强。
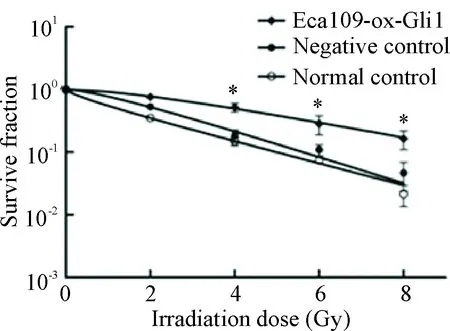
Figure 3. The survival curves of the esophageal cancer cells after transfection. Mean±SD.n=3.*P<0.05vscontrol groups at the same dose.
图3单击多靶模型拟合细胞存活曲线

表1 转染细胞放射生物学参数的比较
*P<0.05,**P<0.01vscontrol groups.
4 上调Gli1对细胞周期的影响
转染后的3组细胞分别接受6 Gy剂量的单次照射后继续培养48 h后,检测细胞周期,结果显示,3组细胞在照射前,Eca109-ox-Gli1组中S期细胞分布比例显著高于对照组(P<0.01),G2/M期细胞分布低于对照组(P<0.05),说明上调Gli1的细胞放射抗拒性相对增强,可能是由于对X射线最为抗拒的S期细胞比例增多所致。6 Gy的X射线照射后,3组细胞均出现G2/M期阻滞,表明细胞在进行自身损伤修复,照射后normal control组相比于Eca109-ox-Gli1组G2/M期细胞比例显著增高(P<0.01),说明相比具有放射抗拒性的Eca109-ox-Gli1转染细胞,亲本Eca109细胞积极地促进细胞进入对放射敏感的G2/M期,放射治疗更为有效,见表2、3。

表2 转染后3组细胞X射线照射前的细胞周期分布
*P<0.05,**P<0.01vscontrol groups.

表3 转染后3组细胞X射线照射后的细胞周期分布
**P<0.01vsnormal control group.
讨 论
Shh信号转导通路由Shh配体、跨膜蛋白受体Ptch和Smo及下游核转录因子Gli组成,其中Gli锌指蛋白家族包括Gli1、Gli2和Gli3。研究表明,Shh信号通路一般在正常成人组织器官中低表达、甚至不表达,仅在参与组织的修复时激活,而在多种肿瘤中均发现存在该通路的异常激活[7-9]。Yang等[10]发现食管癌前病变中Ptch1和Gli2蛋白表达增高,96%的食管腺癌患者存在Shh信号通路的异常激活,表明Shh信号通路的异常激活在食管癌的发生发展中起重要作用。有研究报道[11],43例出现放化疗抗拒的食管癌细胞株中有36例(83.7%)检测出Gli1阳性,表明食管癌放化疗抗拒性与Hh通路的激活有关。近年来,有关肿瘤细胞放射抗拒机制的研究涉及多种复杂因素,包括细胞周期紊乱、DNA的损伤与修复、细胞的凋亡与分化、放射致细胞信号转导通路改变及血管形成等[12]。
在正常情况下,跨膜蛋白质受体Ptch和Smo组成受体复合物,Smo的活性受到抑制;当Shh配体激活时,Shh与Ptch结合,Smo释放进入细胞内,激活信号通路下游转录因子Gli1,调节Wnt、cyclin D1、N-Myc等多种靶基因表达,引起细胞周期改变和细胞增殖与凋亡[13]。有研究发现[14],抑制细胞周期调控因子CDC25在食管癌细胞中的过度激活后进行细胞照射,G2/M期细胞的阻滞程度下降,放射敏感性提高,表明食管癌细胞的放射抗拒性可能与细胞周期的改变有关。Rizvi等[15]的研究显示,CDK2启动子序列在过表达Gli1质粒转染的细胞中富集,并且在Gli1过表达组中活性相比对照组增加多达5倍,说明Gli1与CDK2启动子结合并充当CDK2的转录激活剂。Simsmourtada等[11]发现,cyclin D1在受Shh信号刺激的SEG-1细胞中表达增高;抑制Hh信号后细胞周期进展受到抑制,G1/S监测点蛋白cyclin D1和周期蛋白依赖性激酶4的表达量减少,细胞大量停留在G1期,肿瘤的放射敏感性增强。因此,对细胞周期的研究可能是探究Shh信号通路影响肿瘤放射抗拒性机制的一个关键点。
我们的前期研究发现[6],食管癌放射抗拒株细胞活力较亲本株下降,Shh和Gli1蛋白在放射抗拒细胞株中高表达,且Gli1明显向细胞核聚集。本研究在原有基础上,为进一步明确Shh信号通路影响食管癌细胞放射抗拒的机制,我们通过构建过表达Gli1质粒对Eca109细胞进行转染,发现转染后Gli1表达水平相比转染前增加,同时集落形成实验显示,转染过表达Gli1质粒后细胞放射敏感性减弱,放射抗拒性增强,印证了Shh信号通路与食管癌的放射抗拒性是密切相关的。同时,我们通过检测3组细胞照射前后细胞周期的变化,发现Gli1过表达细胞株S期细胞分布显著增加,G2/M期细胞减少,而放射毒性效应依赖于细胞周期,G1期和G2/M期细胞对射线敏感,S期的细胞对射线最为抗拒,即过表达细胞对射线敏感的细胞减少,放射抗拒性增强。X射线照射后,亲本株Eca109细胞G2/M期细胞分布的增加较过表达细胞更为显著,说明亲本株细胞更能促进细胞进入放射敏感的M期,放射治疗对其更为有效。
综上所述,本文通过上调Gli1进一步探究了Shh信号通路激活与食管癌细胞放射抗拒性之间的关系,比较了上调Gli1细胞与亲本细胞放射前后细胞周期的变化。由此可见,细胞周期改变可能与Shh/Gli1通路影响食管癌放射抗拒性增高密切相关。
[参 考 文 献]
[1] Harris RE. Epidemiology of esophageal cancer[M]∥ Harris RE. Global epidemiology of cancer. 1st ed. Bur-lington, Massachusetts: Jones & Bartlett Learning, 2015:85-90.
[2] Su H, Jin X, Shen L, et al. Inhibition of cyclin D1 enhances sensitivity to radiotherapy and reverses epithelial to mesenchymal transition for esophageal cancer cells[J]. Tumour Biol, 2016, 37(4):5355-5363.
[3] Streppel MM, Lata S, Delabastide M, et al. Next-generation sequencing of endoscopic biopsies identifies ARID1A as a tumor-suppressor gene in Barrett’s esophagus[J]. Oncogene, 2014, 33(3):347-357.
[4] 刘爱梅, 余功旺, 黄莉霞, 等. 阻断Sonic Hedgehog信号对不同人肝癌细胞生长的影响[J]. 中国病理生理杂志, 2016, 32(2):208-214.
[5] Ma X, Sheng T, Zhang Y, et al. Hedgehog signaling is activated in subsets of esophageal can-cers[J]. Int J Cancer, 2006, 118(1):139-148.
[6] 贺昱霖, 刘佳琪, 刘 群, 等. Sonic hedgehog信号通路与食管癌放射抗拒的相关性研究[J]. 中国病理生理杂志, 2017, 33(6):1043-1047.
[7] Justilien V, Walsh MP, Ali SA, et al. The PRKCI and SOX2 oncogenes are coamplified and cooperate to activate Hedgehog signaling in lung squamous cell carcinoma[J]. Cancer Cell, 2014, 25(2):139-151.
[8] Justilien V, Fields AP. Molecular pathways: novel approaches for improved therapeutic targeting of Hedgehog signaling in cancer stem cells[J]. Clin Cancer Res, 2015, 21(3):505-513.
[9] 李若菲, 白云飞, 王芸姣, 等. 槲芪散可通过激活Hedgehog信号通路抑制大鼠肝癌前病变的形成[J]. 中国病理生理杂志, 2017, 33(4):661-668.
[10] Yang L, Wang LS, Chen XL, et al. Hedgehog signaling activation in the development of squamous cell carcinoma and adenocarcinoma of esophagus[J]. Int J Biochem Mol Biol, 2012, 3(1):46-57.
[11] Simsmourtada J, Izzo JG, Apisarnthanarax S, et al. Hedgehog: an attribute to tumor regrowth after chemoradiotherapy and a target to improve radiation response[J]. Clin Cancer Res, 2006, 12(21):6565-6572.
[12] 朱 睿, 吴清明, 龙 辉, 等. 食管癌放射抗拒与P-gP、HER-2及microRNA -296表达的相关性[J]. 中国病理生理杂志, 2012, 28(3):550-552.
[13] 张 红, 吴清明. 食管癌放射抗拒的细胞信号通路研究进展[J]. 肿瘤防治研究, 2014, 41(4):425-427.
[14] Xu X, Fan Z, Liang C, et al. A signature motif in LIM proteins mediates binding to checkpoint proteins and increases tumour radiosensitivity[J]. Nat Commun, 2017, 8:14059.
[15] Rizvi S, Demars CJ, Comba A, et al. Combinatorial chemoprevention reveals a novel smoothened independent role of Gli1 in esophageal carcinogenesis[J]. Cancer Res, 2010, 70(17):6787-6796.
