miR-30c抑制宫颈癌细胞恶性表型的分子机制研究
2018-05-17金虹,张萌,刘念,李珊
金 虹, 张 萌, 刘 念, 李 珊
(新疆医科大学第一附属医院母胎医学中心产科, 新疆 乌鲁木齐 830011)
宫颈癌是全球八大恶性肿瘤之一,是造成全世界妇女死亡的第二大病因。流行病学资料显示,全球每年有近53万宫颈癌新增病例,其中80%的患者发生在发展中国家[1-2],中国是宫颈癌高发国家之一,发病率和死亡率呈逐年增加趋势[3-4]。目前放疗和化疗仍是宫颈癌的主要治疗手段,体外放疗与腔内放疗联合作用是治疗宫颈癌的标准放射疗法[5],但这些方法对晚期转移性宫颈癌的预后效果较差,易复发且对放/化疗耐受。因此,寻找和研发有效治疗宫颈癌的靶向药物已成为亟需解决的医研问题。微小RNA(microRNAs,miRNAs,miR)是一类长度为18~25个核苷酸的单链非编码RNA。大量研究证实miRNAs的异常表达与大多数肿瘤的发生发展密切相关,在肿瘤细胞增殖、转移、侵袭,细胞凋亡,周期调控和肿瘤细胞耐药性方面发挥重要作用[6-8]。miR-30c是近新发现的miR-30家族成员,其生物学功能仍不清楚。研究表明miR-30c在不同肿瘤细胞中发挥不同的生物学功能,其异常表达与多种肿瘤的发生发展相关,提示miR-30c是一个肿瘤相关因子[9-13]。目前,miR-30c在宫颈癌发生发展中的功能尚无报道。本研究以宫颈癌细胞为对象,观察miR-30c异常表达对宫颈癌细胞表型的影响,并探讨其分子机制,为以miR-30c为靶点研发治疗宫颈癌的靶向药物提供科学依据。
材 料 和 方 法
1 细胞株与试剂
宫颈癌细胞系C33A、HeLa、SiHa和CaSki购自ATCC;DMEM培养基购自Gibco;胎牛血清(fetal bovine serum,FBS)、青霉素和链霉素购自北京鼎国昌盛生物技术有限责任公司;胰蛋白酶、MTT和DMSO购自Sigma;Transwell板购自Corning;Lipofectamine 2000购自Invitrogen;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京博泰生物技术有限公司;抗Bax和Bcl-2抗体购自Cell Signaling Technology;抗基质金属蛋白酶(matrix metalloproteinase,MMP)-13、MMP-9和金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase-1,TIMP-1)抗体购自Abcam;抗GAPDH抗体购自北京中杉金桥生物技术有限公司;mirVana miRNA分离试剂盒和TaqMan miRNA试剂盒购自Applied Biosystems;反转录试剂盒(Prime Script® RT reagent kit with gDNA Eraser)和Real-time PCR 试剂盒(SYBR® Premix Ex TaqTMⅡ)购于TaKaRa;BCA蛋白浓度检测试剂盒购自Thermo。
2 方法
2.1细胞培养 C33A、HeLa、SiHa和CaSki细胞培养于DMEM培养基(含10% FBS、1%青霉素和1%链霉素)中,置于37 ℃、5% CO2及95%湿度的培养箱中培养至细胞融合度达到90%左右时进行细胞传代。
2.2细胞转染 pGenesil-1-miR-30c表达质粒由本实验室构建和保存。将生长良好的C33A、HeLa、SiHa和CaSki细胞消化计数后,以细胞密度为每孔2.5×105个接种到6孔板中,置于CO2培养箱中,待细胞融合度达到85%左右时按照Lipofectamine 2000说明书进行pGenesil-1-miR-30c细胞转染。转染的细胞培养4 h后换成完全培养基,转染成功的细胞命名为C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c;以转染pGenesil-1质粒为阴性对照(negative control, NC)组。细胞置于培养箱中用于后续实验。
2.3TaqMan real-time PCR实验 将转染的细胞以密度每孔1×106个接种到6 cm皿中,置于37 ℃、5% CO2及饱和湿度的培养箱中,待细胞融合度达到90%时收集细胞,按照mirVana miRNA分离试剂盒提取细胞中的miRNA;运用TaqMan miRNA检测试剂盒检测miR-30c的表达,采用SYBR GreenⅡ荧光染料法和IQ5TMReal-Time PCR Detection System (Bio-Rad)进行real-time PCR数据分析,结果经U6 RNA内参照校正,miR-30c的相对表达量用2-ΔΔCt表示,进行3次独立重复实验。
2.4MTT法检测细胞活力 C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c细胞及阴性对照细胞经消化计数后,以细胞密度为2.5×107/L接种于96孔板中,分别培养24 h、48 h、72 h和96 h时进行MTT实验,同时设空白对照组。每孔加入20 μL 5 g/L MTT,37 ℃继续培养4 h,弃掉培养液,每孔加入150 μL DMSO,置于摇床上室温振荡5 min,用酶标仪测定492 nm处的吸光度(A),按下式计算细胞活力抑制率:细胞活力抑制率(%)=(对照组A值-实验组A值)/实验组A值×100%。
2.5集落形成实验 C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c及阴性对照细胞经胰酶消化计数后,以每皿500个接种于10 cm细胞培养皿中,置于37 ℃、5% CO2孵箱中,每个剂量3个平行孔,培养直到通过肉眼能清晰观察到可见的细胞集落(约12 d);将培养基倒掉,PBS洗涤,甲醇固定10 min,PBS洗涤,吉姆萨染色10 min,自来水清洗,晾干后计数,按下列公式计算细胞集落形成率:集落形成率(%)=细胞集落数平均值/铺板细胞数×100%。
2.6细胞迁移实验 C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c细胞及阴性对照细胞经胰酶消化,然后在Transwells每个培养孔上室中加入2×104个细胞,下室为无血清培养基,设置空白对照组;37 ℃继续培养6 h后经4%多聚甲醛固定,乙醇脱水,结晶紫染色,洗涤。用棉签轻轻擦去上室的贴壁细胞,在显微镜下拍照并计数从Transwell上室迁移至微孔膜下层的细胞,每组设3个重复孔,通过每组Transwell的迁移细胞数比较细胞的迁移能力。
2.7流式细胞术检测细胞凋亡 C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c、CaSki-miR-30c及阴性对照细胞以细胞密度每孔4×105个接种到6孔板中,培养72 h后弃掉培养基,PBS洗涤,用无EDTA的胰酶消化细胞,加入PBS制成细胞悬液。按照Annexin V-FITC/PI试剂盒说明书操作,先加入500 μL Binding Buffer重悬细胞,再加入5 μL FITC标记的Annexin-V和5 μL PI混匀,室温下避光孵育15 min,流式细胞术检测细胞凋亡。
2.8Western blot实验 C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c、CaSki-miR-30c及阴性对照细胞经消化、离心收集细胞,用RIPA裂解液(50 mmol/L Tris-HCl, pH 7.5,150 mmol/L NaCl,1% NP-40,0.5%脱氧胆酸钠,0.1% SDS)重悬细胞,超声破碎、12 000 r/min,4 ℃离心10 min,按照BCA试剂盒说明书测定总蛋白浓度。每个样本取30 μg进行SDS-PAGE,将蛋白转移到PVDF膜上,5%脱脂奶粉室温封闭1 h,分别孵育 I 抗,以GAPDH为内参照,4 ℃过夜。TBST洗膜、孵育 II 抗,室温孵育1 h。ECL显影后扫描,蛋白相对表达量经内参校正后经Quanity One软件分析。
3 统计学处理
应用SPSS 17.0统计软件进行相关数据分析。每个实验进行3次独立重复试验。结果用均数±标准差(mean±SD)表示,两组间的比较采用t检验,多组间的比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 miR-30c在宫颈癌细胞中过表达
TaqMan Real-time PCR结果显示,转染pGenesil-1-miR-30c的宫颈癌细胞中miR-30c的表达水平均显著增加,其中C33A、HeLa、SiHa及CaSki细胞中的miR-30c表达水平与对照组比较分别显著增加(P<0.01),见图1。

Figure 1. The expression of miR-30c in the cervical cancer cells detected by TaqMan real-time PCR. Mean±SD.n=3.**P<0.01vspGenesil-1 group.
图1TaqManreal-timePCR检测miR-30c在宫颈癌细胞中的表达水平
2 miR-30c过表达对宫颈癌细胞活力的影响
MTT实验结果显示,随着培养时间的延长,miR-30c过表达的宫颈癌细胞活力逐渐降低;24 h、48 h、72 h和96 h时C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c细胞的活力均显著低于pGenesil-1细胞(P<0.05或P<0.01),表明miR-30c过表达能抑制宫颈癌细胞活力,见图2。
3 miR-30c过表达对宫颈癌细胞集落形成的影响
集落形成实验结果显示,miR-30c过表达可明显减少4种宫颈癌细胞的集落形成数,C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c细胞的集落形成率与对照组细胞比较显著降低(P<0.01),见图3。这一结果表明miR-30c过表达能抑制宫颈癌细胞的活性。
4 miR-30c过表达对宫颈癌细胞迁移的影响
Transwell结果发现,miR-30c过表达的宫颈癌细胞迁移数明显减少,C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c细胞的迁移率与对照组细胞比较显著降低(P<0.01),见图4。这一结果表明miR-30c过表达能抑制宫颈癌细胞的迁移。
5 miR-30c过表达对宫颈癌细胞凋亡的影响
Annexin V-FITC染色及流式细胞术结果显示,miR-30c过表达的宫颈癌细胞凋亡率明显增加,C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c细胞凋亡率与对照组细胞比较显著升高(P<0.05),见图5。这提示miR-30c过表达激活细胞凋亡通路,诱导细胞凋亡。
6 miR-30c过表达对细胞凋亡信号通路相关分子表达的影响
Western blot结果发现,与对照组相比,C33A-miR-30c、HeLa-miR-30c、SiHa-miR-30c和CaSki-miR-30c细胞中Bax蛋白表达明显增加,而Bcl-2的表达水平降低,差异具有统计学意义(P<0.01),见图6。
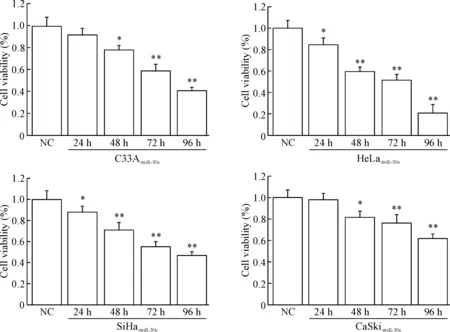
Figure 2. The effect of miR-30c over-expression on the viability of cervical cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vsNC group.
图2miR-30c过表达对宫颈癌细胞活力的影响

Figure 3. The effect of miR-30c over-expression on the colony formation ability of the cervical cancer cells. Mean±SD.n=3.**P<0.01vspGenesil-1 group.
图3miR-30c过表达对宫颈癌细胞集落形成的影响
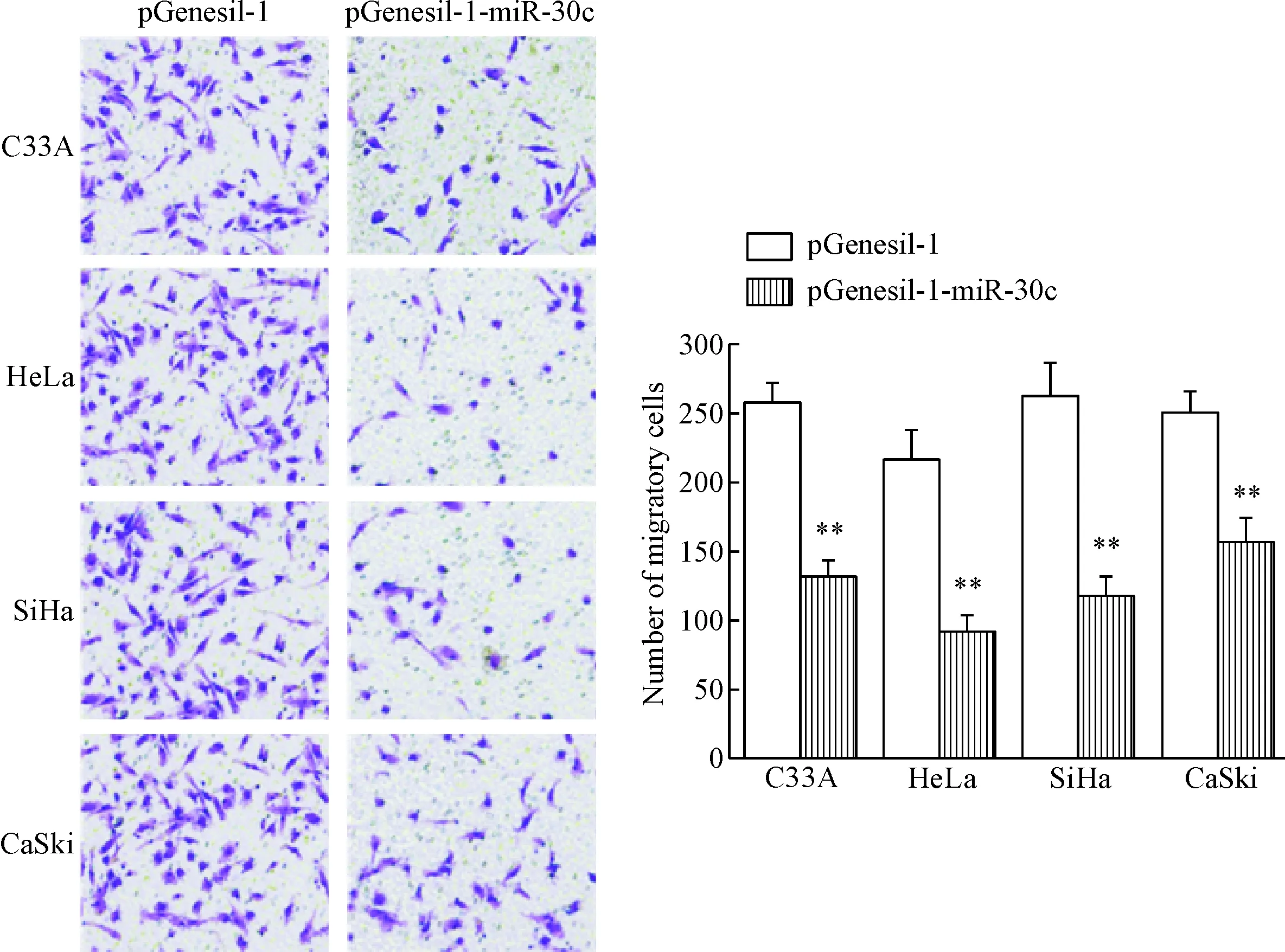
Figure 4 The effect of miR-30c over-expression on the migration ability of the cervical cancer cells (crystal violet staining, ×200). Mean±SD.n=3.**P<0.01vspGenesil-1 group.
图4miR-30c过表达对宫颈癌细胞迁移能力的影响
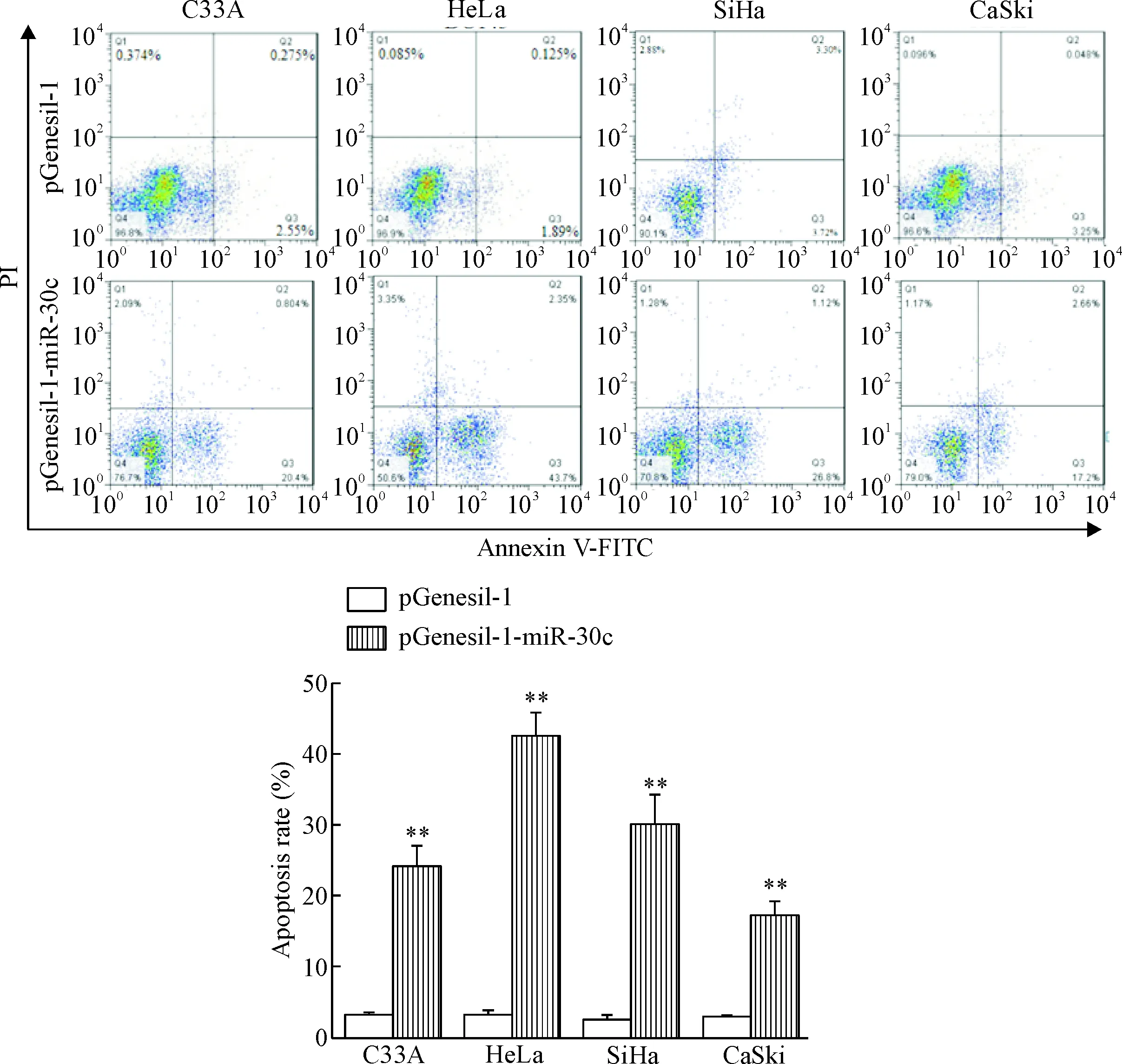
Figure 5. The effect of miR-30c over-expression on the apoptosis of cervical cancer cells. Mean±SD.n=3.**P<0.01vspGenesil-1 group.
图5miR-30c过表达对宫颈癌细胞凋亡的影响

Figure 6. The effect of miR-30c over-expression on protein expression of the apoptosis signaling pathway-related molecules in the cervical cancer cells. Mean±SD.n=3.**P<0.01vspGenesil-1 group.
图6miR-30c过表达对宫颈癌细胞凋亡信号通路相关蛋白表达的影响
7 miR-30c过表达对细胞迁移相关蛋白表达水平的影响
Western blot结果发现,miR-30c过表达的宫颈癌细胞中MMP-13蛋白表达量显著降低,而TIMP-1蛋白显著增加(P<0.01);相同条件下MMP-9蛋白表达量变化的差异无统计学显著性,见图7。这一结果提示miR-30c过表达通过调控靶基因的表达而抑制宫颈癌细胞的表型。
讨 论
宫颈癌的发病率随着年龄的增长而逐渐升高,一般在50~60岁达到高峰。据统计,中国每年约有18万新增病例[14]。目前无特异性治疗宫颈癌的靶向药物,宫颈癌发病机制仍不清楚,因此,揭示宫颈癌发病机制、研发宫颈癌靶向治疗药物迫在眉睫。大量研究发现miRNA在细胞的增殖、分化、衰老以及凋亡中具有重要作用,miRNA的异常表达与肿瘤的发生发展以及肿瘤细胞放/化疗耐受密切相关[15-17]。因此,miRNA是肿瘤靶向小分子药物的潜在靶点。目前,以miRNA-34为靶点的原发性肝癌靶向药物NCT01829971和以miR-122为靶点的丙型肝炎靶向药物NCT01872936正在进行临床I期和II期试验[18-19]。miR-30c是最新发现的miR-30家族成员,其生物学功能仍不清楚。研究发现miR-30c过表达抑制乳腺癌细胞的增殖[9];而下调miR-30c的表达可维持乳腺肿瘤干细胞的自我更新和细胞凋亡功能[10];近新的研究发现,上调miR-30c表达可抑制卵巢癌的增殖、迁移和侵袭[11]。相反,Goparaju等[12]发现miR-30c过表达促进肺癌细胞上皮间质转化从而增强细胞对吉非替尼的耐受;研究发现上调miR-30b/c的表达能抑制胶质瘤细胞调亡[13]。本研究发现miR-30c过表达显著抑制宫颈癌细胞的增殖、克隆形成能力以及迁移率,与文献[9-11]报道结果类似,提示miR-30c是一种肿瘤抑制因子参与宫颈癌的发生和发展。
目前,宫颈癌的发病机制仍不清楚,研究显示原癌基因的激活、抑癌基因的失活与宫颈癌形成的分子机制密切相关[20]。本研究发现miR-30c过表达的宫颈癌细胞的凋亡率明显增加,表明miR-30c具有诱导细胞凋亡的功能。我们进一步探讨miR-30c过表达是否激活细胞凋亡通路。Bcl-2家族是细胞凋亡通路重要的调节子,早期的研究发现Bcl-2家族中的促凋亡蛋白(Bax、Bak和Bim)和抗凋亡蛋白(Bcl-2和Bcl-xL)参与了线粒体介导的细胞凋亡过程[21]。我们的研究显发现在宫颈癌细胞中miR-30c过表达Bax蛋白水平增加,而Bcl-2蛋白水平降低,提示miR-30c过表达促进促凋亡蛋白Bax的表达和抑制抗凋亡蛋白Bcl-2的表达,细胞凋亡通路被激活,诱导宫颈癌细胞凋亡。我们的研究也发现,miR-30c过表达显著抑制宫颈癌细胞的迁移。MMP活性在肿瘤细胞转移过程中发挥关键作用[22],MMP家族成员的表达水平与恶性肿瘤的高转移活性密切相关[23]。已有研究发现,MMP-13过表达能促进乳腺癌的增殖和转移[24]。于是我们推测miR-30c过表达可能通过调控MMP和TIMP的表达而抑制宫颈癌细胞的转移,结果显示miR-30c过表达明显抑制MMP-13的表达,而促进TIMP-1表达,但对MMP-9表达无影响,提示miR-30c过表达可能通过抑制MMP-13的表达而抑制宫颈癌细胞转移。

Figure 7. The effect of miR-30c over-expression on the expression levels of target genes in the cervical cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vspGenesil-1 group.
图7miR-30c过表达对靶基因表达的影响
本研究结果表明,miR-30c过表达抑制宫颈癌细胞的增殖、迁移以及诱导细胞凋亡,其机制可能与激活细胞凋亡通路、调控MMP家族成员的表达水平有关。本研究为以miR-30c为靶点研发治疗宫颈癌的靶向药物提供科学依据。
[参 考 文 献]
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(1):69-90.
[2] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2011, 127(12):2893-2917.
[3] Ili CG, Brebi P, López J, et al. Genotyping of human papillomavirus in cervical intraepithelial neoplasia in a high-risk population[J]. J Med Virol, 2011, 83(5):833-837.
[4] 赵方辉, 胡尚英, 张思维, 等. 2004-2005年中国居民子宫颈癌死亡情况及30年变化趋势[J]. 中华预防医学杂志, 2010, 44(5):408-412.
[5] Rogers L, Siu SS, Luesley D, et al. Radiotherapy and chemoradiation after surgery for early cervical cancer[J]. Cochrane Database Syst Rev, 2012(5):CD007583.
[6] 孙栋勋, 黄栋栋, 金巧智, 等. miRNA-7介导Bax和Bcl-2表达对人鼻咽癌CNE-1细胞凋亡的影响[J]. 中国病理生理杂志, 2016, 32(5):933-937.
[7] Li Z, Lei H, Luo M, et al. DNA methylation downregulated mir-10b acts as a tumor suppressor in gastric cancer[J]. Gastric Cancer, 2015, 18(1):43-54.
[8] 杜文霞, 姬 霞. miR-193b在宫颈癌中的表达与功能及其对化疗敏感性的影响[J]. 中国病理生理杂志, 2016, 32 (7):1241-1245.
[9] Heinzelmann J, Henning B, Sanjmyatav J, et al. Specific miRNA signatures are associated with metastasis and poor prognosis in clear cell renal cell carcinoma[J]. World J Urol, 2011, 29(3):367-373.
[10] Wen JW, Zhang XZ, Liao YX, et al. miR-30c negatively regulates the migration and invasion by targeting the immediate early response protein 2 in SMMC-7721 and HepG2 cells[J]. Am J Cancer Res, 2015, 5(4):1435-1446.
[11] Jia W, Eneh JO, Ratnaparkhe S, et al. MicroRNA-30c-2* expressed in ovarian cancer cells suppresses growth factor-induced cellular proliferation and downregulates the oncogene BCL9[J]. Mol Cancer Res, 2011, 9(12):1732-1745.
[12] Goparaju CM, Blasberg JD, Volinia S, et al. Onconase mediated NFKβ downregulation in malignant pleural me-sothelioma[J]. Oncogene, 2011, 30(24):2767-2777.
[13] Lin J, Lwin T, Zhao JJ, et al. Follicular dendritic cell-induced microRNA-mediated upregulation of PRDM1 and downregulation of BCL-6 in non-Hodgkin’s B-cell lymphomas[J]. Leukemia, 2011, 25(l):145-152.
[14] 孔德璇, 瞿全新. 宫颈癌中环氧合酶2与血管内皮生长因子C的表达及相关研究[J]. 国际妇产科学杂志, 2009, 36(2):151-153.
[15] Yang W, Sun T, Cao J, et al. Downregulation of miR-210 expression inhibits proliferation, induces apoptosis and enhances radiosensitivity in hypoxic human hepatoma cellsinvitro[J]. Exp Cell Res, 2012, 318(8):944-954.
[16] Jiang P, Rao EY, Meng N, et al. MicroRNA-17-92 significantly enhances radioresistance in human mantle cell lymphoma cells[J]. Radiat Oncol, 2010, 5(1):1-8.
[17] Lynam-Lennon N, Reynolds JV, Marignol L, et al. MicroRNA-31 modulates tumour sensitivity to radiation in oesophageal adenocarcinoma[J]. J Mol Med, 2012, 90(12):1449-1458.
[18] Beg MS, Brenner AJ, Sachdev J, et al. Phase I study of MRX34, a liposomal miR-34a mimic, administered twice weekly in patients with advanced solid tumors[J]. Invest New Drugs, 2017, 35(2):180-188.
[19] Malaguarnera G, Bertino G, Chisari G, et al. Silybin supplementation during HCV therapy with pegylated interfe-ron-α plus ribavirin reduces depression and anxiety and increases work ability[J]. BMC Psychiatry, 2016, 16:398.
[20] Bahnassy AA, Zekri AR, Alam El-Din HM, et al. The role of cyclins and cyclins inhibitors in the multistep process of HPV-associated cervical carcinoma[J]. J Egypt Natl Canc Inst, 2006, 18(4):292-302.
[21] Martinou JC, Youle RJ. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Dev Cell, 2011, 21(1):92-101.
[22] Kim YH, Kwon HJ, Kim DK. Matrix metalloproteinase 9 (MMP-9)-dependent processing of βig-h3 protein regulates cell migration, invasion, and adhesion[J]. J Biol Chem, 2012, 287(46):38957-38969.
[23] Botkjaer KA, Kwok HF, Terp MG, et al. Development of a specific affinity-matured exosite inhibitor to MT1-MMP that efficiently inhibits tumor cell invasion in vitro and metastasisinvivo[J]. Oncotarget, 2016, 7(13):16773-16792.
[24] Datar I, Feng J, Qiu X, et al. RKIP inhibits local breast cancer invasion by antagonizing the transcriptional activation of MMP13[J]. PLoS One, 2015, 10(8):e0134494.
