KLF17对裸鼠移植瘤生长的影响及其在体调控靶基因的筛选和功能分析*
2018-05-17蔡兴东赖文佳黄远顺马洪明
蔡兴东, 赖文佳, 杨 莹, 张 苗, 黄远顺, 马洪明△
(暨南大学附属第一医院 1呼吸内科, 2口腔科, 3健康管理中心, 广东 广州 510630)
在全世界范围内,肺癌是最常见的恶性肿瘤之一,是男性癌性死亡的首要原因。在相对发达的国家中,肺癌位列女性癌性死亡原因的第一位[1]。当前,肺癌的死亡率在男性中处于下降趋势,但在女性中,其死亡率仍然处于上升趋势[2-3]。此外,在常见的非小细胞肺癌的病理类型中,肺腺癌的发病率明显增加[4],约占47.1%[5]。目前即使采取了手术、放疗、化疗和靶向治疗等各种手段,肺癌患者的5年生存率仍然低于14%(美国),甚至更低(5%~10%,欧洲或亚洲国家)[6],其主要原因是由于肺癌细胞的恶性增殖、侵袭和转移,因此,进一步明确肺癌细胞增殖、侵袭和转移的机制,对肺癌的早期诊断和治疗具有重要意义。
Krüppel样因子17(Krüppel-like factor 17,KLF17)是2006年新发现的KLF家族成员。研究发现,KLF17优先和β-球蛋白启动子CACCC盒结合,并且通过位点选择实验证实,KLF17的一致性结合位点是CCNC(C/G/a)CCC(C/g/a)。瞬时转染实验同样也表明,KLF17能够启动具有CACCC盒的报告基因[7],通过其锌指结构结合在相关基因的启动子区而发挥调节功能。2009年,Gumireddy等[8]发现,KLF17在乳腺癌组织中明显低表达,而Id1(inhibitor of DNA binding 1)基因高表达,其低表达与Id1基因高表达共同调控乳腺癌细胞的转移。结合临床试验结果,KLF17的表达状况可以精确预测乳腺癌是否发生淋巴结转移。此外,把KLF17转入能特异转移到肺部的乳腺癌细胞株后,能显著抑制其向肺部的转移能力。我们已经发表的文章[9]表明,KLF17在肺腺癌中表达下降,低表达KLF17的肺腺癌患者,其5年累积生存率明显低于高表达KLF17的患者;多因素Cox风险模型回归分析表明,KLF17低表达是肺腺癌患者不良预后的独立预测因素;进一步分析发现,肺腺癌患者的肿瘤T分期(反应肿瘤细胞的增殖能力)与KLF17的表达存在明显的相关性,提示KLF17可能调控肺腺癌细胞的生长或增殖;体外实验也证实,上调A549和PC-9细胞中KLF17的表达明显抑制了细胞的增殖能力。然而,KLF17在移植瘤动物模型中的作用和调控机制目前尚无文献报道。本研究旨在通过裸鼠移植瘤模型分析KLF17在肺腺癌中的作用及其调控机制,为进一步探索KLF17能否作为肺腺癌治疗靶点提供科学依据。
材 料 和 方 法
1 材料和试剂
人肺腺癌细胞株A549和H322购自中国科学院上海细胞库。BLAB/cnu/nu裸鼠11只,雄性,4周龄,购于中山大学实验动物中心,动物合格证编号为No.44008500010297。动物实验方案经中山大学动物伦理委员会审理并通过。胎牛血清和DMEM培养基均购自Gibico; 包含重组人KLF17全长cDNA(NM_173484;1170 bp)的慢病毒穿梭质粒pLV.0-KLF17及对照空质粒、含有KLF17干扰序列(5’-CGACAGTACCTTCTGACGAAAC-3’)的shRNA慢病毒质粒GV248-KLF17 shRNA及对照质粒均购自上海吉凯基因集团;RNA提取试剂TRIzol及逆转录试剂盒PrimeScript RT reagent Kit均购自Invitrogen。嘌呤霉素购自Sigma。KLF17上游引物序列为5’-GCTCTGGAGTGCACACCTCTT-3’,下游引物序列为5’-CAGCATCTCTGCGCTGTGA-3’;内参照β-actin上游引物序列为5’ -TCGTCCACCGCAAATGCTTCTAG-3’, 下游引物序列为5’-ACTGCTGTCACCTTCACCGTTCC-3’,均由广州艾基生物公司合成。蛋白提取试剂盒购自凯基生物; DAB显色试剂盒购自康为世纪生物科技有限公司; 抗KLF17 抗体购自Abgent(WB)和Sigma(IHC); 抗GAPDH抗体购自Genescript。
2 主要方法
2.1细胞培养、慢病毒构建及稳定细胞株筛选 以含有10%胎牛血清、100 mg/L链霉素及1×105U/L青霉素的DMEM完全培养液培养人肺腺癌细胞A549和H322,并置于5% CO2、37 °C培养箱中培养。pLV.0-KLF17及其对照空质粒、GV248-KLF17 shRNA慢病毒质粒及其对照质粒均含有嘌呤霉素筛选基因,可进行稳定细胞株筛选。将上述过表达和低表达质粒分别与慢病毒包装、包膜质粒按比例共转染至293FT细胞,转染48和72 h后取细胞上清液,离心去除细胞沉渣后以慢病毒浓缩液浓缩,然后分别感染A549和H322细胞,分别标记为A549-pre-KLF17和A549-pre-000及H322-shKLF17和H322-000,感染48 h后分别加入嘌呤霉素筛选稳定上调和下调KLF17及其对照细胞株,嘌呤霉素终浓度为4 mg/L培养2~3周,提取细胞总RNA及蛋白进行鉴定,鉴定成功后进行裸鼠皮下移植瘤实验。
2.2裸鼠移植瘤模型构建及在体移植瘤实验 将A549-pre-KLF17、A549-pre-000、H322-shKLF17、H322-000细胞培养至对数生长期,用0.25%的胰蛋白酶液消化待细胞变圆,加入培养液终止消化,吹打制成待测细胞悬液,离心机中(500×g)离心5min。弃上清液,用5%血清培养液重悬悬液。裸鼠11只,其中5只的左侧臀部皮下接种A549-pre-000细胞,右侧臀部皮下接种A549-pre-KLF17细胞;另外6只的左侧肩部皮下接种H322-000细胞,右侧肩部皮下接种H322-shKLF17细胞。每只裸鼠接种细胞数为4.0×106,接种体积均为100 μL。接种结束后放回笼中继续饲养观察。待成瘤后游标卡尺进行肿瘤大小测量,每3天观察测量记录一次,计算重量体积:肿瘤体积=0.5×长径×短径2,并绘制肿瘤增殖曲线。饲养30天后脱颈处死裸鼠,剥离肿瘤组织,分别测量2组肿瘤重量,分析其差异。
2.3Real-time PCR及Western blot检测 提取A549-pre-KLF17、A549-pre-000、H322-shKLF17和H322-000细胞及裸鼠移植瘤组织总RNA和总蛋白。细胞总RNA提取采用TRIzol法,按说明书进行操作。取1 μg总RNA以PrimeScript RT reagent Kit试剂盒进行逆转录成cDNA进行real-time PCR检测,以SYBR Premix Ex TaqTMkit 法进行定量PCR检测(ABI 7900 PRISM),分析各组KLF17 mRNA表达的相对差异。上述细胞和组织总蛋白提取按KeyGene蛋白提取试剂盒提供说明书进行操作。Western blot 检测以抗人KLF17 抗体(1∶200) 和抗人GAPDH抗体(1∶3 000)识别细胞及组织中KLF17及内参照蛋白的表达,具体过程参考文献[9]。
2.4免疫组织化学染色分析 采用链霉菌抗生物素蛋白-过氧化物酶连接(streptavidin-peroxidase,SP) 法免疫组织化学染色分析裸鼠移植瘤组织中KLF17蛋白的表达。配制1∶100的鼠抗人KLF17多克隆抗体工作浓度,详细步骤按SP及DAB显色试剂盒提供的说明进行。KLF17蛋白在裸鼠移植瘤组织中表达强度参考文献[10]进行评分,以染色指数=染色阳性细胞数×染色强度来评价,记录为0、1、2、3、4、6和9共7个等级,实验组裸鼠移植瘤KLF17表达的染色指数较对照组≥2个等级为裸鼠移植瘤KLF17表达上调。
2.5The Cancer Genome Atlas (TCGA)数据库资料分析 对裸鼠移植瘤模型中KLF17可能调控的靶基因,利用UCSC Xena(https://xenabrowser.net.datapages/)下载TCGA数据库(https://cancergenome.nih.gov/)GDC肺腺癌基因表达数据集临床资料,利用在线Kaplan-Meier Plotter数据进行在线表达分析及生存分析,分析KLF17调控的靶基因的功能。
2.6裸鼠移植瘤中KLF17调控的差异基因分析及其Gene Ontology (GO)和KEGG富集分析 我们将裸鼠移植瘤的肿瘤组织送上海伯豪公司做转录组学测序。获得的结果使用FANSe2软件分析(http://bioinformatics.jnu.edu.cn/software/fanse2/),合适的参数设置(mismatch: 7; seed length: 14),将过滤后的测序序列针对Ref数据库中的转录本信息进行定位分析,将分别覆盖到不同转录本的reads进行计数,得到2个样品中每个转录本各自的数量(count)。采用转录组序列版本为UCSC hg19。应用EdgeR软件对FANSe2的mapping结果进行基因定量,应用CPM(count per million)标准化后进行基因表达量差异计算。将差异基因以热点图(heatmap)表示,以在线GO(http://www.geneontology.org/)及KEGG(http://www.kegg.jp/)进行富集分析KLF17可能调控的基因。
3 统计学处理
以SPSS 16.0进行数据统计分析,裸鼠移植瘤重量组间资料采用t检验分析,两组裸鼠移植瘤生长速率的差异采用方差分析。TCGA肺腺癌数据库中相关基因mRNA表达对患者预后的影响以Kaplan-Meier法和 log-rank 检验进行分析,组间计量资料以均数±标准差(mean±SD)表示。以P<0.05差异有统计学意义。
结 果
1 KLF17对裸鼠移植瘤生长的影响
通过构建过表达载体及shRNA载体,以慢病毒技术稳定上调肺腺癌A549细胞中KLF17的表达及稳定下调H322细胞中KLF17的表达,real-time PCR及Western blot 显示KLF17在A549细胞中成功上调,在H322细胞中成功下调,见图1A、B,为后续裸鼠移植瘤做好准备。接种裸鼠移植瘤结果显示,稳定上调KLF17表达的A549细胞形成的裸鼠移植瘤,除1号裸鼠移植瘤外,均较对照细胞移植瘤明显减小,而稳定下调KLF17表达的H322细胞形成的裸鼠移植瘤较对照细胞移植瘤显著增大,见图1C、D。裸鼠移植瘤生长曲线显示,KLF17过表达的A549细胞移植瘤生长速率显著低于空载体对照的A549细胞移植瘤(P<0.05);而KLF17低表达的H322移植瘤生长速率明显高于空载体对照的H322细胞移植瘤(P<0.001),见图1E、F。饲养30天后脱颈处死移植瘤模型裸鼠,分别测量KLF17过表达及去表达组移植瘤重量,分别与对照组肿瘤进行比较,结果显示,KLF17过表达A549移植瘤重量较对照组有减少趋势(P>0.05),而KLF17去表达的H322移植瘤重量显著高于H322空载体对照移植瘤,见图1G、H。这些结果提示KLF17在活体内抑制肿瘤组织生长。
2 裸鼠移植瘤组织中KLF17的表达及其调控的靶基因
裸鼠在体实验显示KLF17抑制裸鼠移植瘤生长,但具体机制不清楚。在5只裸鼠移植瘤模型中,我们选择A549细胞移植瘤3号和4号裸鼠进行深入分析。首先分析裸鼠移植瘤中KLF17表达状况。Real-time PCR显示,过表达KLF17的移植瘤组织中KLF17 mRNA表达水平较对照空载体裸鼠移植瘤组织增高(P<0.01),见图2A;免疫组织化学染色分析显示,过表达KLF17的裸鼠移植瘤组织中KLF17蛋白表达较对照移植瘤组织明显增高(P<0.01),见图2B。通过转录组测序技术分析3、4号裸鼠移植瘤组织中差异基因的表达,结果提示,相对于对照裸鼠移植瘤,按差异表达大于2倍的基因统计,上调的基因有221个,下调的有145个,其中过表达KLF17的裸鼠移植瘤组织较对照移植瘤组织表达下调明显的基因有ANLN、ARL4D、C16orf87、CISH、CORO1C、DSG2、FSCN1、HS2ST1、KIF4A、KRT17、OAT、PRUNE2、RGS2、RHOF、RHOV、SEC24D、SPHK1、TMEM64和VCL等19个基因,提示上述基因是KLF17可能调控的靶基因(图2C),而其中以RHOF和CORO1C差异尤为显著(图2D)。对TCGA数据库中肺腺癌基因表达和预后分析的结果显示,RHOV和CORO1C mRNA高表达的肺腺癌患者的10年累计生存时间低于RHOV和CORO1C低表达的患者,其中以RHOF尤为明显,表明RHOF可能是一个癌基因,见图2E、F。这些结果表明,KLF17可能下调RHOF等癌基因的表达,进而抑制肿瘤的生长,影响患者的预后。
3 裸鼠移植瘤组织中KLF17调控的靶基因GO功能富集分析和KEGG信号通路富集分析
通过对裸鼠移植瘤瘤组织中KLF17可能调控的靶基因(差异基因)的GO基因功能富集分析,研究模型提示KLF17可能与肿瘤细胞的刺激应答、生长及黏附有关,见图3A;通过KEGG信号通路富集分析,研究模型提示KLF17可能是和细胞趋化性、黏附及细胞外基质受体相关的信号通路有关,见图3B。
讨 论
KLF17是Krüppel 样转录因子家族的新成员,能够通过其锌指结构结合在靶基因富含G/C序列的启动子区,进而启动或抑制下游基因的表达。研究表明,KLF17在肺癌[9]、肝癌[11]、胃癌[12]、甲状腺癌[13],食道癌[14]及结肠癌[15]等恶性肿瘤中表达明显下调。作为抑癌基因,KLF17低表达赋予了肿瘤更强的增殖和侵袭能力,因而KLF17低表达与患者的不良预后明显相关。目前为止,KLF17作为抑癌基因的研究是基于细胞水平的验证及临床数据的分析,尚未有KLF17对肿瘤在体功能影响的报道。在我们的研究中,上调肺腺癌细胞株A549中KLF17的表达后,KLF17明显抑制了裸鼠移植瘤的生长;而在肺腺癌细胞株H322中稳定下调KLF17的表达后,明显促进了裸鼠移植瘤的生长。我们的研究证实KLF17抑制在体裸鼠移植瘤的生长。

Figure 1. The effects of KLF17 on the xenograft tumor growth. A and B: real-time PCR and Western blot anaylsis showed that KLF17 was stably up-regulated in A549 cells and down-regulated in H322 cells after lentivirus infection; C and D: xenograft tumors in BLAB/cnu/numice were constructed with A549 cells (KLF17 up-regulation,n=5), H322 cells (KLF17 down-regulation,n=6) or their counterpart cells; E and F: xenograft tumor growth curves of BLAB/cnu/numice transplanted with KLF17 up-/down-regulation in A549 and H322 cells, respectively; G and H: xenograft tumor weight of BLAB/cnu/numice transplanted with KLF17 up-/down-regulation in A549 and H322 cells, respectively. Mean±SD.*P<0.05,**P<0.01vsA549-pre-000 group;#P<0.05,##P<0.01vsH332-000 group.
图1KLF17对裸鼠移植瘤生长的影响

Figure 2. The potential target genes regulated by KLF17 and gene function analysis of the target genes. A: the difference of KLF17 mRNA expression between KLF17-overexpressing xenograft tumor tissues and control tumor tissues determined by real-time PCR; B: immunohistochemical staining showed KLF17 protein expression in KLF17-overexpressing xenograft tumor tissues and control tumor tissues (×400, scale bar=50 μm); C: transcriptome sequencing revealed differentially expressed genes of KLF17-overexpressing xenograft tumor tissues and control tumor tissues; D: histogram showed differentially expressed genes (decreased fold); E and F: the correlation between RHOF or CORO1C mRNA expression and the overall survival rate of the patients with lung adenocarcinoma (n=513). Mean±SD.**P<0.01vsA549-pre-000 group.
图2KLF17在裸鼠移植瘤组织中的表达及KLF17调控的靶基因及其功能分析
上调裸鼠移植瘤A549细胞中KLF17的表达后,随着肿瘤的生长,与对照组比较移植瘤的生长速率明显减慢。但在5只裸鼠移植瘤模型中,仅有过表达KLF17的1号裸鼠移植瘤重于空载对照移植瘤。
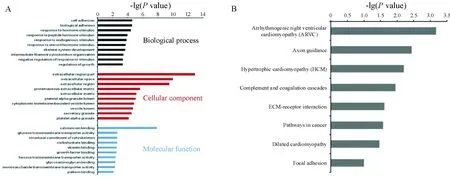
Figure 3. Gene Ontology gene function enrichment analysis (A) and KEGG PATHWAY enrichment analysis (B) of the target genes regulated by KLF17.
图3KLF17调控裸鼠移植瘤中差异表达基因的GO基因功能和KEGG信号通路的富集分析
而在下调裸鼠移植瘤中KLF17表达的6只裸鼠中,其移植瘤重量均高于空载对照移植瘤。可能的原因为(1):KLF17促进肿瘤细胞凋亡[16],在移植瘤生长过程被抑制,而未稳定上调KLF17的部分细胞克隆生长所致;(2)A549细胞株中P53基因为野生型[17],对KLF17基因抑制作用不足,导致上调KLF17对肿瘤最终生长抑制作用不明显。
我们选择裸鼠移植瘤组织中KLF17上调明显的3、4号肿瘤,real-time PCR结果显示,KLF17 mRNA在上调组移植瘤中表达明显高于对照空载组,免疫组织化学染色结果也显示KLF17在上调组移植瘤组织中表达明显升高,结合裸鼠移植瘤生长速率及肿瘤重量,进一步证实了KLF17抑制裸鼠移植瘤的生长,这为分析KLF17在体试验中调控的靶基因提供了可靠的基础。通过转录组测序技术结果显示,在3、4号裸鼠移植瘤模型中,KLF17上调组和空载体对照组移植瘤组织存在表达差异明显的基因,热点图提示至少19个基因在过表达KLF17的裸鼠移植瘤组织中表达显著下降。而表达下调超过25倍的基因有RHOV和CORO1C,提示其可能为KLF17调控的靶基因。RHOV是Rho GTP酶亚家族成员,参与调控细胞迁徙、粘附、细胞极性、细胞分裂,转录调控和细胞周期调控等[18]。RHOV过表达促进细胞丝状伪足和板状伪足的形成,也能诱导点状粘附复合体的形成,促进细胞发生粘附反应[19-20]。Shepelev 等[21]研究显示,RHOV在非小细胞肺癌细胞中高表达,高表达RHOV的非小细胞肺癌患者预后不良,提示RHOV可能是癌基因。我们通过TCGA肺腺癌数据库分析显示,RHOV高表达的肺腺癌患者,其10年累计生存率显著低于RHOV低表达的患者(P=0.002),与Shepelev 等[21]研究结果一致,提示RHOV是一个重要的癌基因。CORO1C参与细胞骨架形成,调控细胞的黏附和形态变化。在肺鳞癌细胞中下调CORO1C的表达能够抑制细胞的增殖、侵袭和转移能力[22],而在乳腺癌细胞下调CORO1C的表达,抑制了细胞的迁移能力及影响细胞肌动蛋白骨架和细胞形态[23],提示CORO1C也是一个重要的癌基因。我们的研究结果显示,KLF17可能通过下调重要的癌基因,进而抑制了裸鼠移植瘤的生长。
KLF17调控裸鼠移植瘤细胞的生长,转录组测序分析结果显示,与对照移植瘤比较,差异表达的基因有366个,其中上调的有221个,下调的基因有145个。这些差异基因可能与KLF17表达变化相关。通过Gene Ontology 及KEGG PATHWAY分析KLF17可能调控的基因的功能和参与的信号通路,能够更全面地了解该基因的作用网络。结果显示,KLF17调控的基因与肿瘤细胞的刺激应答、生长及黏附有关,参与细胞趋化性、黏附及细胞外基质受体相关的信号通路。
总之,我们的研究结果显示,KLF17抑制裸鼠移植瘤的生长,参与调控重要的癌基因表达,与肿瘤细胞的黏附、生长及细胞外基质信号通路相关。KLF17是一个重要的抑癌基因,可能作为肺腺癌治疗靶点和预后预测的分子标志物。
[参 考 文 献]
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 62(2):87-108.
[2] Malvezzi M, Arfé A, Bertuccio P, et al. European cancer mortality predictions for the year 2011 [J]. Ann Oncol, 2011, 22(4):947-956.
[3] Ahmedin J, Rebecca S, Jiaquan X, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5):277-300.
[4] Julian R, Molina MD, Ping Y, et al. Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship[J]. Mayo Clin Proc, 2008, 83(5):584-594.
[5] Brody H. Lung cancer[J]. Nature, 2014, 513(7517):S1.
[6] Lam WK, Watkins DN. Lung cancer: future directions[J]. Respiratory, 2007, 12(4):471-477.
[7] van Vliet J, Crofts LA, Quinlan KG, et al. Human KLF17 is a new member of the Sp/KLF family of transcription factors[J]. Genomics, 2006, 87(4):474-482.
[8] Gumireddy K, Li A, Gimotty PA, et al. KLF17 is a negative regulator of epithelial-mesenchymal transition and metastasis in breast cancer[J]. Nat Cell Biol, 2009, 11 (11):1297-1304.
[9] Cai XD, Zhou YB, Huang LX, et al. Reduced expression of Krüppel-like factor 17 is related to tumor growth and poor prognosis in lung adenocarcinoma[J]. Biochem Biophys Res Commun, 2012, 418(1):67-73.
[10] 黄志宏, 骆文志, 蔡兴东. KLF16在肺腺癌中表达的临床意义及机制[J].中国病理生理杂志, 2013, 29(11):1978-1983.
[11] Liu FY, Deng YL, Li Y, Zeng D, et al. Down-regulated KLF17 expression is associated with tumor invasion and poor prognosis in hepatocellular carcinoma[J]. Med Oncol, 2013, 30(1):425.
[12] Peng JJ, Wu B, Xiao XB, et al. Reduced Krüppel-like factor 17 (KLF17) expression correlates with poor survival in patients with gastric cancer[J]. Arch Med Res, 2014, 45(5):394-399.
[13] Ye WC, Gao L, Huang J, et al. Suppressed Krüppel-like factor 17 expression induces tumor proliferation, metastasis and a poor prognosis in papillary thyroid carcinoma[J]. Mol Med Rep, 2014, 10(4):2087-2092.
[14] Li S, Qin X, Cui A, et al. Low expression of KLF17 is associated with tumor invasion in esophageal carcinoma[J]. Int J Clin Exp Pathol, 2015, 8(9):11157-11163.
[15] Gao HL, Zhou N, Sun Z, et al. KLF17 expression in colorectal carcinoma and its clinical significance[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2016, 38(1):69-72.
[16] Ali A, Shah AS, Ahmad A. Gain-of-function of mutant p53: mutant p53 enhances cancer progression by inhibiting KLF17 expression in invasive breast carcinoma cells[J].Cancer Lett, 2014, 354(1):87-96.
[17] Kim JH, Kim MS, Lee BH, et al. Marmesin-mediated suppression of VEGF/VEGFR and integrin β1 expression: its implication in non-small cell lung cancer cell responses and tumor angiogenesis[J]. Oncol Rep, 2017, 37(1):91-97.
[18] Heasman SJ, Ridley AJ. Mammalian Rho GTPases: new insights into their functions frominvivostudies[J]. Nat Rev Mol Cell Biol, 2008, 9(9):690-701.
[19] Aronheim A, Broder YC, Cohen A, et al. Chp, a homologue of the GTPase Cdc42Hs, activates the JNK pathway and is implicated in reorganizing the actin cytoskeleton[J]. Curr Biol, 1998, 8(20):1125-1129.
[20] Aspenström P, Fransson A, Saras J. Rho GTPases have diverse effects on the organization of the actin filament system[J]. Biochem J, 2004, 377(Pt2):327-337.
[21] Shepelev MV, Korobko IV. The RHOV gene is overexpressed in human non-small cell lung cancer[J]. Cancer Genet, 2013, 206(11):393-397.
[22] Mataki H, Enokida H, Chiyomaru T, et al. Downregulation of themicroRNA-1/133acluster enhances cancer cell migration and invasion in lung-squamous cell carcinoma via regulation ofCoronin1C[J]. J Hum Genet, 2015, 60(2):53-61.
[23] Wang J, Tsouko E, Jonsson P, et al. miR-206 inhibits cell migration through direct targeting of the actin-binding protein coronin 1C in triple-negative breast cancer [J]. Mol Oncol, 2014, 8(8):1690-702.
