山柰酚-3-O-芸香糖苷对血管平滑肌细胞增殖、迁移及TGFBR1信号通路活化的影响*
2018-05-17张文通吴玉婷范慧婕谢凌鹏谭章斌毕艺鸣周迎春
张文通, 李 俊, 吴玉婷, 范慧婕, 谢凌鹏, 谭章斌, 毕艺鸣, 刘 彬, 2△, 周迎春△
(1南方医科大学中医药学院,广东 广州 510505; 2广州医科大学心血管疾病研究所,广东 广州 510260)
血管平滑肌细胞(vascular smooth muscle cells,VSMC)位于动脉血管壁中层,是构成血管壁的主要细胞之一。研究表明,血管平滑肌细胞的增殖和向内膜下迁移是动脉粥样硬化和经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后再狭窄的重要发病机制之一[1-3]。血管平滑肌细胞的增殖和向内膜下迁移促进粥样斑块的形成和发展,动脉粥样硬化斑块的稳定与血管平滑肌细胞的增殖和迁移密切相关[4-5]。PCI术后,血管内皮损伤、功能失调,血管平滑肌细胞发生增殖和迁移、内膜增厚,再狭窄形成[6-7]。因此,抑制血管平滑肌细胞增殖和迁移是抗动脉粥样硬化和预防PCI术后再狭窄中的重要研究方向。
转化生长因子β受体1(transforming growth factor beta receptor 1,TGFBR1)是转化生长因子β(transforming growth factor beta,TGF-β)的特异性受体,参与TGF-β的生理病理过程。TGF-β是一种多功能细胞因子,通过TGFBR1信号通路调节细胞增殖、细胞迁移、基质合成、钙化和免疫应答,以上生理病理过程参与动脉粥样硬化的发生发展[8-9]。TGF-β在PCI术后患者中表达上调,并促进PCI术后再狭窄的发展[10-11]。部分学者提出了把TGFBR1作为动脉粥样硬化早期诊断和PCI术后预后的生物学标志物[12-13]。
山柰酚-3-O-芸香糖苷(kaempferol-3-O-rutinoside,KR)是红花的提取成分之一。红花是常用的活血化瘀药之一,具有活血祛瘀、通经止痛的功效,临床常用于血瘀相关疾病,近年来常用于治疗心血管系统疾病,临床中常用的红花注射液即是以红花作为主要成分的药物制剂。现代药理研究发现,红花及其多个成分具有抗动脉粥样硬化作用,如羟基红花黄色素A、红花黄色素和红花酚苷等[14-15]。有研究发现,KR具有降压、减慢心率和抑制细胞内脂肪合成的作用[16-17]。目前国内尚未见KR对VSMC增殖和迁移影响和机制的报道。本项目将采用VSMC增殖和迁移体外模型,探索KR对VSMC的增殖、迁移及TGFBR1信号通路活化的影响。
材 料 和 方 法
1 细胞和主要实验材料
大鼠胸主动脉平滑肌细胞A7R5购自中科院细胞库。山柰酚-3-O-芸香糖苷购自成都曼思特生物科技有限公司;DMEM、胎牛血清和胰酶购自Gibco;MTT购自碧云天公司;EdU染色试剂盒购自锐博生物公司;兔抗鼠p-TGFBR1抗体购自MyBioSource;兔抗鼠p-Smad2和p-Smad3抗体购自Cell Signaling;兔抗鼠基质金属蛋白酶(matrix metalloproteinase, MMP)2和MMP9抗体购自Affinity Biosciences。
2 主要方法
2.1细胞培养 A7R5细胞培养在含10%胎牛血清、5×104U/L青霉素和50 mg/L链霉素的DMEM高糖培养基中,在37 ℃、5% CO2的恒温培养箱中培养,每2 d换液1次,待细胞长至60%~70%左右融合时传代。
2.2MTT法检测细胞活力 取对数生长期的A7R5细胞,以每孔5 000个细胞接种于96孔板,每组设置5个复孔,用不同浓度(10、20和40 μmol/L)KR刺激24 h后,或用40 μmol/L KR刺激细胞24、48、72 h后,每孔加入20 μL浓度为5 g/L 的MTT液,继续孵育4 h。弃上清,每孔加入200 μL DMSO,脱色摇床震荡10 min,结晶溶解后用酶标仪于570 nm测定吸光度(A)值。
2.3EdU染色检测细胞增殖 取对数生长期的A7R5细胞,以每孔5 000个细胞接种于96孔板,不同浓度KR刺激24 h后。弃上清,每孔加入含100 μL EdU (50 μmol/L)的培养基孵育2 h,弃上清,PBS洗2次,每次5 min。每孔加入 50 μL 细胞固定液(含4%多聚甲醛的PBS)室温孵育30 min,弃上清,每孔加入50 μL甘氨酸(2 g/L),脱色摇床上孵育5 min,弃甘氨酸溶液,每孔加入100 μL PBS,脱色摇床上清洗5 min,弃PBS;每孔加入100 μL含0.5% TritonX-100的PBS于脱色摇床上孵育10 min,PBS洗1次,5 min;每孔加入100 μL 1×Apollo 染色反应液,避光、室温、脱色摇床上孵育30 min,弃染色反应液;加入100 μL含0.5% TritonX-100的PBS于脱色摇床上清洗2~3次,每次10 min,弃渗透剂;每孔加入100 μL 甲醇清洗1~2次,每次5 min;PBS清洗1次,每次5 min;每孔加入100 μL 1×Hoechst 33342 反应液,避光、室温、脱色摇床上孵育30 min,弃染色反应液;每孔每次加入100 μL PBS清洗1~3次;荧光显微镜观察,每孔随机选择3个视野,计算EdU染色阳性细胞的比例。
2.4Transwell细胞迁移实验 取对数生长期的A7R5细胞,制备细胞悬液,以每孔1×105个细胞接种于上室,上室每孔加入200 μL纯DMEM培养基,下室加500 μL含10%胎牛血清的DMEM培养液,不同浓度KR刺激24 h后,用棉球抹去上室细胞,用4%多聚甲醛固定5 min,PBS洗2次,结晶紫染色10 min,PBS洗2次,每次5 min,光镜下观察迁移到滤膜下室面的A7R5细胞并计数。
2.5分子对接 使用分子对接技术探索TGFBR1与KR之间的关系。从Protein Data Bank (PDB)蛋白结构数据库获得TGFBR1(PDB ID:1PY5)的模拟分子结构。从PubChem Compound数据库取得KR(CID: 5318767)的3D分子结构。采用AutoDock 4.2程序对TGFBR1进行预处理,去除水分子和原始的配体,添加极性氢原子。采用YASARA软件对受体蛋白和配体进行能量最小化。以已知的TGFBR1抑制剂Quinoline与TGFBR1蛋白的结合位点为中心设置对接盒子,盒子大小50×50×50,盒子中心的坐标为X=4.44、Y=8.00、Z=4.9,点格间距离为0.375 Å。采用Autodock VINA软件进行分子对接模拟,运用Lamarckian 遗传算法,对小分子构象和位置进行全局搜索,依据最低结合能来选取最佳的结合构象。采用Pymol 2.7和Chimera 1.8.1软件进行3D作图。
2.6Western blot检测蛋白水平 各组细胞经预冷的PBS洗涤后加入含蛋白酶抑制剂和磷酸酶抑制剂的蛋白裂解液提取蛋白。离心定量后蛋白样品经10%的SDS-PAGE分离后,转移至硝酸纤维素膜上。室温下5% BSA封闭2 h,加入 I 抗,4 ℃,摇床上缓慢摇动,孵育过夜。TBST洗涤3次,每次5 min,II 抗室温孵育1 h,TBST脱色摇床上清洗3次,每次5 min。加入 ECL发光液100 μL,在MiniGel成像系统进行显影,用ImageJ软件进行半定量分析。
3 统计学处理
所有实验数据均采用SPSS 19.0统计软件进行处理,数据以均数±标准差(mean±SD)表示,多个样本均数间的比较采用单因素方差分析,组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
1 KR抑制血管平滑肌细胞增殖
将不同浓度的KR刺激A7R5细胞24 h后,MTT法观察KR对A7R5细胞活力的影响,结果显示,与control组相比,KR呈剂量依赖性抑制A7R5的细胞活力(P<0.05),见图1A。为了探索KR作用的时间效应,我们将KR(40 μmol/L)与A7R5细胞孵育24、48和72 h,MTT法观察KR对A7R5细胞活力的影响,结果显示与control组相比,KR时间依赖性的抑制A7R5细胞数量的增加(P<0.05),见图1B。EdU染色结果显示,与control组相比,KR剂量依赖性的降低EdU阳性细胞比例(P<0.05),见图1C、D。
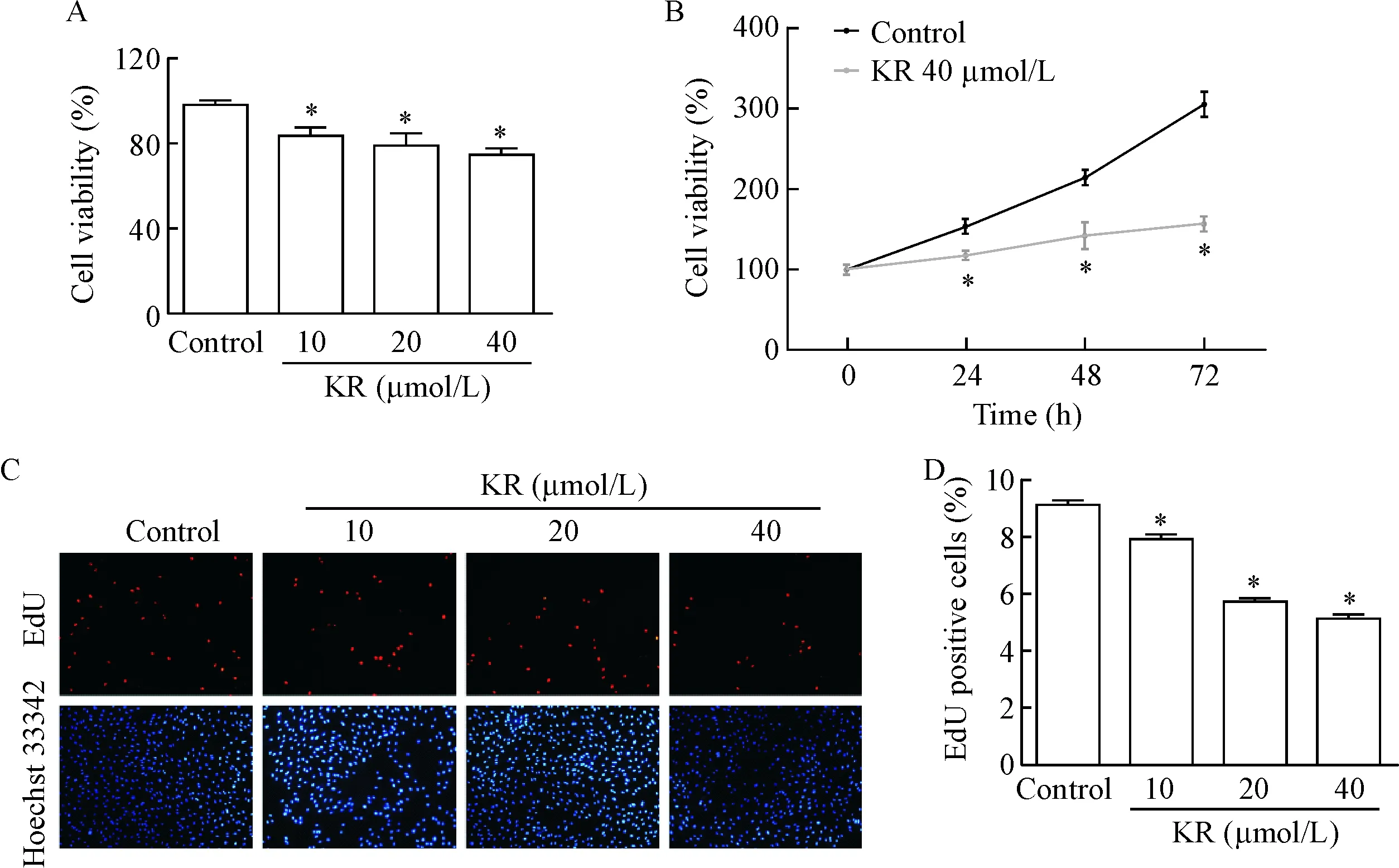
Figure 1. Kaempferol-3-O-rutinoside (KR) inhibited the proliferation of VSMC. A: the cell viability of VSMC treatment with different concentrations of KR was detected by MTT assay; B: the cell viability of VSMC with 40 μmol/L KR treatment for different time points was measured by MTT assay; C: the representative images of EdU staining (×100); D: the ratio of EdU positive cells. Mean±SD.n=3.*P<0.05vscontrol group.
图1KR抑制血管平滑肌细胞增殖
2 KR抑制血管平滑肌细胞迁移
用不同浓度的KR刺激A7R5细胞24 h后,通过Transwell迁移实验观察KR对血管平滑肌细胞迁移能力的影响,结果显示,KR剂量依赖性降低A7R5细胞的迁移细胞数,与control组相比差异有统计学意义(P<0.05),见图2。
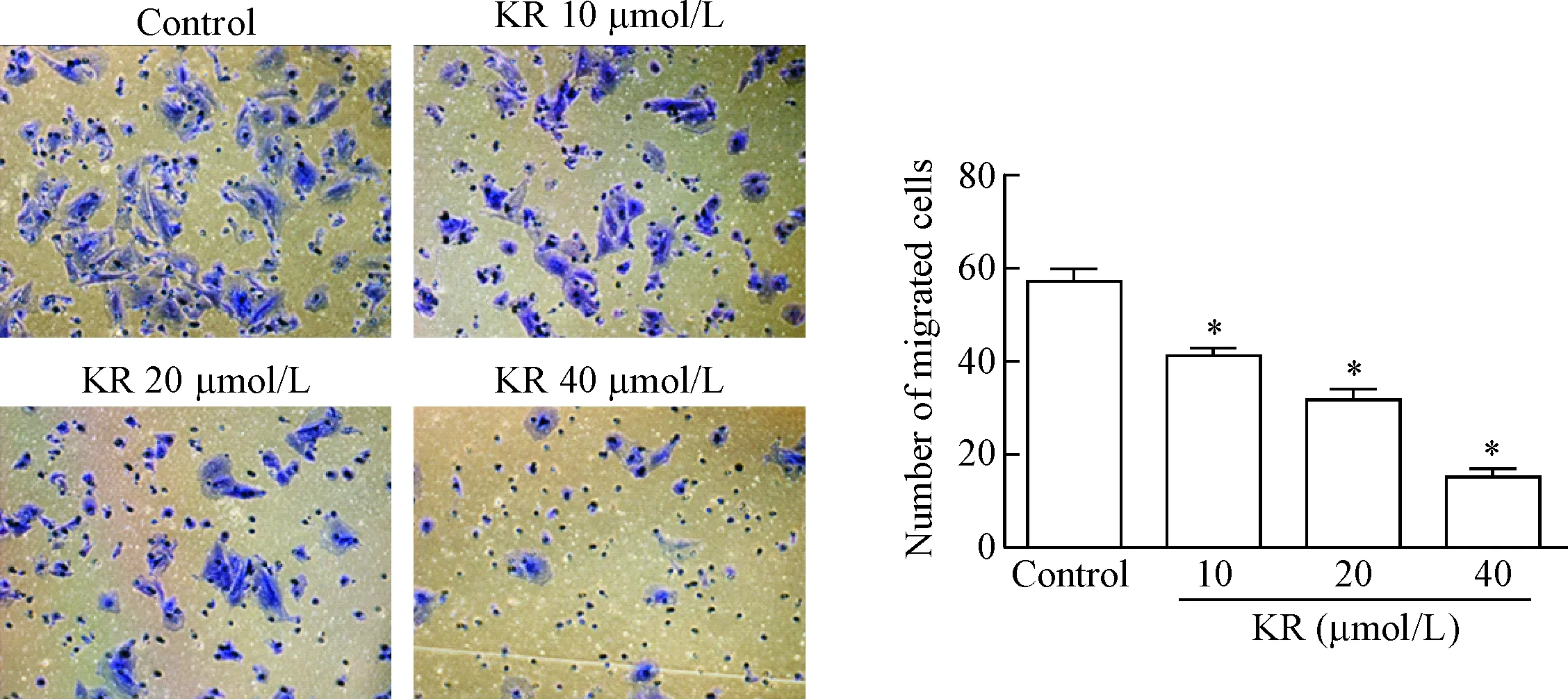
Figure 2. Kaempferol-3-O-rutinoside (KR) inhibited VSMC migration (×200). Mean±SD.n=3.*P<0.05vscontrol group.
图2KR抑制血管平滑肌细胞迁移
3 KR抑制VSMC迁移相关蛋白的表达
用不同浓度的KR刺激A7R5细胞24 h后,Western blot法检测A7R5细胞迁移相关蛋白MMP2和MMP9的表达,结果显示,与control相比,KR可降低MMP2和MMP9的表达,差异具有统计学意义(P<0.05),见图3。
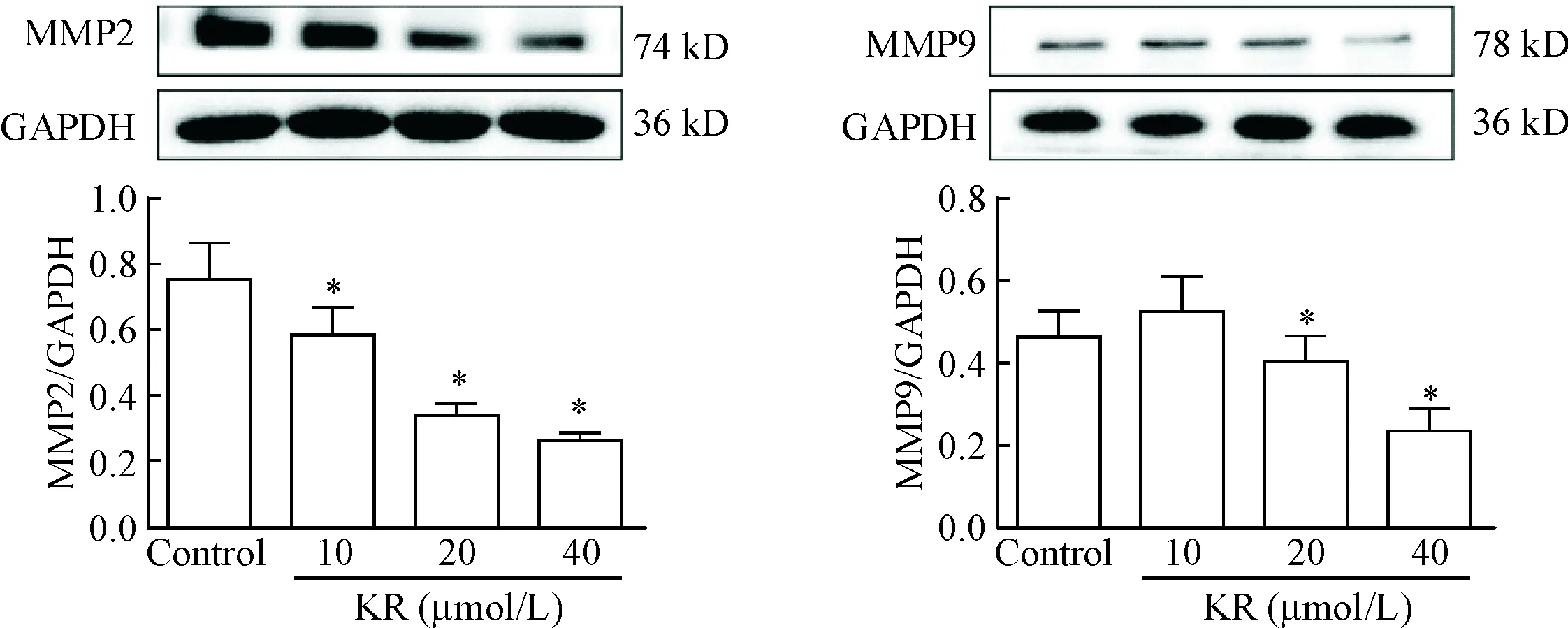
Figure 3. Kaempferol-3-O-rutinoside (KR) inhibited expression of migration-associated protein in VSMC. Mean±SD.n=3.*P<0.05vscontrol group.
图3KR抑制血管平滑肌细胞迁移相关蛋白的表达
4 KR与TGFBR1的分子对接模拟
采用AutoDock Vina分子对接方法评价TGFBR1与KR之间的关系。TGFBR1与KR的结合力为-9.804 kcal/mol,TGFBR1与KR结合的表面模拟模型见图4A,KR位于TGFBR1抑制剂结合位点之中。KR与TGFBR1结合的丝带模型见图4B,KR分别与TGBFR1的SER-280、ARG-215和LYS-335氨基酸残基形成1个氢键,氢键长度分为2.7、2.6和2.5Å,与ASP-290氨基酸残基形成3个氢键连接,氢键长度为2.3、2.4和2.6Å。
5 KR对TGFBR1信号通路活化的影响
用不同浓度的KR刺激A7R5细胞24 h后,Western blot法检测TGFBR1及其下游Smad2和Smad3的磷酸化水平,结果显示,与control组相比,KR抑制p-TGFBR1、p-Smad2和p-Smad3的蛋白水平(P<0.05)。
讨 论
VSMC增殖和向内膜下迁移是动脉粥样硬化和PCI术后再狭窄的重要机制之一[1-3]。抑制VSMC增殖和迁移可以阻止内膜新生,延缓动脉粥样硬化进展[18-19]。红花作为常用的活血化瘀中药,在动脉粥样硬化治疗中,效果显著。本研究探索红花有效成分KR对VSMC增殖和迁移的影响,进一步阐明红花抗动脉粥样硬化的有效成分和相关机制。
既往研究发现红花抗动脉粥样硬化作用,能抑制血管平滑肌细胞的增殖和迁移[20-22]。KR是红花的主要成分之一,既往研究证实KR具有抑制α-葡萄糖苷酶活性、抗糖化、抑制脂肪合成和减轻急性肝损伤的作用[16, 23-25]。本项目探索了KR对血管平滑肌细胞增殖和迁移的影响,结果显示KR剂量及时间依赖性的降低细胞活力,剂量依赖性的减少EdU染色阳性细胞数量,降低迁移细胞数量,以上结果表明KR抑制VSMC增殖和迁移的作用,可能是红花抑制动脉粥样硬化发展的主要成分之一。
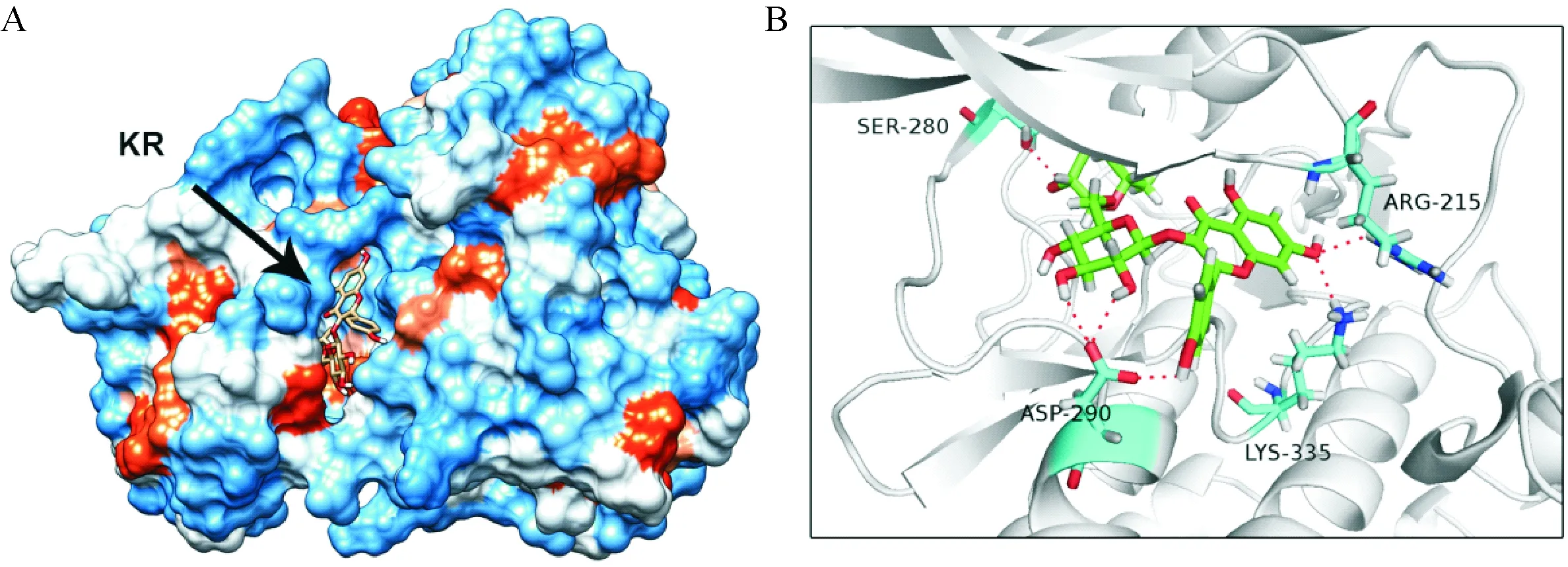
Figure 4. Kaempferol-3-O-rutinoside (KR) docked to transforming growth factor beta receptor 1 (TGFBR1). A: the 3D surfaces model of docking KR into TGFBR1; B: the ribbon model of KR binding with TGFBR1.
图4KR与TGFBR1分子对接模拟
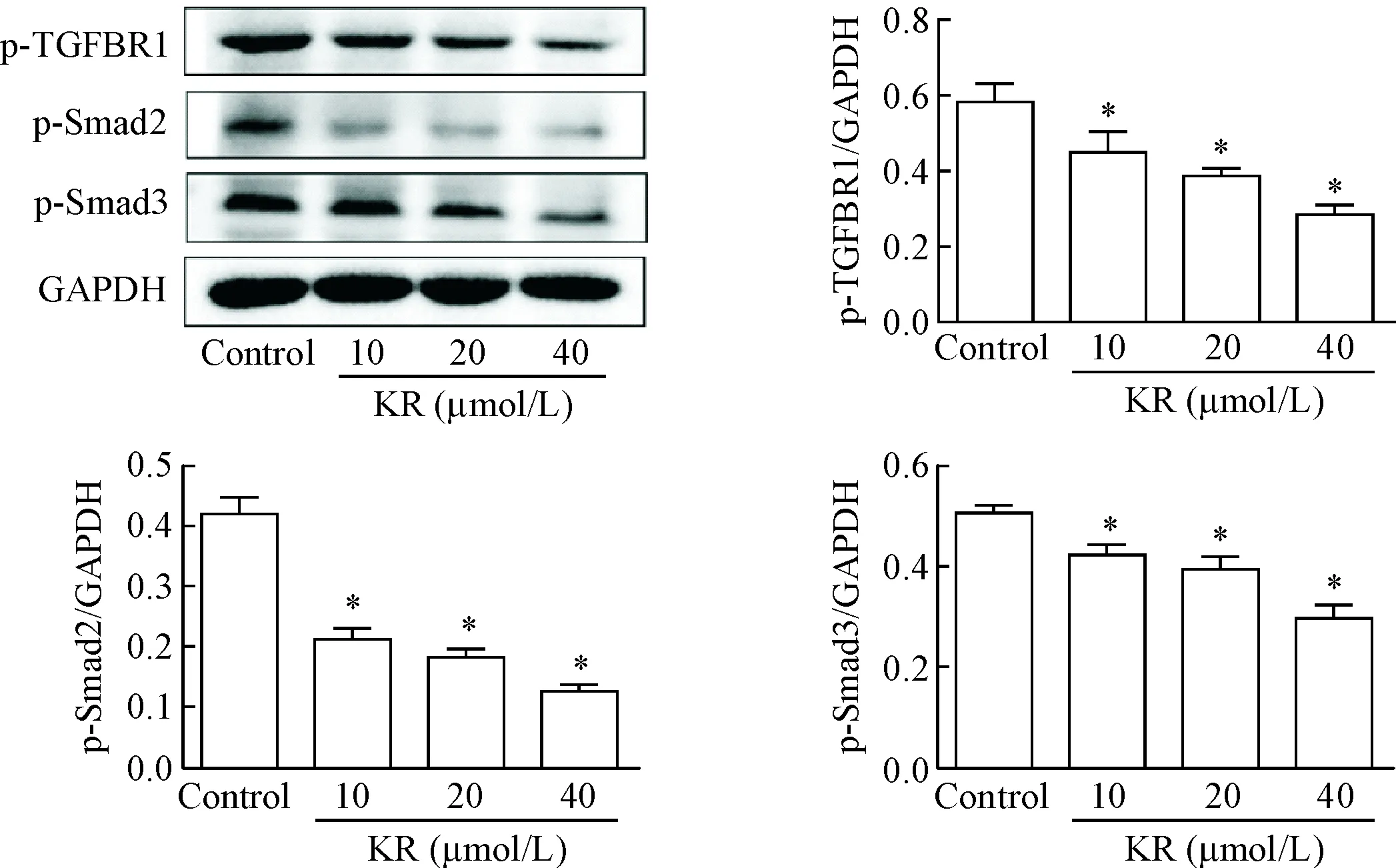
Figure 5. Kaempferol-3-O-rutinoside (KR) suppressed the activation of TGFBR1 and its downstream proteins Smad2 and Smad3. Mean±SD.n=3.*P<0.05vscontrol group.
图5KR抑制TGFBR1及其下游Smad2和Smad3的激活
TGFBR1信号通路参与广泛的生物学过程,包括细胞增殖、细胞迁移、基质合成、钙化和免疫应答,这些生理病理过程均与动脉粥样硬化和PCI术后再狭窄相关。有研究发现抑制TGFBR1可以减少低密度脂蛋白同主动脉瓣间质细胞中蛋白聚糖的结合和预防PCI术后再狭窄[26-27],可见TGFBR1是防治动脉粥样化硬发生发展的有效靶点。我们先采用分子对接技术探索KR与TGFBR1抑制的相互关系,我们发现KR与TGFBR1发生分子对接的结合力为-9.804 kcal/mol,提示KR与TGFBR1具有较好的结合活性。我们还发现KR能与TGBFR1的SER-280、ARG-215、ASP-290和LYS-335形成氢键连接,这些氨基酸残基都位于TGFBR1的激酶区域内,这些结果提示KR可能具有抑制TGFBR1活性的作用。因此,我们进一步采用Western blot法检测血管平滑肌细胞中TGFBR1的磷酸化水平,结果显示KR能剂量依赖性的降低磷酸化TGFBR1的含量,提示KR可能通过抑制TGFBR1抑制VSMC的增殖和迁移。
Smad蛋白质家族参与TGF-β、激活素和骨形态发生蛋白的信号转导。参与TGF-β信号转导的主要是Smad2和Smad3。在TGF-β信号通路中,Smad2和Smad3被活化的TGFBR1相继激活并转移至细胞核参与目的基因的调控[28-29]。因此,我们进一步检测了VSMC细胞中Smad2和Smad3 的激活。结果显示,KR剂量依赖性抑制TGFBR1其下游 Smad2和Smad3 的激活,这提示KR可能通过抑制TGFBR1从而抑制Smad信号的激活。既往研究发现Smad具有调控MMP2和MMP9表达作用[30]。本研究发现KR能够降低MMP2和MMP9的表达,这提示KR可能通过抑制TGFBR1及其下游的Smad信号的激活,进而抑制MMP2和MMP9的表达抑制VSMC的迁移。
综上所述,在本研究中我们明确了KR能抑制VSMC的增殖和迁移,同时发现KR可能是一个潜在的TGBFR1抑制剂,其抗增殖及迁移的作用与抑制TGFBR1及其下游信号分子密切相关。本次研究结果提示抑制TGFBR1可能是KR防治动脉粥样硬化以及其他心血管疾病的新靶点。
[参 考 文 献]
[1] Jukema JW, Ahmed TA, Verschuren JJ, et al. Restenosis after PCI. Part 2: prevention and therapy[J]. Nat Rev Cardiol, 2011, 9(2):79-90.
[2] Hansson GK, Hermansson A. The immune system in atherosclerosis[J]. Nat Immunol, 2011, 12(3):204-212.
[3] Ross R. The pathogenesis of atherosclerosis: a perspective for the 1990s[J]. Nature, 1993, 362(6423):801-809.
[4] Bennett MR, Sinha S, Owens GK. Vascular smooth muscle cells in atherosclerosis[J]. Circ Res, 2016, 118(4):692-702.
[5] Schwartz SM. Smooth muscle migration in atherosclerosis and restenosis[J]. J Clin Invest, 1997, 100(11 Suppl):S87-S89.
[6] Marx SO, Totary-Jain H, Marks AR. Vascular smooth muscle cell proliferation in restenosis[J]. Circ Cardiovasc Intervent, 2011, 4(1):104-111.
[7] Jukema JW, Verschuren JJ, Ahmed TA, et al. Restenosis after PCI. Part 1: pathophysiology and risk factors[J]. Nat Rev Cardiol, 2012, 9(1):53-62.
[8] Zhang YE. Mechanistic insight into contextual TGF-β signaling[J]. Curr Opin Cell Biol, 2017, 51(21):1-7.
[9] Toma I, Mccaffrey TA. Transforming growth factor-β and atherosclerosis: interwoven atherogenic and atheroprotective aspects[J]. Cell Tissue Res, 2012, 347(1):155-175.
[10] Aihara K, Ikeda Y, Yagi S, et al. Transforming growth factor-β1 as a common target molecule for development of cardiovascular diseases, renal insufficiency and metabolic syndrome[J]. Cardiol Res Pract, 2011, 2011(3):1-9.
[11] Sergienko IV, Masenko VP, Semenova AE, et al. Effect of myocardial revascularization on dynamics of factors of angiogenesis in patients with ischemic heart disease[J]. Kardiologiia, 2009, 49(12):4-10.
[12] Dąbek J, Bays M, Piotrkowicz J, et al. May the transcriptional activity of transforming growth factor beta 1 gene be a marker for early stages for coronary atherosclerosis?[J]. Atherosclerosis, 2016, 252(Suppl C):e78-e79.
[13] Devaux Y, Bousquenaud M, Rodius S, et al. Transforming growth factor β receptor 1 is a new candidate prognostic biomarker after acute myocardial infarction[J]. BMC Med Genomics, 2011, 4(1):83.
[14] 李淑娇, 唐于平, 沈 娟, 等. 药对研究(Ⅷ)——丹参-红花药对[J]. 中国中药杂志, 2013, 38(24):4227-4231.
[15] 靳宏光, 姜 琛, 田宇丹. 羟基红花黄色素A对兔动脉粥样硬化影响的实验研究[J]. 上海中医药杂志, 2011, 45(4):67-68.
[16] Jang Y, Wang Z, Lee J, et al. Screening of Korean natural products for anti-adipogenesis properties and isolation of kaempferol-3-O-rutinoside as a potent anti-adipogenetic compound from solidago virgaurea[J]. Molecules, 2016, 21(2):226-236.
[17] Ahmad M, Gilani A, Aftab K, et al. Effects of kaempfe-rol-3-O-rutinoside on rat blood pressure[J]. Phytother Res, 1993, 7(4):314-316.
[18] Chen S, Dong S, Li Z, et al. Atorvastatin calcium inhibits PDGF-ββ-induced proliferation and migration of VSMCs through the G0/G1cell cycle arrest and suppression of activated PDGFRβ-PI3K-Akt signaling cascade[J]. Cell Physiol Biochem, 2017, 44(1):215-228.
[19] Porter KE, Naik J, Turner NA, et al. Simvastatin inhibits human saphenous vein neointima formation via inhibition of smooth muscle cell proliferation and migration[J]. J Vasc Surg, 2002, 36(1):150-157.
[20] 孔建明. 红花桑寄生叶提取物槲皮素对大鼠血管平滑肌细胞增殖及迁移能力的影响[J]. 中国中医药科技, 2014, 21(2):159-161.
[21] 宋鲁成, 沈 军. 红花对AngⅡ诱导大鼠胸主动脉血管平滑肌细胞凋亡和Caspase-3表达的影响[J]. 山东医药, 2013, 53(31):26-27.
[22] 段文卓,宫海民. 红花、郁金对血管平滑肌细胞表型及增殖变化的影响[J]. 中国病理生理杂志, 2000, 16(10):116-117.
[23] Wang Y, Tang C, Zhang H. Hepatoprotective effects of kaempferol 3-O-rutinoside and kaempferol 3-O-glucoside fromCarthamustinctoriusL. on CCl4-induced oxidative liver injury in mice[J]. J Food Drug Anal, 2015, 23(2):310-317.
[24] Lal SS, Abbas G, Siddiqui H, et al. Synthesis and antiglycation activity of kaempferol-3-O-rutinoside (nicotiflorin)[J]. Med Chem, 2012, 8(3):415-420.
[25] Habtemariam S. A-glucosidase inhibitory activity of kaempferol-3-O-rutinoside[J]. Nat Prod Commun, 2011, 6(2):201-203.
[26] Osman N, Grande-Allen KJ, Ballinger ML, et al. Smad2-dependent glycosaminoglycan elongation in aortic valve interstitial cells enhances binding of LDL to proteoglycans[J]. Cardiovasc Pathol, 2013, 22(2):146-155.
[27] Kingston PA, Sinha S, David A, et al. Adenovirus-me-diated gene transfer of a secreted transforming growth factor-beta type II receptor inhibits luminal loss and constrictive remodeling after coronary angioplasty and enhances adventitial collagen deposition[J]. Circulation, 2001, 104(21):2595-2601.
[28] Massague J. Smad transcription factors[J]. Genes Dev, 2005, 19(23):2783-2810.
[29] Derynck R, Zhang Y, Feng XH. Smads: transcriptional activators of TGF-beta responses[J]. Cell, 1998, 95(6):737-740.
[30] Wiercinska E, Naber HP, Pardali E, et al. The TGF-β/Smad pathway induces breast cancer cell invasion through the up-regulation of matrix metalloproteinase 2 and 9 in a spheroid invasion model system[J]. Breast Cancer Res Treat, 2011, 128(3):657-666.
