1株高效溶磷细菌的分离、鉴定和溶磷能力研究
2018-05-17屈建航张璐洁符运会李海峰田海龙
屈建航,张璐洁,符运会,李海峰,田海龙
(河南工业大学 生物工程学院,河南 郑州 450001)
土壤中磷元素对植物的生长至关重要,但土壤中能被植物体直接吸收利用的可溶性磷含量较低[1],而具有溶磷能力的微生物能够将土壤中的难溶性磷转化为生物有效磷,从而改善土壤的磷源结构,提高作物产量[2]。溶磷微生物目前报道的包括溶磷细菌、真菌和放线菌,其中以细菌居多,主要涉及芽孢杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、假单胞菌属(Pseudomonas),还有一些如沙雷氏菌属(Serratia)、埃希氏菌属(Escherichia)、欧文氏菌属(Erwiia)等[3-4]。目前,国内对无机磷降解菌的研究已有很多报道,尤其是利用溶磷菌促进农业生产方面。冯瑞章等[5]在土壤中施用溶磷菌制成的菌剂后发现,菌剂能显著提高燕麦地下生物量,最大增长率高达336.51%。南京林业大学[6]从江西省南昌市林业科学院中国枫香根际土壤中分离得到的1株高效溶磷脂的蜡状芽孢杆菌可明显促进中国枫香苗的生长,接种90 d,苗高增长率达37.80%,地径增长率达32.09%。苑伟伟等[7]从青岛蔚蓝生物研发中心得到溶磷菌和促生菌配制的一种高效溶磷菌复合菌剂,其能使土壤有效磷含量提高66.50%,油菜鲜质量提高30.76%。稳定、高效的溶磷菌种筛选,仍然是溶磷微生物菌剂研制和保护土壤、实现绿色可持续农业发展的重要前提。传统的溶磷细菌多分离自土壤,而水体尤其是富营养化水体的沉积物是微生物天然的种质资源库,含有丰富的微生物多样性及未培养菌属[8],其中溶磷微生物分布亦十分丰富。本研究从太湖表层沉积物中筛选高效溶磷细菌,鉴定并完成溶磷能力测定,为溶磷微生物菌剂的研制提供依据。
1 材料和方法
1.1 试验材料
1.1.1 样品采集 2011年3月用抓土漏斗法采集太湖污染较严重的16个位点表层沉积物,采集后置冰盒带回实验室备用。
1.1.2 培养基 无机磷培养基参考李文红等[9]的方法:葡萄糖10 g、(NH4)2SO40.5 g、NaCl 0.3 g、KCl 0.3 g、FeSO4·7H2O 0.03 g、MnSO4·4H2O 0.03 g、MgSO4·7H2O 0.3 g、Ca3(PO4)210 g、蒸馏水1 000 mL,pH值 7.0~7.2,115 ℃灭菌30 min;其中Ca3(PO4)2单独灭菌,使用前添加。固体培养基加琼脂15 g。牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂15 g、水1 000 mL,pH值 7.0~7.2,121 ℃灭菌20 min,用于菌株的活化和保藏。
1.2 试验方法
1.2.1 溶磷菌分离 取5 g沉积物样品、19 mL钠型离子交换树脂、30 mL的1 g/L脱氧胆酸钠和2.5 g玻璃珠(直径0.5 mm),在4 ℃条件下低速振荡 2 h,静止1 h后,取上层菌悬液[10]。常规10倍梯度稀释法涂布无机磷培养基平板,定期观察菌落及透明圈形成情况,记录圈径比[11],挑取圈径比较大的菌落,纯化并保藏于牛肉膏蛋白胨培养基。
1.2.2 菌种分类地位鉴定 参考东秀珠等[12]的方法完成基础生理生化指标的鉴定,并结合基于16S rRNA基因的系统发育分析[13],对溶磷菌株进行系统分类地位鉴定。用无菌牙签挑取少量单菌落,碱提法制备DNA模板,同时以1.5 μL无菌水为模板作为阴性对照。以16S rRNA基因通用引物Escherichiacoli27f和1495r进行PCR扩增:94 ℃ 3 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。产物进行琼脂糖凝胶电泳检测,送上海生工生物工程有限公司完成核苷酸序列测定。测序结果于GenBank数据库(http://www.ncbi.nlm.nih.gov/)进行BLAST比对分析[14],下载相关序列并以MEGA 5.0软件构建系统发育树[15]。
1.2.3 溶磷能力测定 新鲜菌液定量接种于100 mL无菌无机磷培养基,160 r/min、28 ℃条件下摇床振荡培养5 d,设置3组平行。定期取培养液,3 000 r/min离心30 min,取上清液,使用钼蓝比色法测定磷含量[16];以无菌培养液代替菌液,设置空白对照,消除体系影响。使用PHS-3C酸度计,测定培养液的pH值变化。
1.2.4 对土壤溶磷效果的测定 供试土壤采集自郑州市郊区农田,采样深度0~20 cm,采集后除杂。30 g土壤加入90 mL无菌水。接种溶磷菌液10 mL,同时以接种10 mL灭活菌液作为平行对照组。25 ℃条件下静置,在预定时间点取上清液,钼蓝比色法测定其中可溶性有效磷含量。
2 结果与分析
2.1 溶磷菌株初筛结果
不定期观察涂布的无机磷平板,结果表明,太湖沉积物中溶磷细菌含量丰富,约为2.40×104cfu/g,从中共初筛到8株具有溶磷能力的菌株。其中,HXZ-21-Ⅲ具有最大的圈径比,培养4 d时的圈径比为3.59,选择其作为本研究的出发菌株。点接于无机磷平板,培养7 d时的溶磷圈结果如图1所示。
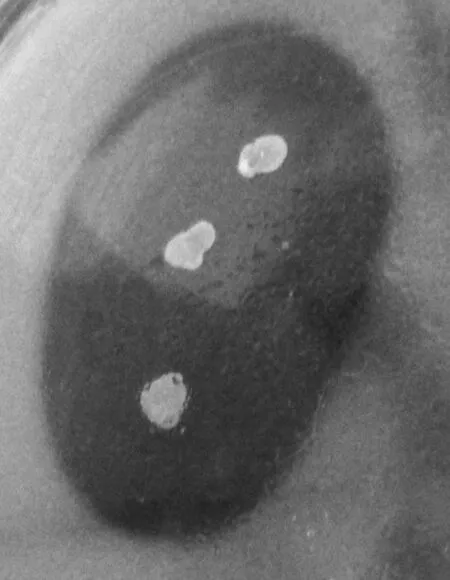
图1 菌株HXZ-21-Ⅲ及其溶磷圈
2.2 溶磷菌株HXZ-21-Ⅲ系统发育鉴定结果
生理生化鉴定结果表明,菌株HXZ-21-Ⅲ菌落呈乳白色,表面光滑,革兰氏染色阴性,接触酶反应阳性,氧化酶反应阳性,甲基红反应阴性。PCR扩增菌株HXZ-21-Ⅲ的16S rRNA基因片段,并测定核苷酸序列,提交GenBank,登录号为JX857813。完成BLAST比对并下载相关序列,邻接法构建系统发育树。菌株HXZ-21-Ⅲ的16S rRNA基因与Burkholderiafungorum(BAYC01000104)[17]和Burkholderiainsulsa(KF733462)[18]同源性最高,分别为99.08%和98.87%。系统发育树结果(图2)显示,菌株HXZ-21-Ⅲ与相关菌种B.fungorum和B.insulsa的模式株聚在1个分支,表明菌株HXZ-21-Ⅲ为伯克氏菌(Burkholderiasp.)。

以Burknolderia andropogonis ICMP2807T为外围
2.3 溶磷菌株HXZ-21-Ⅲ的溶磷曲线
菌株HXZ-21-Ⅲ的溶磷曲线如图3所示,结果表明,无机磷培养基中培养72 h时,溶磷量达最高,为16.6 μmol/mL,曲线呈现先上升后下降的趋势,而培养液中的pH值变化趋势刚好相反,在菌体溶磷量上升的过程中,pH值处于下降趋势,在最高溶磷量时,pH值达到最低点(3.5),之后逐渐上升至5左右。

图3 菌株HXZ-21-Ⅲ的溶磷量及pH值变化曲线
2.4 溶磷菌株HXZ-21-Ⅲ对土壤磷的溶出能力
以土壤作为磷源,磷溶出结果如图4所示,相对于对照组,菌株HXZ-21-Ⅲ能明显提高土壤中磷的溶出效果,在48 h时达到最大溶出量,对应体系中可溶性磷含量为0.47 μmol/mL,较对照(0.25 μmol/

图4 菌株HXZ-21-Ⅲ对土壤磷的溶出效果
mL)高0.22 μmol/mL。
3 结论与讨论
磷是DNA、RNA、ATP和磷酸类脂等生命大分子的重要组成部分,也是植物生长发育的关键物质[19],土壤中磷含量是土壤肥力的最重要的限制性因素之一[20]。溶磷微生物能溶出不溶性矿物磷,提高土壤磷肥力[21]。一般认为,施用溶磷微生物肥料能够缓解长期施用化学肥料引起的土壤退化、板结等问题[22],而高效、稳定的溶磷菌株的获取,是构建微生物磷肥的关键。1908年首次发现溶磷微生物的存在,1935年前苏联研究者从土壤中分离到的芽孢杆菌,使土壤中P2O5形式的磷含量提高15%以上,并在1947年大量使用[23]。国内对溶磷微生物的研究起步较晚,1955年陈延伟[24]发现1株具有较强溶解磷酸三钙能力的无孢子杆菌,可使玉米干质量提高32%~45%,谷子的干质量提高51%。1993年刘荣昌等[25]分离出欧文氏菌属的溶磷细菌,制成菌剂施入土壤,使小麦增产10.4%,绿豆增产23.8%。近年来,国内溶磷细菌的溶磷能力可达190~663 mg/L[26]。
溶磷微生物的作用机制主要包括有机酸的产生、质子的释放和酸性磷酸酶的生物合成[27]。一般认为,溶磷菌的溶无机磷能力主要取决于其分泌有机酸的能力,有机酸可使培养液的pH值下降,与铁、钙、镁、铝等金属离子形成络合物,使难溶性磷酸盐中的磷释放[28]。本研究中,菌株的溶磷能力与pH值呈负相关,这与多数研究报道结果[29-31]一致,但与部分报道[32-33]有所不同,原因可能是不同菌种的溶磷微生物的溶磷作用机制不同。此外,菌株HXZ-21-Ⅲ为伯克氏菌,而伯克氏菌可利用葡萄糖为碳源产生乙酸和葡萄糖酸,使酸度提高,pH值下降,从而溶解环境中的不溶性磷[34]。目前,溶磷微生物菌株大多分离自土壤样品,而水体沉积物是一种新型微生物种质资源库,具备较好的待发掘前景。宋炜等[35]对太湖沉积物中溶磷细菌分布及其与碱性磷酸酶活性的关系进行研究发现,溶磷菌在秋季种类最多,冬季最少,溶磷能力较强的菌株大部分出现在夏季。此外,不同的土壤中溶磷微生物数量不同,一般为:黑钙土>黄棕壤>白土>红壤>砖红壤>瓦碱土,因为溶磷菌在土壤中的数量及生态分布主要受土壤质地、有机质含量、土壤类型、耕作栽培方式的影响[36],因此,新型生态环境更加有利于溶磷微生物的开发利用。
本研究自太湖沉积物分离到1株高效溶磷细菌HXZ-21-Ⅲ,经鉴定为伯克氏菌,实验室条件下溶磷能力为16.6 μmol/mL,能有效提高土壤磷的溶出效率。当前国内外研究并应用于微生物肥料生产的溶磷细菌菌株主要是芽孢杆菌[22],伯克氏菌在农业上作为生物降解、控制及促进植物生长的根际微生物[37],为溶磷菌株HXZ-21-Ⅲ的实践应用奠定了基础。
参考文献:
[1] 王庆仁,李继云,李振声.植物高效利用土壤难溶态磷研究动态及展望[J].植物营养与肥料学报,1998,4(2):107-116.
[2] 盛荣,肖和艾,谭周进,等.土壤解磷微生物及其磷素有效性转化机理研究进展[J].土壤通报,2010,41(6):1505-1510.
[3] 许云台.西湖沉积物中微生物对有机磷循环影响研究[D].杭州:浙江大学,2005.
[4] 杜雷,王素萍,陈钢,等.一株高效解磷细菌的筛选、鉴定及其溶磷能力的研究[J].中国土壤与肥料,2017(3):136-141.
[5] 冯瑞章,姚拓,周万海,等.溶磷菌对燕麦生物量及植株氮、磷含量的影响[J].水土保持学报,2009,23(2):188-192.
[6] 南京林业大学.一种蜡状芽孢杆菌及其在促进中国枫香生长中的应用:CN201210328300.3[P].2012-11-28.
[7] 苑伟伟,赵阳国,井永苹,等.一种高效解磷复合菌剂的筛选与应用[J].山东农业科学,2016,48(12):86-90.
[8] Koizumi Y,Kojima H,Fukui M.Characterization of depth-related microbial community structure in lake sediment by denaturing gradient gel electrophoresis of amplified 16S rDNA and reversely transcribed 16S rRNA fragments [J].FEMS Microbiology Ecology,2003,46(2):147-157.
[9] 李文红,施积炎.西湖沉积物中解磷菌的分离纯化及其解磷能力[J].应用生态学报,2006,17(11):2112-2116.
[10] Li C,Yuan H,Huang H.Vertical distribution of phosphorus and P-dissolving/decomposing bacteria in the sediment of Guanting reservoir [J].Science in China Series D (Earth Sciences),2005,48(2):285-294.
[11] 孙珊,黄星,范宁杰,等.一株溶磷细菌的分离、鉴定及其溶磷特性研究[J].土壤,2010,42(1):117-122.
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13] Qu J H,Yuan H L,Li H F,etal.Flavobacteriumcauensesp.nov.isolated from sediment of a eutrophic lake [J].International Journal of Systematic and Evolutionary Microbiology,2009,59(11):2666-2669.
[14] Altschul S F,Madden T L,Schaffer A A,etal.Gapped BLAST and PSI-BLAST:A new generation of protein database search programs [J].Nucleic Acids Research,1997,25(17):3389-3402.
[15] Tamura K,Peterson D,Peterson N,etal.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods [J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[16] 赵小蓉,林启美.细菌解磷能力测定方法的研究[J].微生物学通报,2001,28(1):1-4.
[17] Coenye T,Laevens S,Willems A,etal.Burkholderiafungorumsp.nov.andBurkholderiacaledonicasp.nov.,two new species isolated from the environment,animals and human clinical samples[J].International Journal of Systematic and Evolutionary Microbiology,2001,51(3):1099-1107.
[18] Rusch A,Islam S,Savalia P,etal.Burkholderiainsulsasp.nov.,a facultatively chemolithotrophic bacterium isolated from an arsenic-rich shallow marine hydrothermal system [J].International Journal of Systematic and Evolutionary Microbiology,2015,65(1):189-194.
[19] Li J,Li Z,Wang F,etal.Effects of nitrogen and phosphorus addition on soil microbial community in a secondary tropical forest of China [J].Biology and Fertility of Soils,2015,51(2):207-215.
[20] Shi X K,Ma J J,Liu L J.Effects of phosphate-solubilizing bacteria application on soil phosphorus availability in coal mining subsidence area in Shanxi [J].Journal of Plant Interactions,2017,12(1):137-142.
[21] Chen Y P,Rekha P D,Arun A B,etal.Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J].Applied Soil Ecology,2006,34(1):33-41.
[22] 邢芳芳,高明夫,禚优优,等.玉米根际高效溶磷菌的筛选、鉴定及溶磷特性研究[J].中国农学通报,2016,32(9):119-124.
[23] 李海云,孔维宝,达文燕,等.土壤溶磷微生物研究进展[J].微生物学通报,2013,48(7):1-5.
[24] 陈延伟.微生物对不溶性无机磷化合物的分解能力及其接种效果[J].微生物学报,1955,2(5):210-215.
[25] 刘荣昌,李凤汀,郝正然,等.小麦接种联合固氮菌增产原因分析[J].华北农学报,1993,8(2):73-77.
[26] 陈丹阳,李汉全,张炳火,等.两株解磷细菌的解磷活性及作用机制研究[J].中国生态农业学报,2017,25(3):410-418.
[27] 林燕青,吴承祯,洪伟,等.解磷菌的研究进展[J].武夷科学,2015,31(1):161-169.
[28] 安志装,介晓磊,李有田,等.不同水分和添加物料对石灰性土壤无机磷形态转化的影响[J].植物营养与肥料学报,2002,8(1):58-64.
[29] 白文娟,胡蓉蓉,章家恩,等.玉米根际溶磷细菌的分离、筛选及溶磷能力研究[J].华南农业大学学报,2013,34(2):167-176.
[30] 王继雯,刘莉,岳丹丹,等.4株溶磷解钾芽孢杆菌的互作效应研究[J].中国农学通报,2015,31(18):132-139.
[31] 郭艺鹏,王海儒,孙林琦,等.枣根际解磷细菌的分离筛选及16S rDNA鉴定[J].河南农业大学学报,2015,49(12):811-813.
[32] 李海峰,张月阳,曹健,等.耐寡营养高效解磷菌株XMT-5的分离鉴定及解磷特性[J].河南农业科学,2017,46(8):67-71.
[33] 陈俊,陆俊锟,康丽华,等.红树林溶磷菌的初步鉴定、溶磷能力测定及其优化培养[J].微生物学通报,2009,36(8):1183-1188.
[34] 李海峰,李志健,屈建航.解磷微生物及其应用的研究[J].贵州农业大学学报,2012,40(10):108-110.
[35] 宋炜,袁丽娜,肖琳,等.太湖沉积物中解磷细菌分布及其与碱性磷酸酶活性的关系[J].环境科学,2007,28(10):2355-2360.
[36] 王光华,赵英,周德瑞,等.解磷菌的研究现状与展望[J].生态环境学报,2003,12(1):96-101.
[37] 江琳琳.生物炭对土壤微生物多样性和群落结构的影响[D].沈阳:沈阳农业大学,2016.
