人工耳蜗植入与骨髓间充质干细胞移植联合治疗感音神经性耳聋研究进展
2018-05-16尹晓玲火子榕严爽张治华
尹晓玲火子榕严爽 张治华
1上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科2上海交通大学医学院耳科学研究所3上海市耳鼻疾病转化医学重点实验室
耳聋是人类最常见的致残性疾病之一,据WHO2013年的数据显示[1],全世界范围内约有3.6亿人遭受听力损伤的困扰,其中感音神经性听力下降占大部分。生活方式的改变,人口老龄化以及长期的噪音暴露等因素都可能导致感音神经性听力损失的人群激增。耳蜗在将声音转换为神经冲动,再向听觉中枢传递的过程中发挥着重要作用,位于耳蜗内数以千计的的感觉毛细胞将声音信息传输到它们所连接的螺旋神经元(spiral ganglion neurons,SGNs),而感觉毛细胞以及SGNs的损伤便是感音神经性听力损失的主要原因之一,目前对于重度至极重度的感音神经性聋(sensorineural hearing loss,SNHL)实现听觉重建的方法主要为助听器和人工耳蜗植入(cochlear implant,CI),这部分患者在进行CI后听力有一定恢复,但其程度在个体之间差异很大。这种多变性可归因于[2](但不限于)植入前耳聋持续时间,植入年龄,病因和设备使用经验等因素。鉴于使用人工耳蜗获得的治疗效果个体化差异较大,SGNs功能和数量的保存可能是进一步改善人工耳蜗植入治疗效果的重要因素[3],目前的研究开始关注生物治疗(例如干细胞治疗、分子治疗和基因治疗)以帮助改善患者对该装置的体验。而近年来,人们对利用骨髓来源的间充质干细胞进行细胞治疗和基因治疗进行了不断的探索,骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)由于高扩增潜能,遗传稳定,易于分离、培养和扩增,低免疫源性和免疫调节功能,在将来的临床应用中具有潜在优势。将BMSCs移植入内耳恰恰可以弥补哺乳动物内耳受损毛细胞以及SGNs的不可再生[4]。本文将从SGNs数量与人工耳蜗植入效果之间存在的关系、骨髓间充质干细胞移植实现SGNs再生或修复以及人工耳蜗植入联合干细胞移植的治疗难点几方面进行综述。
1 螺旋神经元数量与人工耳蜗植入效果的关系
SGNs是将由人工耳蜗植入电极产生的电刺激传递到中枢神经系统的一级神经元,言语测听能力为CI术后患者的听觉言语康复提供最直接最重要的评估指标,听力受损严重的患者内耳幸存SGNs越多在接受CI治疗后拥有更好的言语识别率及言语感知能力这一假设似乎是合理的,但却一直存在争议。Khan[5]等人,在一项对15名曾接受单侧CI的尸体颞骨研究中发现残留SGNs数量与CI后言语识别率之间并无显著相关性。Xu[6]等人在4位曾进行CI后的人体颞骨研究中得出了相似的结论。Fayad[7]等人,对14个曾接受CI治疗的颞骨进行了组织学形态分析,报告统计总SGNs计数与言语识别率之间呈显着负相关(r=-0.632,P≤0.047)。而另一部分人类颞骨研究则提出了相反的观点,Seyyedi[8]等在残留SGNs数量与CI后言语识别率之间的相关性研究中对SGNs计数方法进行了优化,将许多变量如耳聋的病因,年龄和认知能力都做了相应匹配分组,最终得出CI后言语识别率与SGNs计数之间存在非常强的相关性(r=0.934,P=0.006,N=6),证实了假设患者拥有更多幸存的SGNs数量在进行CI入后能获得更好的治疗效果。总之,临床病史与组织形态学数据相关联的发现有助于阐明SGNs存活数量对提高人工耳蜗植入效能的重要性,若在将来能进行大规模的队列研究也许能进一步阐明这一关系。若设想使用人工耳蜗获得良好的功能性与SGNs存活的数量确实存在正相关,这同时还取决于以下几个因素,包括(但不限于)SGNs的密度和完整性,植入电极与SGNs间的距离,以及长时间没有听觉输入后中央听觉通路连接退化的程度[9]。总而言之,CI前残留较多数量的SGNs尽管不太可能成为CI性能的唯一决定因素,但具有功能性连接的SGNs可能有助于改善植入效果[10]是不可否认的。
2 骨髓间充质干细胞植入实现SGNs再生或修复
由于重度极重度SNHL患者的内耳毛细胞以及SGNs都受到不同程度的损伤或丢失,作为人工耳蜗植入电极直接接触的一级听觉神经元,实现SGNs的修复或再生至关重要,干细胞移植为SNHL的治疗打开了新的大门,已经有研究报道利用不同类型干细胞移植帮助耳蜗功能的重建,包括在体外实验中诱导毛细胞[11,12,13]和SGNs[14,15]的再生。而作为成体干细胞类中的一员,骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)具有高扩增潜能,遗传稳定,易于分离培养,低免疫源性和免疫调节功能的特点,在将来的临床应用中具有潜在优势,目前BMSCs不仅作为组织工程的种子细胞广泛应用于修复各种组织,进行骨折、跟腱修复、软骨再生和化疗后骨修复的治疗[23],且近年来利用BMSCs移植入内耳的研究也取得了相应进展。接下来我们集中讨论使用BMSCs植入修复/再生内耳SGNs的相关研究。
2.1 体外实验
诱导BMSCs向听神经元的分化主要涉及四个阶段:神经诱导,扩增,神经祖细胞干细胞的维持及其向神经元和神经胶质的分化。Woodbury等[16]在体外成功地将成年大鼠的BMSCs诱导分化为类似神经元细胞,诱导后的细胞可以表达神经元中间丝蛋白(NF)、神经元特异性烯醇化酶(NSE)、巢蛋白(Nestin)和神经生长因子受体TrkA。Sanchez[20]等用含维甲酸和表皮细胞生长因子的培养基诱导BMSCs向神经元样细胞分化。Peng[17]等人研究表明MSCs具有在体外分化成听觉神经元样细胞的能力,作为一种有效的诱导剂,BMP4可能在转分化中起关键作用。
2.2 体内实验
目前将体外分离培养的干细胞植入内耳的方法可包括经中阶植入[18],经鼓阶植入[19,20],经蜗轴螺旋管植入[21]。以上几种手术入路都有各自的优势与缺点,但在移植过程中都多少会对耳蜗本身结构造成损伤。损伤较小的植入方法(如经鼓阶植入)也许能减小对耳蜗结构造成的影响,但存在植入后干细胞容易扩散[19],以上提及的几种植入方法总结如图1[9]示。
在以往的研究中,外源性干细胞经鼓阶植入后在内耳中至少能存活3-13周内[22,23]。秦贺[24]等人通过鼓阶将BMSCs移植到阿米卡星致聋的成年小鼠的内耳中,可观察到干细胞在鼓阶和前庭阶内贴壁或游离存活至少4周,并可迁移到耳蜗基底膜处且具有毛细胞特征。也有报道[25]证明神经营养因子在动物体内可以诱导听神经纤维向毛细胞受损伤的部位生长,这种促进神经再生的能力可以被用于降低植入电极和神经末梢之间的距离,通过减低阻抗和电流传递,加强耳蜗植入的效果。将BMSCs植入以替代或修复损伤的神经元已经用于很多动物研究,尽管其实现修复的机制尚未明确,可能与BMSCs的“归巢”效应有关[26],当组织存在损伤时BMSCs会迁移到损伤组织中,因其分泌的营养因子,包括胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、神经营养因子3(NT-3)等,这些神经营养因子在内耳神经细胞和感觉上皮细胞的发生、发育过程中起重要作用,能减轻各种有害因素如耳毒性药物、噪声等对毛细
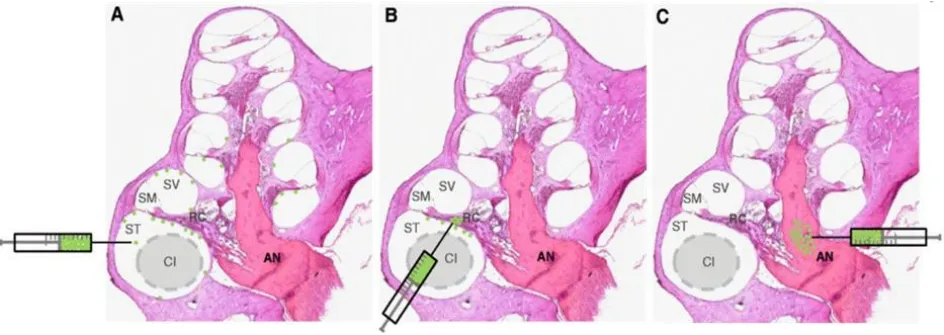
图1 [9]将干细胞移植入耳蜗。通过用HE染色的哺乳动物耳蜗横切组织切片,表明三种主要的干细胞移植途径(A-C)。绿色显示绿色荧光蛋白标记的干细胞。A:干细胞通过圆窗或通过耳蜗造口直接进入鼓阶(scala tympani,ST)。使用这种方法递送的干细胞导致细胞排列在鼓阶和前庭前庭(scala vestibuli,SV)的壁上,它们在蜗顶相互连接。 B:干细胞直接移植至Rosenthal’s管(Rosenthal’s channel,RC)C:将干细胞移植入听神经(auditory nerve,AN)或蜗轴。 中阶(scala media,SM),人工耳蜗电极(cochlear implant electrode array,CI)。绘图不成比例。Fig.1[9]Transplantation of stem cells into the cochlea.Transverse histological sections through the mammalian cochlea stained with hematoxylin and eosin(A-C),demonstrating three major stem cell transplantation routes.Stem cells are shown in green to illustrate the expression of green fluorescent protein in transplanted cells.A:Stem cells are delivered directly into the scala tympani(ST).Stem cells delivered using this approach results in cells lining the walls of the ST and scala vestibuli(SV),which are inter-connected at the apex of the cochlea.B:Stem cells delivered directly into Rosenthal’s canal(RC).C:Stem cells transplanted into the auditory nerve(AN) or modiolus.SM:scala media,CI:cochlear implant electrode array.Drawing not to scale.
胞的损害,同时维持SGNs的存活率。
3 人工耳蜗植入联合干细胞移植的治疗的难点
联合应用人工耳蜗及干细胞植入治疗难度很大,通过选择最合适的植入路径、植入靶区域和干细胞分化阶段,可以改善耳蜗中外源性植入干细胞的存活率,其次干细胞分化到何种阶段进行移植对其长期存活和整合到内源性听觉系统中也可能产生影响。目前对此有两种观点,一种观点认为将干细胞在体外培养至完全分化且具有听觉神经元细胞表型后再进行移植,这种方法的主要优点是能够操纵和控制干细胞的分化。Reyes[27]利用GDNF和BDNF与小鼠胚胎干细胞共同培养后可检测到NeuroD1的表达,然后将其移植入小鼠内耳,结果能在成熟听觉神经元中检测到表达谷氨酸神经递质。另一相反的观点则更倾向于将部分分化的干细胞植入内耳,因为体内生长因子和其他支持性分子可使未完全分化的干细胞生长并促进其整合到新的环境中。再者干细胞与人工耳蜗植入相结合是否可以从形态学和功能上实现整合以改善听力的关键难点还在于植入的干细胞分化形成的SGNs与耳蜗核神经元之间是否能产生功能性突触结构,实现完整的传导通路。Ryugo[28]等在先天性耳聋猫的有髓鞘听神经纤维轴索末端观察到异常的突触超微结构,主要表现为突触后密度增大,突触小泡减少,都导致了突触传递受阻,重要的是,这些超微结构的变化在人工耳蜗电刺激后是可逆的。最后还需考虑将如何实现干细胞与植入电极的相互结合。Richardson[29]使用一种聚合材料包裹神经营养因子并将其涂于人工耳蜗电极表面形成生物材料复合电极,植入到药物性致聋豚鼠耳内,以证明神经营养因子联合人工耳蜗植入对SGNs具有保护作用。Ceschi[30]证实了聚合物P(4HB)可以作为CI电极涂层以用于药物或细胞递送,由于其优异的涂层粘附稳定性和最佳降解能力,更有前景将这种生物材料复合电极应用到CI联合药物或细胞治疗中去。
4 小结与展望
BMSCs向内耳毛细胞或SGNs的定向诱导分化、干细胞内耳移植的方式的探索为BMSCs的体内移植奠定了基础[31],结合电刺激对SGNs影响的部分研究结果,为今后将二者联合治疗应用于感音神经性耳聋患者提供了可能。Roemer[32]首次报道将自体BMSCs与人工耳蜗相结合用于临床治疗,他们使用患者自体BMSCs与纤维蛋白胶混合并涂于植入电极表面治疗重度耳聋患者,虽然今后还需要大量队列研究资料来加以验证治疗效果,但这也是将生物材料复合电极用于临床治疗迈出的第一步。
近年来,人工耳蜗植入联合基因治疗为提高CI治疗效果提供了另一条新思路。Pinyon[33]提出,希望通过神经营养因子的释放来刺激螺旋神经节轴突来改善CI其性能,首先在体外建立基因工程细胞,使之过表达BDNF,并同电极一起植入致聋豚鼠内耳,并对人工耳蜗电极实现双极刺激,发现再生的螺旋神经节轴突能延伸至耳蜗植入电极附近,并且具有局部的异位分支。Konerding[34]等使用经基因工程改造后能分泌GDNF的人ARPE-19细胞系,将其放入胶囊装置与人工耳蜗电极经鼓阶一同植入到致聋猫的内耳,给予持续且有规律的电刺激6个月,结果表明营养因子GDNF与有效电刺激的联合应用对SGNs具有保护意义,并证实CI给予的电刺激能减少周围组织纤维化包裹,利于营养因子GDNF的递送达到联合治疗增强CI治疗效果的目的。并提出纤维组织生长可能限制了CI的治疗效果可能性,对于今后使用CI联合传递营养因子的治疗中有必要考虑到优化植入电极表面材料以减少纤维细胞的黏附。
总之,将干细胞移植与CI相结合用于临床治疗面临的挑战巨大,目前作为探讨最多的BMSCs,用于与CI的联合治疗主要基于其已被证实能分泌相应神经营养因子,神经营养因子的分泌对SGNs是有保护作用,但要在内耳环境中实现将BMSCs向SGNs的再生及修复还需要进一步的研究与探索。未来将干细胞移植与人工耳蜗植入联合治疗作为一个提高感音神经性耳聋治疗效果的新思路,基于耳蜗内毛细胞及SGNs的残留情况制定个性化治疗方案也需要考虑。
参考文献
1 Richardson RT,Atkinson PJ.Atoh1 Gene Therapy in the Cochlea for Hair Cell Regeneration[J].Expert opinion on Biological Therapy,2015,15(3):417-430.
2 Shepherd RK,Coco A,Epp SB.Neurotrophins and Electrical Stimulation for Protection and Repair of Spiral Ganglion Neurons Fol-lowing Sensorineural Hearing Loss[J].Hearing Research,2008,242(1-2):100-109.
3 Coleman B,de Silva MG,Shepherd RK.Concise Review:The Potential of Stem Cells for Auditory Neuron Generation and Replacement[J].Stem Cells,2007,25(11):2685-2694.
4 Li H,Roblin G,Liu H,et al.Generation of Hair Cells by Stepwise Differentiation of Embryonic Stem Cells[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(23):13495-13500.
5 Khan AM,Handzel O,Burgess BJ,et al.Is Word Recognition Correlated with the Number of Surviving Spiral Ganglion Cells and Electrode Insertion Depth in Human Subjects with Cochlear Implants?[J].The Laryngoscope,2005,115(4):672-677.
6 Xu HX,Kim GH,Snissarenko EP,et al.Multi-Channel Cochlear Implant Histopathology:Are Fewer Spiral Ganglion Cells Really Related to Better Clinical Performance?[J].Acta Oto-laryngologica,2012,132(5):482-490.
7 Fayad JN,Linthicum FH.Multichannel Cochlear Implants:Relation of Histopathology to Performance[J].The Laryngoscope,2006,116(8):1310-1320.
8 Seyyedi M,Viana LM,Nadol JB.Within-Subject Comparison of Word Recognition and Spiral Ganglion Cell Count in Bilateral Cochlear Implant Recipients[J].Otology&Neurotology,2014,35(8):1446-1450.
9 Gunewardene N,Dottori M,Nayagam BA.The Convergence of Cochlear Implantation with Induced Pluripotent Stem Cell Therapy[J].Stem Cell Reviews,2012,8(3):741-754.
10 Nayagam BA,Minter RL.A Comparison of in Vitro Treatments for Directing Stem Cells toward a Sensory Neural Fate[J].American Journal of Otolaryngology,2012,33(1):37-46.
11 Zhong C,Chen Z,Luo X,et al.Barhl1 Is Required for the Differentiation of Inner Ear Hair Cell-Like Cells from Mouse Embryonic Stem Cells[J].The International Journal of Biochemistry&Cell Biology,2018,96:79-89.
12 Mahmoudian-Sani MR,Hashemzadeh-Chaleshtori M,Jami MS,et al.In Vitro Differentiation of Human Bone Marrow Mesenchymal Stem Cells to Hair Cells Using Growth Factors[J].The International Tinnitus Journal,2017,21(2):179-184.
13 Ouji Y,Sakagami M,Omori H,et al.Efficient Induction of Inner Ear Hair Cell-Like Cells from Mouse ES Cells Using Combination of Math1 Transfection and Conditioned Medium from ST2 Stromal Cells[J].Stem Cell Research,2017,23:50-56.
14 王翠翠,陈建玲,杨仕明等.iPSCs定向分化的内耳毛细胞与支持细胞间相互作用的研究.中华耳科学杂志,2017,15(04):489-497.Wang CC,Chen JL,Yang SM,et al.Intercellular Junctions Between Hair Cell-like Cells and Supporting Cells by Derived From Human iPSCs.Chinese Journal of Otology,2017,15(04):489-497.
15 Chen W,Johnson SL,Marcotti W,et al.Human Fetal Auditory Stem Cells Can Be Expanded in Vitro and Differentiate into Functional Auditory Neurons and Hair Cell-Like Cells[J].Stem Cells(Dayton,Ohio),2009,27(5):1196-1204.
16 Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult Rat and Human Bone Marrow Stromal Cells Differentiate into Neurons[J].Journal of Neuroscience Research,2000,61(4):364-370.
17 Peng T,Zhu G,Dong Y,et al.Bmp4:A Possible Key Factor in Differentiation of Auditory Neuron-Like Cells from Bone-Derived Mesenchymal Stromal Cells[J].Clinical Laboratory,2015,61(9):1171-1178.
18 Hildebrand MS,Dahl HH,Hardman J,et al.Survival of Partially Differentiated Mouse Embryonic Stem Cells in the Scala Media of the Guinea Pig Cochlea[J].Journal of the Association for Research in Otolaryngology,2005,6(4):341-354.
19 李利,杨仕明,赵立东等.经鼓阶胚胎干细胞内耳导入的初步观察[J].中华耳科学杂志.2009,7(4):362-366.Li L,Yang SM,Zhao LD,et al.The Observation of Embryonic Stem Cells Transplantated into the Inner Ear Through Scala Tympani[J].chinese Journal of Otology,2009.7(4)362-366.
20 Taniguchi M,Yamamoto N,Nakagawa T,et al.Identification of Tympanic Border Cells as Slow-Cycling Cells in the Cochlea[J].PloS One,2012,7(10):e48544.
21 Coleman B,Hardman J,Coco A,et al.Fate of Embryonic Stem Cells Transplanted into the Deafened Mammalian Cochlea[J].Cell Transplantation,2006,15(5):369-380.
22 Sekiya T,Kojima K,Matsumoto M,et al.Cell Transplantation to the Auditory Nerve and Cochlear Duct[J].Experimental Neurology,2006,198(1):12-24.
23 Sekiya T,Holley MC,Kojima K,et al.Transplantation of Conditionally Immortal Auditory Neuroblasts to the Auditory Nerve[J].The European Journal of Neuroscience,2007,25(8):2307-2318.
24 秦贺.骨髓间充质干细胞治疗药物性聋的基础研究.[D]中国人民解放军军医进修学院,2010.Qin H.Basic Research on Treatment on Drug Deafness with Bone Marrow Mesenchymal Stem Cells.[D]Chinese PLA Hospital and Postcraduate Medical School,2010.
25 Wise AK,Hume CR,Flynn BO,et al.Effects of Localized Neurotrophin Gene Expression on Spiral Ganglion Neuron Resprouting in the Deafened Cochlea[J].Molecular Therapy:the Journal of the American Society of Gene Therapy,2010,18(6):1111-1122.
26 Kandathil CK,Stakhovskaya O,Leake PA.Effects of Brain-Derived Neurotrophic Factor(BDNF)on the Cochlear Nucleus in Cats Deafened as Neonates[J].Hearing Research,2016,342:134-143.
27 Reyes JH,O'Shea KS,Wys NL,et al.Glutamatergic Neuronal Differentiation of Mouse Embryonic Stem Cells after Transient Expression of Neurogenin 1 and Treatment with Bdnf and Gdnf:In Vitro and in Vivo Studies[J].The Journal of Neuroscience:the Official Journal of the Society for Neuroscience,2008,28(48):12622-12631.
28 Ryugo DK,Kretzmer EA,Niparko JK.Restoration of Auditory Nerve Synapses in Cats by Cochlear Implants[J].Science(New York,NY),2005,310(5753):1490-1492.
29 Richardson RT,Wise AK,Thompson BC,et al.Polypyrrole-Coated Electrodes for the Delivery of Charge and Neurotrophins to Cochlear Neurons[J].Biomaterials,2009,30(13):2614-2624.
30 Ceschi P,Bohl A,Sternberg K,et al.Biodegradable Polymeric Coatings on Cochlear Implant Surfaces and Their Influence on Spiral Ganglion Cell Survival[J].Journal of Biomedical Materials Research Part B,Applied Biomaterials,2014,102(6):1255-1267.
31 刘日渊,赵立东,杨仕明等.干细胞治疗耳聋研究进展.中华耳科学杂志,2016,14(01):6-9.Liu RY,Zhao LD,Yang SM,et al.Research and Development of Stem Cell Therapy for Deafness.Chinese Journal of Otology,2016,14(01):6-9.
32 Roemer A,Kohl U,Majdani O,et al.Biohybrid Cochlear Implants in Human Neurosensory Restoration[J].Stem Cell Research&Therapy,2016,7(1):148.
33 Pinyon JL,Tadros SF,Froud KE,et al.Close-Field Electroporation Gene Delivery Using the Cochlear Implant Electrode Array Enhances the Bionic Ear[J].Science Translational Medicine,2014,6(233):233-254.
34 Konerding WS,Janssen H,Hubka P,et al.Encapsulated Cell Device Approach for Combined Electrical Stimulation and Neurotrophic Treatment of the Deaf Cochlea[J].Hearing Research,2017,350:110-121.
