GJB2 235delC纯合突变致聋患者的听力表型分析
2018-05-16郭畅蒋刈黄莎莎康东洋张昕杨苏燕江远仕戴朴
郭畅蒋刈黄莎莎康东洋张昕杨苏燕江远仕戴朴
1汕头大学医学院(广东汕头515041)2福建医科大学省立临床医学系、福建省立医院耳鼻咽喉科(福州350001)3解放军总医院耳鼻咽喉/头颈外科,解放军耳鼻咽喉研究所聋病分子诊断中心(北京100853)4汕头大学第二附属医院耳鼻咽喉头颈外科(汕头515041)
耳聋是影响人类健康和生活质量的常见疾病之一,而遗传性耳聋是临床上常见的遗传病。据推测,60%的重度聋与遗传因素有关[1]。遗传性耳聋中,非综合征型耳聋约占70%[2],其中GJB2基因突变被认为是最常见的致病因素之一[3],目前已成为临床耳聋基因诊断的一线检测基因。在中国人群中,GJB2基因突变以235delC最为常见[4],其碱基的缺失导致基因框移突变,从而使翻译过程提前终止,产生无功能蛋白质,致缝隙连接缺损,耳蜗毛细胞间信息传递受阻或紊乱,亦使钾离子回流进入内淋巴液的循环受阻碍,浓度发生改变,引起Corti器的钾中毒,从而引起感音神经性聋[5-6]。本文总结分析了100例200耳GJB2 235delC纯合突变致聋患者的听力资料,着重研究其双耳听力表型对称性情况,以期更好地了解中国人群中GJB2 235delC基因突变所引起的听力表型多样性。
1 资料与方法
1.1 临床资料
研究对象为2007年至2014年在解放军总医院聋病分子诊断中心就诊的具有完整听力学资料的患者。纳入标准:经询问病史、体格检查、专科检查、详细听力学检查确诊为双耳感音神经性聋,且GJB2基因检测结果证实为GJB2 235delC纯合突变的患者,除外综合征型耳聋,及耳部相关器质性病变(如急性或慢性中耳炎、晚期梅尼埃病、听神经瘤、脑膜脑炎、外伤等因素)致聋的患者。本研究共纳入研究对象100例,其中男45例,女55例,年龄范围为3个月到37岁,其中0-4岁的42例,5-17岁的31例,18-37岁的27例。56例患者有明确的发病年龄,范围由出生到14岁,平均发病年龄2.4岁。
1.2 研究方法
1.2.1 基因组DNA的提取
采集患者的手臂外周静脉血样本,采用试剂盒法提取血液白细胞中的基因组DNA[7]。
1.2.2 GJB2基因编码区突变检测
采用戴朴报道的方法[8]进行引物设计、PCR扩增及直接测序。测序结果通过Gene Tool Lite 1.0软件与标准序列(GJB2:N M_004004)进行比对。
1.2.3 听力学检查
研究对象均在解放军总医院听力中心进行听力学检查,检查内容包括:(1)纯音测听或行为测听,用于年龄>4岁患者;(2)多频稳态诱发电位(Multiple-frequency Auditory steady-state evoked responses,ASSR)测试,用于年龄≤4岁患者。
患者听力损失程度判定:如患者年龄>4岁,根据纯音或行为测听图分别计算双耳0.25 kHz、0.5 kHz、1 kHz、2 kHz、4 kHz、8 kHz的气导纯音听阈平均值;如患者年龄≤4岁,根据ASSR图分别计算双耳0.5 kHz、1 kHz、2 kHz、4 kHz的气导纯音反应阈平均值。如果在某一频率未引出,按照该频率听力计最大输出值计算。根据计算所得的平均阈值,依据1996年我国制定的《职业工伤与职业病致残程度鉴定》中的标准,将听力分为:听力正常(≤25 dB HL)、轻度听力损失(25.1~40 dB HL)、中度听力损失(40.1~55 dB HL)、中重度听力损失(55.1~70 dB HL)、重度听力损失(70.1~90 dB HL)和极重度听力损失(>90 dB HL,包括全聋)。双侧耳聋的听力损失程度不同时以耳聋较轻侧的听力作为听力损失程度归类的依据。听力图分型:
本组患者的纯音测听图形和ASSR图形可以分为6种类型:下降型、平坦型、谷型、上升型、残余型(仅在某一或两个频率有残余听力)、其他类型(无法归类到上述各种类型者)。
为研究GJB2 235delC纯合突变致聋患者双耳听力表型是否存在不对称性情况,制定了双耳听力表型不对称性的判定标准如下:
1.双耳听力曲线图形不对称(简称“A型不对称”):双耳间听力曲线类型不同(如一耳为下降型,一耳为谷型),但听力曲线规则(图1-A)。此外,将一耳为残余型听力或全聋者,称为“Aa型不对称”。
2.规则性双耳听力损失程度不对称(简称“B型不对称”):双耳听力图分型相同,但一耳的听力比另一耳差,且至少有4个频率的听力损失程度差异≥10 dB,或2个频率的听力损失程度差异≥15 dB,或1个频率的听力损失程度差异≥25 dB(图1-B)。
3.不规则性双耳听阈不对称(简称“C型不对称”):一耳或双耳的听力曲线不规则,致使不同频率的听阈差异不规则。一侧耳的听力在某些频率比对侧差、在某些频率与对侧相同或比对侧好。在0.125 kHz-8 kHz范围内,双耳间听阈差值存在于2个频率≥15 dB,或3个频率≥10 dB(图1-C)。
2 结果
2.1 GJB2 235delC纯合突变致聋患者听力损失程度情况
100 例GJB2 235delC纯合突变致聋患者均有不同程度的听力损失(表1)。病人听力损失程度(如双耳听力损失程度不同时以较轻一侧为准)以极重度(51%,51/100)最为常见,其次为中重度(21%,21/100)和重度(20%,20/100),中度(7%,7/100)和轻度(1%,1/100)最少见。
2.2 GJB2 235delC纯合突变致聋患者听力曲线图构成情况
本研究观察的100例(200耳)GJB2 235delC纯合突变致聋患者中,听力曲线以下降型(37%,74/200)、平坦型(21%,42/200)最为常见,其次为残余型(15.5%,31/200)和谷型(11.5%,23/200),上升型(3.5%,7/200)最少见,另有其他类型(11.5%,23/200)。
双耳听力曲线图搭配见表2,有60%(60/100)的患者双耳听力曲线图为同一类型。

图1 -A
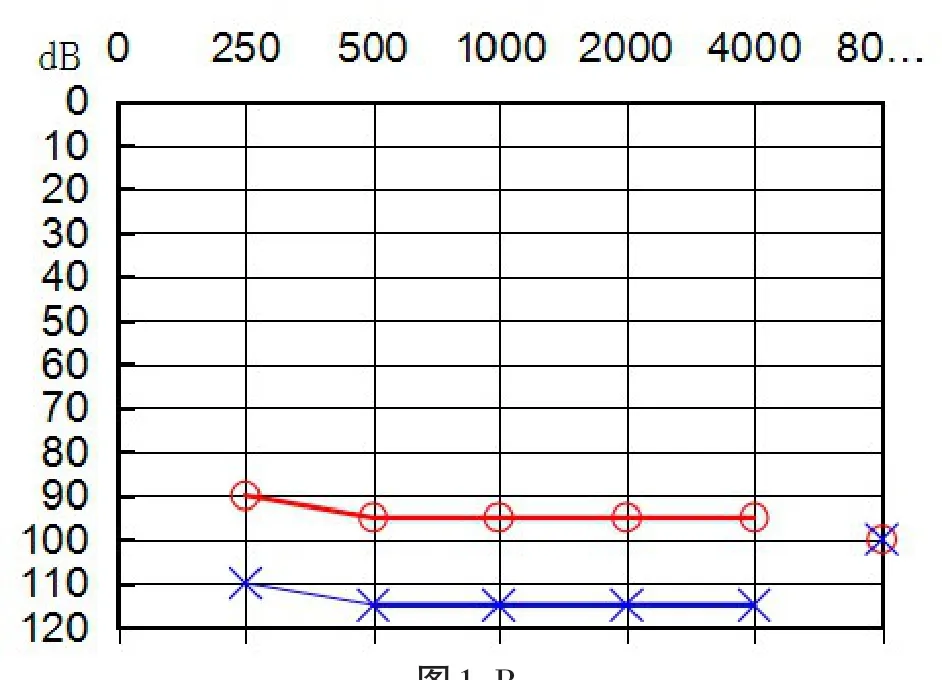
图1 -B

图1 -C
2.3 GJB2 235delC纯合突变致聋患者双侧听力表型不对称性检出情况
100 例耳聋患者中,听力曲线图图形和听力损失程度均对称的患者有39例,图形或听力损失程度不对称的患者有61例,不对称性检出率为61%(61/100)。在不对称的患者中,双耳听力曲线图形不对称(A型)有36例,其中一耳为残余型听力或全聋者(Aa型)有11例;规则性双耳听力损失程度不对称(B型)有18例;不规则性双耳听阈不对称(C型)有7例。
2.4 听力不对称患者听力损失程度及听力图分型的分布情况
61例听力不对称患者中,极重度听力损失为21例 (34.4%),重度听力损失为17例 (27.9%);39例听力对称患者中,极重度听力损失为30例(76.9%)。见表3。
61例听力不对称患者中,44耳(36.1%)为下降型,28耳(23.0%)为平坦型;39例听力对称患者中,30耳(38.5%)为下降型,24耳(30.8%)为残余型。见表4。

表1 听力损失程度Table 1 Degree of hearing loss
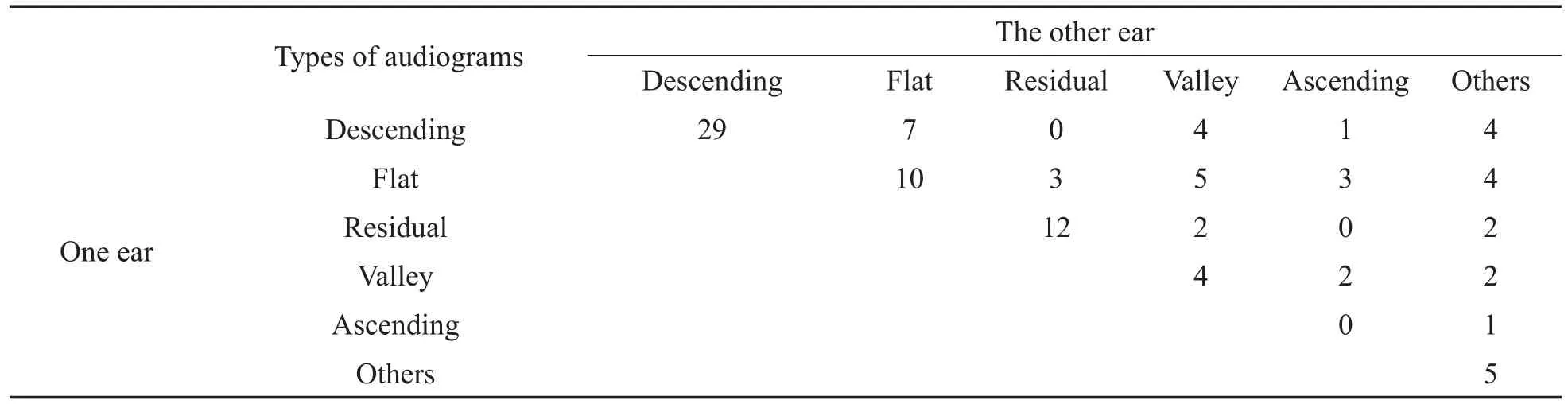
表2 双耳听力曲线图搭配情况Table 2 Types of audiograms in pairs

表3 听力不对称及对称患者听力损失程度情况Table 3 Degree of hearing loss in patients with asymmetric and symmetric hearing loss

表4 听力不对称及对称患者听力曲线图分布情况Table 4 Types of audiograms in patients with asymmetric and symmetric hearing loss
3 讨论
在遗传性非综合征型耳聋患者中,GJB2基因突变是主要的致病原因之一,且大多数突变位于GJB2基因的编码区[3]。在常染色体隐性遗传中,GJB2基因引起的耳聋可占约50%[9]。因此GJB2基因筛查成为聋病诊断和相关遗传咨询的主要部分。中国人群中,235delC纯合突变是GJB2基因最常见的突变类型[4]。
GJB2基因编码的Cx-26属于缝隙连接蛋白基因家族,与相邻细胞的缝隙连接蛋白组成一个完整的缝隙连接通道,这些通道在信息传导和物质交换中起重要作用[10],是完成电解质、第二信使和代谢产物的细胞间转换的重要通道。GJB2 235delC突变,其碱基的缺失导致基因框移突变,使翻译过程提前终止,产生无功能的缝隙连接蛋白[5],使缝隙连接通透性降低,影响通道的正常关闭,导致钾离子回流进入内淋巴液的循环受阻碍,浓度发生改变,引起Corti器的钾中毒,最终致感音神经性耳聋[6]。
GJB2基因突变常见于双耳感音神经性聋,单耳少见[11]。我们在对100例GJB2 235delC纯合突变致聋患者研究中发现,所有患者均为双耳感音神经性聋。听力损失程度以极重度(51%,51/100)最为常见,其次为中重度(21%,21/100)和重度(20%,20/100),中度(7%,7/100)和轻度(1%,1/100)最少见。Zhao等[12]通过大样本回顾性分析中国人群GJB2双等位基因突变致聋患者的听力表型,得出对于GJB2 235delC纯合突变,多数患者表现为重度或极重度听力损失,仅极少数患者表现为中度听力损失。而本研究发现,虽然听力损失程度为极重度的仍是最常见,但听力损失程度为轻度至中重度的也占有一定比例,其中中重度占21%,轻度和中度共占8%,这可能与样本量相对较小有关,但也提示了GJB2 235delC纯合突变患者听力表型的多样性。本研究分析发现,听力曲线图以下降型(37%)和平坦型(21%)最常见,其次为残余型(15.5%)和谷型(11.5%),最少的为上升型(3.5%),这与Liu等[13]认为GJB2听力曲线图类型主要有下降型、平坦型和残余型的特点相一致。
回顾以往文献,对双耳听力表型不对称尚无深入研究。本研究详细分析了100例GJB2 235delC纯合突变致聋患者的听力图,根据听力图形及听力损失情况,将双耳听力不对称分为3型。本研究显示,GJB2 235delC纯合突变致聋患者在听力曲线图类型、双耳听力损失程度上均有一定的不对称性,总计图形或听力损失程度不对称的患者有61例,不对称性检出率达61%(61/100)。其中,双耳听力曲线图形不对称(A型)有36例,其中一耳为残余型听力或全聋者(Aa型)有11例;规则性双耳听力损失程度不对称(B型)有18例;不规则性双耳听阈不对称(C型)有7例。提示GJB2 235delC突变致聋可导致双耳听力表型存在显著差异,呈现多元化现象,显示了遗传的高度异质性。
61例听力不对称患者中,极重度听力损失为21例 (34.4%),重度听力损失为17例 (27.9%);39例听力对称患者中,极重度听力损失为30例(76.9%)。提示GJB2 235delC纯合突变致聋者,无论其双耳听力是否对称,多数为重度或极重度聋。在听力不对称患者中,听力曲线图图形以下降型(36.1%)和平坦型(23.0%)最常见;听力对称患者中,以下降型(38.5%)和残余型(30.8%)最常见。这两组患者听力曲线分型构成的差异可能与听力对称组的听力损失程度较重有关。
GJB2 235delC纯合突变所表现出的双侧听力不对称性,简单来说,可能是遗传、表观遗传及环境等一种或多种因素在GJB2突变相关耳聋的发病过程中发挥一定的影响作用所导致的结果。具体机制现在尚不明确,需进一步收集GJB2 235delC纯合突变致聋患者的资料,并利用全外显子组测序、全基因组测序等多种技术手段,争取获得GJB2 235delC遗传异质性的相关信息,为遗传性耳聋的精确诊疗提供更多证据。
参考文献
1 Marazita ML,Ploughman LM,Rawlings B,et al.Genetic Epidemiological Studies of Early-onset Deafness in the U.S.School-age Population[J].American Journal of Medical Genetics,1993,46(5):486-491.
2 Bitner-Glindzicz M.Hereditary Deafness and Phenotyping in Humans.[J].British Medical Bulletin,2002,63(1):73-94.
3 Lucotte G,Diéterlen F.The 35delG Mutation in the Connexin 26 Gene(GJB2)Associated with Congenital Deafness:European Carrier Frequencies and Evidence for Its Origin in Ancient Greece[J].Genetic Testing,2005,9(1):20-25.
4 刘学忠,欧阳小梅,Denise Yan,等.中国人群遗传性耳聋研究进展[J].中华耳科学杂志,2006,4(2):81-89.
5 于飞,戴朴,韩东一.GJB2基因突变及语前遗传性非综合征性耳聋[J].国际耳鼻咽喉头颈外科杂志,2005,29(6):359-361.
6 Lefebvre PP,Van De Water TR.Connexins,Hearing and Deafness:Clinical Aspects of Mutations in the Connexin 26 Gene[J].Brain Research Reviews,2000,32(1):159-162.
7 代志瑶,孙宝春,黄莎莎,等.GJB2基因听力学表型与基因型关系分析[J].中华耳科学杂志,2014(1):34-36.
8 戴朴,于飞,康东洋,等.线粒体DNA1555位点和GJB2基因及SLC26A4基因的诊断方法及临床应用[J].中华耳鼻咽喉头颈外科杂志,2005,40(10):769-773.
9 Maeda Y,Fukushima K,Nishizaki K,et al.In Vitro and in Vivo Suppression of GJB2 Expression by RNA Interference.[J].Human Molecular Genetics,2005,14(12):1641-1650.
10 Todt I,Hennies HC,Basta D,et al.Vestibular Dysfunction of Patients with Mutations of Connexin 26[J].Neuroreport,2005,16(11):1179-1181.
11 Denoyelle F,Marlin S,Weil D,et al.Clinical Features of the Prevalent form of Childhood Deafness,DFNB1,Due to a Connexin-26 Gene Defect:Implications for Genetic Counselling[J].Lancet,1999,353(9161):1298-303.
12 Zhao FF,Ji YB,Wang DY,et al.Phenotype-Genotype Correlation in 295 Chinese Deaf Subjects with Biallelic Causative Mutations in the GJB2 Gene[J].Genetic Testing&Molecular Biomarkers,2011,15(9):619-625.
13 Liu XZ,Pandya A,Angeli S,et al.Audiological Features of GJB2(Connexin 26)Deafness[J].Ear&Hearing,2005,26(3):361.
