Notch信号通路在TGF-β1诱导胃癌细胞EMT过程中的作用
2018-05-15何燕霞张巍然李鹏云单婉婉
何燕霞,张巍然,李鹏云,单婉婉
(郑州大学第三附属医院,郑州450052)
Notch信号通路是一种广泛表达于多个物种、遗传进化上高度保守、反映相邻细胞间通信作用的信号通路,在肿瘤发生、发展和侵袭、转移过程中具有重要作用[1~3]。该信号通路的失调与多种恶性肿瘤的发生密切相关。上皮间质转化(EMT)是上皮细胞来源的恶性肿瘤细胞获得侵袭和迁移能力的重要生物学过程。目前用来验证EMT过程发生的分子标志物主要有上皮性标志基因E-cadherin及间质性标志基因Vimentin等。肿瘤微环境改变,如转化生长因子β1(TGF-β1)增多,可诱导多种类型上皮细胞发生EMT[4]。目前对Notch信号通路在TGF-β1诱导胃癌细胞EMT过程中的作用尚不完全清楚。2016年10月~2017年6月,我们观察了Notch信号通路在胃癌细胞EMT过程中的作用及其对胃癌细胞侵袭能力的影响。现分析结果并报告如下。
1 材料与方法
1.1 材料 胃癌细胞株SGC7901(以下称SGC7901细胞),购自北京鼎国昌盛生物技术有限责任公司。TGF-β1,美国PeproTech公司。Jagged1 siRNA及阴性对照siRNA,广州市锐博生物科技有限公司;引物序列,由上海生工生物工程股份有限公司设计合成。7500Fast荧光定量PCR仪,美国ABI公司;NanoDrop ND-2000超微量分光光度计,美国Thermo Fisher Scientific公司;DYY-6D型电泳仪,北京六一生物科技有限公司;Transwell小室,美国Corning公司;Matrigel基质胶,美国BD公司。TRIzol,北京康维世纪生物科技有限公司;LipofectamineTM2000转染试剂及用于qRT-PCR的M-MLV第一链合成系统,美国Invitrogen公司;Bestar®SybrGreen qPCR mastermix,德国DBI公司;兔抗人Jagged1单克隆抗体,美国Abcam公司;兔抗人E-cadherin单克隆抗体和兔抗人Vimentin单克隆抗体,武汉三鹰生物技术有限公司;兔抗人N1ICD单克隆抗体,沈阳万类生物科技有限公司;兔抗人GAPDH多克隆抗体,杭州贤至生物科技有限公司。
1.2 TGF-β1诱导SGC7901细胞EMT及其效果验证 ①细胞培养:将SGC7901细胞接种于含10% FBS的RPMI 1640完全培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。每2~3天更换1次新的培养基,待细胞生长融合至80%左右,胰酶消化,计数,取对数生长期细胞用于后续实验。②TGF-β1诱导SGC7901细胞EMT:取对数生长期SGC7901细胞,接种于含10% FBS RPMI 1640完全培养基的6孔板,每孔2×105个,随机将细胞分为诱导组和对照组,每组设3个复孔。待细胞生长融合至70%左右,弃去原培养基,诱导组每孔加入含10 ng/mL TGF-β1的无血清培养基,对照组加入不含TGF-β1的无血清培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养24 h。③EMT效果验证:a.采用荧光定量PCR法。收集各组培养24 h细胞,采用TRIzol法提取细胞总RNA,经NanoDrop ND-2000超微量分光光度计检测,A260/A280为1.8~2.0,说明提取的总RNA纯度合格,可用于后续实验。根据逆转录试剂盒说明将总RNA逆转录为cDNA,以cDNA为模板进行PCR扩增。引物序列:E-cadherin上游引物5′-CGGACGATGATGTGAACACC-3′,下游引物5′-TTGCTGTTGTGCTTAACCCC-3′;Vimentin上游引物5′-TTGACCTTGAACGCAAAGTG-3′,下游引物5′-ACATCGATTTGGACATGCTG-3′;β-actin上游引物5′-CCTGGCACCCAGCACAAT-3′,下游引物5′-GGGCCGGACTCGTCATAC-3′。PCR反应体系共20 μL:cDNA 1 μL,Bestar®SybrGreen qPCR mastermix 10 μL,上下游引物各0.5 μL,无RNA酶水8 μL;反应条件:95 ℃预变性2 min,95 ℃变性15 s、55 ℃退火34 s共40个循环,最后72 ℃延伸30 s。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。结果显示,诱导组和对照组E-cadherin mRNA相对表达量分别为0.339±0.035、1.000±0.040,Vimentin mRNA相对表达量分别为1.597±0.025、1.000±0.100,两组比较P均<0.05。b.采用Western blotting法。收集各组培养24 h细胞,采用普通RIPA裂解液提取细胞总蛋白,BCA法蛋白定量合格,加入上样缓冲液,100 ℃水浴使蛋白充分变性。取变性蛋白30 μg行SDS-PAGE(8%分离胶、5%浓缩胶),电泳结束采用湿转法将蛋白电泳产物转印至PVDF膜上,5%脱脂奶粉封闭1 h,分别加入E-cadherin(1∶1 000)、Vimentin(1∶750)、GAPDH(1∶1 000)一抗4 ℃孵育过夜。次日加入辣根过氧化物酶标记的山羊抗兔IgG抗体(1∶5 000)室温孵育1 h,采用凝胶成像系统拍照,Image J软件分析各蛋白电泳条带灰度值。以GAPDH为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。实验重复3次,取平均值。结果显示,诱导组和对照组E-cadherin蛋白相对表达量分别为0.30±0.04、1.02±0.30,Vimentin蛋白相对表达量分别为1.41±0.08、1.05±0.08,两组比较P均<0.05。结果表明,TGF-β1可诱导SGC7901细胞发生EMT,可用该方法进行后续试验。
1.3 siRNA转染及转染后再诱导 取对数生长期SGC7901细胞,接种于含10% FBS RPMI 1640完全培养基的6孔板,每孔2×105个,随机将细胞分为空白对照组、阴性对照组、siRNA组。当细胞生长融合至80%左右,siRNA组、阴性对照组分别加入Jagged1 siRNA及阴性对照siRNA转染,转染操作严格按照转染试剂LipofectamineTM2000及siRNA产品说明进行。空白对照组不予转染。转染48 h,将空白对照组、阴性对照组、siRNA组分别分为两份,一份直接用于mRNA和蛋白检测,另一份阴性对照组、siRNA组更换为含10 ng/mL TGF-β1的无血清培养基,空白对照组更换为不含TGF-β1的无血清培养基,均置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养24 h,然后进行相关mRNA和蛋白检测。
1.4 相关指标观察
1.4.1 E-cadherin、Vimentin、Jagged1 mRNA表达 采用荧光定量PCR法。收集空白对照组、阴性对照组、siRNA组转染48 h细胞及三组转染48 h再诱导24 h细胞,检测E-cadherin、Vimentin、Jagged1 mRNA表达。Jagged1引物序列:上游引物5′-TTCCAACGACACACCTGAAG-3′,下游引物5′-TCCCGTGAAG-CCTTTGTTAC-3′。其余步骤同1.2。
1.4.2 E-cadherin、Vimentin、Jagged1、N1ICD蛋白表达 采用Western blotting法。收集空白对照组、阴性对照组、siRNA组转染48 h细胞及三组转染48 h再诱导24 h细胞,检测E-cadherin、Vimentin、Jagged1、N1ICD 蛋白表达。Jagged1、N1ICD一抗稀释倍数分别为1∶1 000、1∶750,其余步骤同1.2。
1.4.3 细胞侵袭能力 采用Transwell侵袭法。将BD基质胶用无血清培养基按15∶1稀释后,取100 μL铺于Transwell上室并置于培养箱6 h待基质胶凝固。收集空白对照组、阴性对照组、siRNA组转染48 h细胞及三组转染48 h再诱导24 h细胞,用无血清培养基重悬,调整细胞密度至1×105个/mL。取细胞悬液200 μL加入Transwell小室,24孔板下室加入完全培养基750 μL,置于37 ℃、5% CO2、饱和湿度的培养箱培养48 h。取出Transwell小室,4%多聚甲醛固定20 min,PBS清洗2遍,苏木素染色10 min,PBS冲洗,小心擦除小室内未侵袭细胞,将小室置于倒置显微镜下观察。每个小室随机选取5个200倍视野,计数侵袭至小室下层的细胞数。实验重复3次,取平均值。
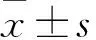
2 结果
2.1 各组siRNA转染48 h及转染48 h再诱导24 hJagged1、E-cadherin、Vimentin mRNA表达比较 见表1、2。

表1 各组siRNA转染48 h E-cadherin、Vimentin、 Jagged1 mRNA相对表达量比较
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
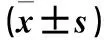
表2 各组siRNA转染48 h再诱导24 h E-cadherin、 Vimentin、Jagged1 mRNA相对表达量比较
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
2.2 各组siRNA转染48 h及转染48 h再诱导24 h E-cadherin、Vimentin、Jagged1、N1ICD蛋白表达比较 见表3、4。

表3 各组siRNA转染48 h E-cadherin、Vimentin、 Jagged1、N1ICD蛋白相对表达量比较
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。

表4 各组siRNA转染48 h再诱导24 h E-cadherin、Vimentin、 Jagged1、N1ICD蛋白相对表达量比较
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
2.3 各组细胞侵袭能力比较 空白对照组、阴性对照组、siRNA组转染48 h侵袭细胞数分别(55.00±2.65)、(54.67±4.50)、(22.33±2.52)个,siRNA组侵袭细胞数明显低于空白对照组和阴性对照组(P均<0.05),而空白对照组与阴性对照组比较P>0.05。空白对照组、阴性对照组、siRNA组转染48 h再诱导24 h侵袭细胞数分别(74.67±2.60)、(77.33±3.79)、(23.33±4.73)个,siRNA组侵袭细胞数明显低于空白对照组和阴性对照组(P均<0.05),而空白对照组与阴性对照组比较P>0.05。
3 讨论
目前,对胃癌发生的分子机制尚不完全清楚,但其强侵袭和转移能力是患者预后差的主要原因。在阐释肿瘤转移机制的理论模型中,EMT模型被广泛认可。EMT是上皮细胞向间质样细胞的可塑性转变,在此过程中,细胞间连接和细胞黏附能力被破坏,细胞极性丧失,失去上皮细胞表型获得间质细胞表型,并获得更强的侵袭和转移能力。EMT是肿瘤侵袭和迁移的先决条件[5]。研究证实,多种因子及信号通路(如Wnt、Hedgehog等)均可通过相应受体信号参与胃癌细胞的EMT过程。如Zhang等[6]研究报道,KLF8因子参与胃癌细胞的EMT过程,并能促进胃癌的侵袭和转移。有研究还发现,抑制胃癌细胞中Hedgehog通路的转录因子Gli1可逆转已发生的EMT,使得E-cadherin表达上调、Vimentin表达下调,同时使间质样细胞恢复上皮细胞形态[7]。
Notch基因最初在果蝇体内被发现,其功能丧失可导致果蝇翅膀边缘出现缺口,进而以此命名。Notch信号通路由三部分组成:Notch受体、Notch配体Jagged1和DNA结合序列CSL。在哺乳动物中,Notch受体有Notch1、Notch2、Notch3、Notch4四种异构体及Dll1、Dll-3、Dll-4、Jagged-1、Jagged-2五种配体。Notch受体和Jagged-1均是Ⅰ型单次跨膜蛋白[8]。Notch信号通路是十分保守的信号通路,可参与调节细胞增殖、分化和凋亡,对机体正常发育至关重要,是许多重要信号通路的主要组成部分和关键调控位点。Notch信号通路配体Jagged1与邻近上皮细胞膜上Notch1受体结合后,经过金属蛋白酶和γ分泌酶介导的一系列酶促分裂反应,致使Notch1胞内结构域(N1ICD)易位至细胞核;N1ICD进而与细胞核内转录因子形成复合物,从而促进靶基因Hes、Hey转录。有研究显示,Notch信号通路与肿瘤的发生、发展关系密切,具有促癌或抑癌作用[9,10]。多项研究表明,Notch受体及其配体在宫颈癌、肺癌、结肠癌等多种肿瘤组织中表达上调[11~13]。此外,Notch1及其配体Jagged1高表达与乳腺癌和肝内胆管癌患者预后不良有关[14,15]。在胰腺癌细胞系中,Notch1信号通路已被证实可促进EMT相关的侵袭和转移[16]。而在探索Notch信号通路参与EMT发生的机制时发现,Notch信号通路可能通过诱导转录因子Snail表达,促进TGF-β1诱导的EMT[11]。Leong等[18]在乳腺癌中研究发现,Slug可作为Notch信号通路调节EMT的下游靶点,通过抑制E-cadherin表达促进EMT发生,进而促进肿瘤细胞增殖并抑制其凋亡。
本研究通过TGF-β1诱导胃癌细胞发生EMT,结果发现,胃癌细胞E-cadherin表达下调、Vimentin表达上调,表明TGF-β1可诱导胃癌细胞发生EMT。为进一步证实Notch信号通路是否参与TGF-β1诱导的胃癌细胞EMT过程,采用RNAi技术通过Jagged1 siRNA沉默Notch信号通路,结果显示,siRNA组Jagged1、N1ICD表达下调,表明转染Jagged1 siRNA可抑制Notch信号通路;而siRNA转染后再诱导时,siRNA组E-cadherin表达上调、Vimentin表达下调,与仅予siRNA转染时E-cadherin、Vimentin表达变化一致,表明抑制Notch信号通路可阻断TGF-β1诱导的EMT,进一步证实TGF-β1可通过Notch信号通路诱导胃癌细胞发生EMT。本研究结果还发现,siRNA组转染48 h及转染48 h再诱导24 h侵袭细胞数明显低于空白对照组和阴性对照组,而阴性对照组与空白对照组比较差异无统计学意义。表明抑制Notch信号通路可降低胃癌细胞的侵袭能力。
综上所述,抑制Notch信号通路可阻断TGF-β1诱导的胃癌细胞EMT过程,并能降低胃癌细胞的侵袭能力。
参考文献:
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Brzozowa M, Mielanczyk L, Michalski M, et al. Role of Notch signaling pathway in gastric cancer pathogenesis[J]. Contemp Oncol (Pozn), 2013,17(1):1-5.
[3] Artavanis-Tsakonas S, Muskavitch MA. Notch: the past, the present, and the future[J]. Curr Top Dev Biol, 2010(92):1-29.
[4] Meng X, Ezzati P, Wilkins JA. Requirement of podocalyxin in TGF-beta induced epithelial mesenchymal transition[J]. PLoS One, 2011,6(4):e18715.
[5] Li JC, Yang XR, Sun HX, et al. Up-regulation of Kruppel-like factor 8 promotes tumor invasion and indicates poor prognosis for hepatocellular carcinoma[J]. Gastroenterology, 2010,139(6):2146-2157.
[6] Zhang H, Liu L, Wang Y, et al. KLF8 involves in TGF-beta-induced EMT and promotes invasion and migration in gastric cancer cells[J]. J Cancer Res Clin Oncol, 2013,139(6):1033-1042.
[7] 陈剑辉,吴晖,马晋平,等.抑制胃癌Hedgehog通路对转化生长因子β诱导的上皮间质化的影响[J].中华医学杂志,2013,93(26):2075-2078.
[8] Katoh M, Katoh M. Notch signaling in gastrointestinal tract (review)[J]. Int J Oncol, 2007,30(1):247-251.
[9] Koch U, Radtke F. Notch and cancer: a double-edged sword[J]. Cell Mol Life Sci, 2007,64(21):2746-2762.
[10] Thiery JP, Acloque H, Huang RY, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009,139(5):871-890.
[11] Matsuno Y, Coelho AL, Jarai G, et al. Notch signaling mediates TGF-β1-induced epithelial-mesenchymal transition through the induction of Snai1[J]. Int J Biochem Cell Biol, 2012,44(5):776-789.
[12] Siebel C, Lendahl U. Notch signaling in development, tissue homeostasis, and disease[J]. Physiol Rev, 2017,97(4):1235-1294.
[13] Kim HA, Koo BK, Cho JH, et al. Notch1 counteracts WNT/β-catenin signaling through chromatin modification in colorectal cancer[J]. J Clin Invest, 2012,122(9):3248-3259.
[14] Ma D, Dong X, Zang S, et al. Aberrant expression and clinical correlation of Notch signaling molecules in breast cancer of Chinese population[J]. Asia Pac J Clin Oncol, 2011,7(4):385-391.
[15] Zhou Q, Wang Y, Peng B, et al. The roles of Notch1 expression in the migration of intrahepatic cholangiocarcinoma[J]. BMC Cancer, 2013(13):244.
[16] Ni X, Long J, Cen P, et al. Pancreatic cancer tumour initiating cells: the molecular regulation and therapeutic values[J]. J Cell Mol Med, 2012,16(5):988-994.
[17] Leong KG, Niessen K, Kulic I, et al. Jagged1-mediated Notch activation induces epithelial-to-mesenchymal transition through Slug-induced repression of E-cadherin[J]. J Exp Med, 2007,204(12):2935-2948.
