过表达miR-18a-5p对结肠癌细胞增殖和凋亡的影响及其作用机制
2018-05-15玛依努尔达吾提胡尼其古丽阿巴克阿依努尔玉苏普祖丽胡玛尔阿卜杜合力力依米提热合曼
玛依努尔·达吾提,胡尼其古丽·阿巴克,阿依努尔·玉苏普,祖丽胡玛尔·阿卜杜合力力,依米提·热合曼
( 新疆大学生命科学与技术学院,乌鲁木齐830046)
微小RNA(miRNA)是一类存在于真核生物中的内源性非编码单链小分子RNA[1],长度为20~25个核苷酸。成熟的miRNA以碱基互补配对原则与靶基因mRNA的非编码区结合,从而引起靶基因mRNA降解或抑制靶基因mRNA翻译,进而在转录后对基因表达起负性调控作用,主要参与细胞增殖、分化、凋亡以及生长发育等一系列生物学过程。近年研究发现,miRNA还与肿瘤的发生、发展有关[2,3]。miR-18a-5p为miR-17-92家族成员之一,之前称为miR-18a,基于miRbase更名为miR-18a-5p[4]。研究发现,在食管鳞癌、胰腺癌、甲状腺癌等多种肿瘤细胞可见miR-18a-5p差异表达,可能具有癌基因或抑癌基因作用[5~7]。2016年12月~2017年8月,本研究通过脂质体瞬时转染技术构建过表达miR-18a-5p的结肠癌细胞,观察过表达miR-18a-5p对结肠癌细胞生物学行为的影响,并对其可能的靶基因进行初步研究。现分析结果并报告如下。
1 材料
结肠癌SW480细胞,购自中国科学院上海细胞生物学研究所。靶基因特异性引物,由上海生工生物工程股份有限公司设计合成。miRNA真核质粒PGV514,上海吉凯基因化学技术有限公司。miR-18a-5p特异性引物,由北京天根生化科技有限公司合成。NanoDrop ND-2000核酸定量测定仪、Multiskan FCM酶标仪,美国Thermo Fisher Scientific公司;荧光倒置显微镜,日本奥林巴斯株式会社;流式细胞仪,美国Beckman公司;荧光定量PCR仪,美国Bio-Rad公司。LipofectaminTM3000转染试剂,美国Invitrogen公司;Annexin V-PE/7-AAD细胞凋亡检测试剂盒,美国BD公司;miRcute miRNA cDNA试剂盒、miRcute miRNA荧光定量检测试剂盒,北京天根生化科技有限公司;QuantiNovaTMSYBR®Green PCR Kit,德国QIAGEN公司;First Strand cDNA Synthesis Kit,美国Thermo Fisher Scientific公司;质粒小体试剂盒,美国Omega-Bio-Tek公司。
2 方法与结果
2.1 质粒表达构建与质粒DNA抽提 从miRbase数据库中获得成熟miRNA序列,按照hsa-miR-18a-5p(miRbas编号:MIMAT0000072)的成熟miRNA序列:UAAGGUGCAUCUAGUGCAGAUAG,设计合成带有末端保护碱基、BamHⅠ、XhoⅠ酶切位点的hsa-miR-18a-5p引物。引物序列:hsa-miR-18a-5p-XhoⅠ-F:5′-GTCCGGACTCAGATCTCGAGCTTGAAT-CTACTGCAGTGAAGGCACTTG-3′,hsa-miR-18a-5p-BamHⅠ-R: 5′-TATCTAGATCCGGTGGATCCGTGCA-ACTATGCAAAACTAACAG-3′。扩增pre-miR-18a-5p序列,构建真核过表达hsa-miR-18a-5p-PGV514-EGFP质粒(miR-18a-5p-eGFP)、插入空载体(5′-TTCTCCGAACGTGTCACGT-3′)的阴性对照CMV-EGFP-MCS-SV40-Neomycin质粒(NC-eGFP)。将miR-18a-5p-eGFP、NC-eGFP接种于含50 mg/mL卡那霉素的LB培养基中,220 r/min、37 ℃恒温摇床12~16 h,按质粒小体试剂盒说明抽提真核miRNA质粒DNA,核酸定量测定仪检测质粒DNA浓度和纯度合格,可用于后续实验。
2.2 细胞转染及转染效率验证 将SW480细胞接种于含10% FBS、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。每2~3天更换1次新的培养基,当细胞融合约90%时,用含0.25% EDTA的胰蛋白酶消化,按1∶2比例进行传代。取传4代对数生长期细胞,以4×106个/孔接种于6孔板,随机将细胞分为miR-18a-5p-eGFP组、NC-eGFP组、空白对照组。当细胞融合约70%时,miR-18a-5p-eGFP组加入含200 ng/μL miR-18a-5p-eGFP的质粒DNA 25 μL、LipofectaminTM3000 Reagent 3.75 μL和Opti-MEM培养基250 μL;NC-eGFP组加入含200 ng/μL NC-eGFP的质粒DNA 25 μL、LipofectaminTM3000 Reagent 3.75 μL和Opti-MEM培养基250 μL;空白对照组仅加入Opti-MEM培养基250 μL。各组均置于37 ℃、5% CO2细胞培养箱孵育6 h,弃去旧培养基,更换为含10% FBS的RPMI 1640完全培养基,之后每隔24 h更换1次新的培养基。转染12、24、48 h,荧光倒置显微镜下空白对照组未见绿色荧光,miR-18a-5p-eGFP组、NC-eGFP组均可见绿色荧光,表明转染成功,且以转染48 h效率最高。故选择转染48 h细胞进行后续实验。收集miR-18a-5p-eGFP组、NC-eGFP组转染48 h细胞,采用TRIzol法提取细胞总RNA,经核酸定量测定仪检测,OD260/OD280为1.8~2.0;经1.5%琼脂糖凝胶电泳检测,可见28、18 S两条RNA条带。说明提取的总RNA纯度和完整性符合实验要求。取总RNA 1 μg,按照miRNA cDNA试剂盒说明逆转录为cDNA。以cDNA为模板,按照miRNA荧光定量检测试剂盒说明进行PCR扩增。miR-18a-5p和内参U6的引物序列由北京天根生化科技有限公司提供。PCR反应体系共20 μL:2×miRcute miRNA Premix 10 μL,上下游引物各0.4 μL,cDNA 2 μL,RNase-Free ddH2O 7.2 μL;反应条件:94 ℃ 2 min,94 ℃ 20 s、60 ℃ 34 s共40个循环,最后55 ℃ 30 s。以U6为内参,采用2-ΔΔCt法计算miR-18a-5p相对表达量。结果发现,miR-18a-5p-eGFP组、NC-eGFP组、空白对照组miR-18a-5p相对表达量分别为17.19±0.98、7.32±0.51、2.97±0.66;与NC-eGFP组、空白对照组比较,miR-18a-5p-eGFP组miR-18a-5p相对表达量明显升高(P均<0.05),而NC-eGFP组与空白对照组比较P>0.05。表明此转染方法能使miR-18a-5p过表达,可用于后续实验。
2.3 过表达miR-18a-5p对SW480细胞增殖抑制率影响的观察 采用MTT法。预实验发现,NC-eGFP组和空白对照组细胞增殖抑制率比较P>0.05[8],故本次检测仅设miR-18a-5p-eGFP组和NC-eGFP组。取传4代对数生长期SW480细胞,按2.2中方法进行转染。转染48 h,每孔加入MTT 20 μL,继续培养4 h,1 000 r/min离心10 min,吸弃上清液;每孔加入DMSO 150 μL,轻轻振荡10 min,使结晶充分溶解。酶联免疫分析仪450 nm波长处检测各孔的吸光度(A)值,计算细胞增殖抑制率(Ri)。Ri=[1-(实验孔A450值-空白对照孔A450值)/(阴性对照孔A450值-空白对照孔A450值)]×100%。结果发现,miR-18a-5p-eGFP组、NC-eGFP组细胞增殖抑制率分别为(66.02±0.51)%、(23.81±0.64)%,两组比较P<0.05。
2.4 过表达miR-18a-5p对SW480细胞凋亡率影响的观察 采用流式细胞术。取传4代对数生长期SW480细胞,按2.2中方法进行分组、转染。转染48 h,收集各组细胞,4 ℃、800 r/min离心5 min,弃上清液,PBS重悬。收集含2×105个细胞的细胞悬液,4 ℃、800 r/min离心5 min,弃上清液,室温下加入1×Binding Buffer 400 μL,然后加入Annexin V-PE 5 μL和7-AAD 5 μL轻轻混匀,避光反应15~20 min。采用流式细胞仪自动检测早期凋亡率和晚期凋亡率。结果见表1。
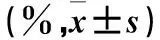
表1 三组转染48 h早期凋亡率和晚期凋亡率比较
注:与空白对照组比较,*P<0.05;与NC-eGFP组比较,#P<0.05。
2.5 miR-18a-5p过表达对SW480细胞靶基因表达影响的观察
2.5.1 miR-18a-5p靶基因预测与筛选 根据基因芯片结果,运用在线数据库miRanda、microCosm、Targetscan等预测miR-18a-5p的靶基因可参与MAPK、Wnt等信号通路,通过靶基因信号通路分析,筛选出miR-18a-5p的靶基因可能为DUSP5、FZD3、CCND2。
2.5.2 过表达miR-18a-5p对SW480细胞靶基因DUSP5、FZD3、CCND2表达的影响 采用qRT-PCR法。预实验发现,NC-eGFP组和空白对照组靶基因相对表达量比较P>0.05[8],故本次检测仅设miR-18a-5p-eGFP组和NC-eGFP组。取传4代对数生长期SW480细胞,按2.2中方法进行转染。转染48 h,收集两组细胞,采用TRIzol法提取细胞总RNA。经核酸定量测定仪和1.5%琼脂糖凝胶电泳鉴定,提取的总RNA纯度和完整性符合实验要求。取总RNA 1 μg,按照First Strand cDNA Synthesis Kit说明逆转录为cDNA。以cDNA为模板,按QuantiNovaTMSYBR®Green PCR Kit试剂盒说明进行PCR扩增。引物序列:DUSP5上游引物5′-AATGAGGTAGTTGGTTGAAGTAGC-3′,下游引物5′-AGAAGA-GGTGGAATGAGACAAGT-3′;FZD3上游引物5′-TGGCTCTCATAGTTGGCATTCC-3′,下游引物5′-ACCTGTCGGCTCTCATTCACT-3′;CCND2上游引物5′-TG-AGGAACAGAAGTGCGAAGA-3′, 下游引物5′-CTGAGGCTTGATGGAGTTGTC-3′; β-actin上游引物5′-CATCCGTAAAGACCTCTATGCCAAC-3′,下游引物5′-ATGGAGCCACCGATCCACADUSP-3′。PCR反应体系共20 μL:cDNA 1 μL,2×SYBR Green PCR Master Mix 10 μL,上下游引物各0.7 μL,RNase-Free ddH2O 7.6 μL;反应条件:95 ℃ 2 min,95 ℃ 5 s、60 ℃ 30 s共40个循环,最后55 ℃ 10 s。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。结果见表2。

表2 两组miR-18a-5p的靶基因DUSP5、FZD3、CCND2相对表达量比较
注:与NC-eGFP组比较,*P<0.05。
3 讨论
miRNA是一种转录后调节基因表达的非编码小分子RNA,可通过与靶mRNA结合,抑制靶mRNA翻译过程或诱导靶mRNA降解,继而参与基因表达调控。生理状态下,miRNA主要参与生物体生长、发育、衰老、死亡等生命过程调控[9]。miRNA异常表达会影响靶基因表达,导致多种疾病的发生[10]。据报道,超过50%的miRNA位于肿瘤相关的基因区域或脆性位点,其异常表达与肿瘤的发生、发展有关[11]。miR-18a-5p是miRNA中的一种,属于miR-17-92家族成员,定位于染色体13q31.3,与抑癌基因GUGC序列结合发挥作用[12]。miR-18a-5p可在多种肿瘤细胞中差异表达。如在非小细胞肺癌、胰腺癌等恶性肿瘤细胞中miR-18a-5p表达上调,并通过靶向调控干扰素因子2,促进肿瘤细胞增殖和侵袭[13,14];miR-18a-5p还可下调肿瘤抑制基因PTEN表达,促进肿瘤进展[15]。
本研究通过脂质体瞬时转染法成功在SW480细胞过表达miR-18a-5p。结果发现,miR-18a-5p-eGFP组细胞增殖抑制率明显高于NC-eGFP组,说明miR-18a-5p过表达能抑制SW480细胞增殖。miR-18a-5p-eGFP组早期凋亡率、晚期凋亡率均明显高于NC-eGFP组和空白对照组,提示过表达miR-18a-5p可促进SW480细胞凋亡。
miRNA的功能主要取决于其下游靶基因的生物学效应。本研究对miR-18a-5p的靶基因进行预测,筛选出其靶基因可能为DUSP5、FZD3、CCND2。DUSP5是蛋白酪氨酸磷酸酶家族成员,其功能是磷酸酪氨酸和磷酸丝氨酸去磷酸化而起作用的MAPK负性调节剂[16]。MAPK信号通路是细胞内广泛存在的信号通路之一。Bellou等[17]研究发现,DUSP5能去磷酸化p-VEGF从而抑制肿瘤血管生成;在前列腺癌中DUSP5呈低表达,其表达变化可引起前列腺癌细胞生物学行为改变[18]。FZD3基因是FZD家族成员之一,其编码的卷曲蛋白是Wnt蛋白的受体,可与Wnt配体结合启动Wnt信号通路[19,20]。Pourreyron等[20]研究发现,FZD3与Wnt5a结合激发Wnt信号通路与非黑色素瘤皮肤癌的侵袭有关。CCND2是D型细胞周期蛋白家族成员,主要参与细胞周期调控。CCND2可参与PI3K-AKT信号通路,调控细胞增殖、凋亡和迁移等过程[21,22]。本研究结果显示,miR-18a-5p-eGFP组DUSP5、FZD3相对表达量高于NC-eGFP组,CCND2相对表达量低于NC-eGFP组。说明过表达miR-18a-5p通过靶向调控其靶基因DUSP5、FZD3、CCND2表达,继而调控MAPK、Wnt和PI3K/AKT等信号通路,参与肿瘤的发生、发展。
综上所述,过表达miR-18a-5p能够抑制结肠癌SW480细胞增殖并促进其凋亡,其机制可能与调控靶基因DUSP5、FZD3、CCND2表达有关。
参考文献:
[1] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism and function[J]. Cell, 2004,116(2):281-297.
[2] Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006,6(11):857-866.
[3] 郝莉,孙国平.miRNA作为大肠癌生物标志物的研究进展[J].安徽医药,2013,17(2):183-185.
[4] Ichihara A, Wang Z, Jinnin M, et al. Upregulation of miR-18a-5p contributes to epidermal necrolysis in severe drug eruptions[J]. J Allergy Clin Immunol, 2014,133(4):1065-1074.
[5] Xu XL, Jiang YH, Feng JG, et al. MicroRNA-17, microRNA-18a, and microRNA-19a are prognostic indicators in esophageal squamous cell carcinoma[J]. Ann Thorac Surg, 2014,97(3):1037-1045.
[6] Sand M, Skrygan M, Sand D, et al. Expression of microRNAs in basal cell carcinoma[J]. Br J Dermatol, 2012,167(4):847-855.
[7] Takakura S, Mitsutake N, Nakashima M, et al. Oncogenic role of miR-17-92 cluster in anaplastic thyroid cancer cells[J]. Cancer Sci, 2008,99(6):1147-1154.
[8] 胡尼其古丽·阿巴克,玛依努尔·达吾提,依米提·热合曼,等.蜂胶黄酮PB3A作用下结肠癌细胞株中miRNA-198和miRNA-296-5p的表达及功能预测[J].中国病理生理杂志,2017,33(7):1317-1322.
[9] 宛彦,程琳,王晓云,等.血管紧张素Ⅱ对小鼠胰岛β细胞miR-375表达的影响[J].山东医药,2015,55(24):4-6.
[10] Dong WH, Li Q, Zhang XY, et al. Deep sequencing identifies deregulation of microRNAs involved with vincristine drug-resistance of colon cancer cells[J]. Int J Clin Exp Pathol, 2015,8(9):11524-11530.
[11] 邓晰月,吴运妙,吴运妙,等.姜黄素对HeLa细胞增殖、迁移及miRNA表达谱的影响[J].中国妇幼保健,2015,30(26):4554-4558.
[12] Hamilton MP, Rajapakshe K, Harting SM, et al. Identification of a pan-cancer oncogenic microRNA superfamily anchored by a central core seed motif[J]. Nat Commun, 2013(4):2730.
[13] Liang C, Zhang X, Wang HM, et al. MicroRNA-18a-5p functions as an oncogene by directly targeting IRF2 in lung cancer[J]. Cell Death Dis, 2017,8(5):e2764.
[14] Morimura R, Komatsu S, Ichikawa D, et al. Novel diagnostic value of circulating miR-18a in plasma of patients with pancreatic cancer[J]. Br J Cancer, 2011,105(11):1733-1740.
[15] Zhang W, He W, Gao J, et al. The long noncoding RNA CASC2 inhibits tumorigenesis through modulating the expression of PTEN by targeting miR-18a-5p in esophageal carcinoma[J]. Exp Cell Res, 2017,361(1):30-38.
[16] Moon SJ, Lim MA, Park JS, et al. Dual-specificity phospha-tase 5 attenuates autoimmune arthritis in mice via reciprocal regulation of the Th17/Treg cell balance and inhibition of osteoclastogenesis[J]. Arthritis Rheumatol, 2014,66(11):3083-3095.
[17] Bellou S, Hink MA, Bagli E, et al. VEGF autoregulates its proliferative and migratory ERK1/2 and p38 cascades by enhancing the expression of DUSP1 and DUSP5 phosphatases in endothelial cells[J]. Am J Physiol Cell Physiol, 2009,297(6):C1477-C141489.
[18] 汤永峰,蔡超,陈果,等.双特异性磷酸酶5基因在良性前列腺增生症与前列腺癌中的表达及临床意义[J].中华临床医师杂志:电子版,2015,9(16):3006-3009.
[19] 丁林灿,郑斐斐,佘林,等.FZD3基因在涎腺腺样囊性癌转移与复发中的作用[J].福建医科大学学报,2013,47(2):85-88.
[20] Pourreyron C, Reilly L, Proby C, et al. Wnt5a is strongly expressed at the leading edge in non-melanoma skin cancer, forming active gradients, while canonical wnt signalling is repressed[J]. PLoS One, 2012,7(2):e31827.
[21] Chalhoub N, Baker SJ. PTEN and the PI3-kinase pathway in cancer[J]. Annu Rev Pathol, 2009(4):127-150.
[22] 王军义,夏源,杨翠婵,等.体外培养耳蜗毛细胞氧化应激损伤的微小RNA调控网络分析[J].中华耳鼻咽喉头颈外科杂志,2016,51(10):751-755.
