靶向线粒体的mt-roGFP2荧光探针检测人肝癌HepG2细胞线粒体ROS水平动态变化
2018-05-15刘晓宁薄惠刘翠娥
刘晓宁,薄惠,刘翠娥
(黄河科技学院医学院,郑州450063)
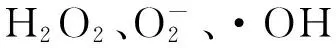
1 材料与方法
1.1 材料 人肝癌细胞系HepG2、人肾上皮细胞系293T(以下分别称HepG2细胞、293T细胞),购自美国ATCC公司。mt-roGFP2质粒载体pLPCX,由Tobias P. Dick教授惠赠。所有引物由本课题组自行设计,委托中国农业科学院合成。MitoTracker®红色线粒体荧光探针、Lipofectamine®2000,美国Invitrogen公司;青链霉素混合液(P/S)、H2O2、DTT,北京索莱宝科技有限公司;聚凝胺、嘌呤霉素,美国Sigma公司;琼脂糖凝胶DNA纯化回收试剂盒,北京天根生化科技有限公司;限制性内切酶EcoR Ⅰ-HF、Xba Ⅰ,美国NEB公司;PCR扩增试剂盒,北京全式金生物技术有限公司;无缝克隆试剂盒、pLenti-CMV-PGK-puro、pVSVg、pRev、pGag-Pol,上海和元生物技术股份有限公司;GAPDH一抗、GFP一抗,上海碧云天生物技术有限公司;山羊抗兔IgG二抗、山羊抗小鼠IgG二抗,美国Santa-Cruz公司。
1.2 pLenti-CMV-mt-roGFP2-PGK-puro慢病毒载体构建 以pLPCX为模板,设计正向引物5′-CGAGC-TCAAGCTGAATTCGCCACCATGGCCTCCACTCGTGT C-3′和反向引物5′-CGGTAGAATTATCTAGATTACT-TGTACAGCTCGTCC-3′,通过PCR扩增得到mt-roGFP2目的片段。用限制性内切酶EcoR Ⅰ-HF和Xba Ⅰ酶切载体pLenti-CMV-PGK-puro后,琼脂糖凝胶DNA纯化回收试剂盒回收,通过无缝克隆试剂盒将目的片段与回收载体连接,得到目的质粒pLenti-CMV-mt-roGFP2-PGK-puro。利用正向引物5′-CGCAAATGGGCGGTAGGCGTG-3′和反向引物5′-CAGCGGGGCTGCTAAAGCGCATGC-3′对阳性克隆测序鉴定。经鉴定,目的片段已成功构建入载体中。
1.3 mt-roGFP2慢病毒制备及其滴度测定 利用Lipofectamine®2000将慢病毒载体pLenti-CMV-mt-roGFP2-PGK-puro与包装质粒pVSVg、pRev、pGag-Pol共转染293T细胞,离心,留取上清液,即mt-roGFP2慢病毒颗粒。为确定制备的慢病毒颗粒感染细胞最佳浓度,将所得慢病毒悬液梯度稀释后再次感染293T细胞,再次检测慢病毒滴度。共检测3次,取平均值。慢病毒滴度(IU/mL)=(C×N×D×1 000)/V,其中C为每基因组整合的病毒拷贝数、N为感染时细胞数目、D为病毒载体稀释倍数、V为稀释病毒体积(μL)。
1.4 稳定细胞株筛选 将HepG2细胞接种于含10% FBS和P/S的DMEM培养液,置于37 ℃、5% CO2细胞培养箱中培养。当细胞进入对数生长期时,0.25%胰蛋白酶消化,待细胞收缩变圆,加入适量培养液,制成密度为4×104个/mL的细胞悬液。取细胞悬液接种于24孔板,每孔500 μL,培养至对数生长期,每孔加入上述制备的mt-roGFP2慢病毒颗粒0.99 μL,再加入适量聚凝胺,使其终浓度为5 μg/mL。感染12 h,弃去原培养液,每孔加入2 mL新鲜的培养液。感染72 h,加入适量嘌呤霉素,使其终浓度为2 μg/mL,继续培养。每隔2天更换1次含2 μg/mL嘌呤霉素的培养液。嘌呤霉素筛选约两周,奥林巴斯IX71荧光显微镜(激发光波长488 nm、发射光波长507 nm)观察mt-roGFP2表达,Western blotting法鉴定mt-roGFP2表达。将稳定表达mt-roGFP2的HepG2细胞命名为HepG2-mt-roGFP2。
1.5 mt-roGFP2荧光探针的亚细胞定位分析 选择HepG2-mt-roGFP2细胞,接种于含10% FBS和P/S的DMEM完全培养液,37 ℃、5% CO2细胞培养箱中培养。培养至对数生长期,取细胞2×104个接种于Nest-35 mm激光共聚焦培养皿,与MitoTracker线粒体荧光探针(终浓度为100 nmol/L)共温育20 min。使用奥林巴斯FV1000激光共聚焦显微镜(激发光波长579 nm,发射光波长599 nm)观察mt-roGFP2荧光探针的亚细胞定位。
1.6 线粒体ROS的荧光成像分析 取对数生长期HepG2-mt-roGFP2细胞接种于Nest-35 mm激光共聚焦培养皿,置于显微镜用活细胞培养系统中。采用尼康A1R激光扫描共聚焦显微镜拍摄同一细胞,在拍摄20 s时经0.5 mmol/L H2O2处理,200 s时加入1 mmol/L DTT。设置2个激发光波长(405、488 nm)和1个发射光波长(500~554 nm)。通过Image J软件分析荧光图片(http://rsb.info.nih.gov/ij/),通过设定阈值得到伪彩色比值(405 nm/488 nm)图片。
2 结果
2.1 mt-roGFP2慢病毒滴度 mt-roGFP2表达载体与pVSVg、pRev和pGag-Pol共转染293T细胞,包装产生的mt-roGFP2慢病毒平均滴度为4.04×108IU/mL。见表1。

表1 mt-roGFP2慢病毒滴度
2.2 稳定转染细胞HepG2-mt-roGFP2构建 mt-roGFP2慢病毒感染HepG2细胞,经嘌呤霉素筛选,得到稳定转染细胞HepG2-mt-roGFP2。经荧光显微镜观察和Western blotting法鉴定,roGFP2荧光蛋白探针稳定表达在HepG2细胞中,roGFP2荧光蛋白与MitoTracker探针共定位于HepG2细胞线粒体。
2.3 mt-roGFP2荧光探针响应HepG2细胞线粒体ROS水平变化 合并后的荧光图片(405 nm和488 nm)显示,HepG2细胞线粒体经历了还原状态到氧化状态再到还原状态的迅速转换。外源性氧化剂H2O2的加入导致HepG2细胞线粒体ROS水平明显升高,其荧光比值(405 nm/488 nm)从1.19上升到3.98,持续约135 s后加入还原剂DTT,可使其荧光比值下降至1.25。见图1。
3 讨论
作为细胞的“能量工厂”,线粒体利用氧气进行氧化磷酸化,产生三磷酸腺苷,为细胞及生命体提供能量;同时,伴随着呼吸链电子泄露,线粒体成为ROS产生并相互转化的主要位点。线粒体ROS在维持氧化还原平衡及参与细胞增殖、凋亡调控等方面发挥了至关重要的作用。相比调控细胞内整体ROS水平,调控线粒体ROS可能是一种更为有效的靶向治疗肿瘤策略[4]。最近研究报道,靶向线粒体的荧光探针AIE-mito-TPP可选择性聚集在肿瘤细胞线粒体内,从而降低线粒体膜电位,增加线粒体ROS水平,最终诱导肿瘤细胞凋亡[10]。因此,实时监测线粒体ROS水平对研究线粒体ROS在靶向治疗肿瘤中的作用机制至关重要。
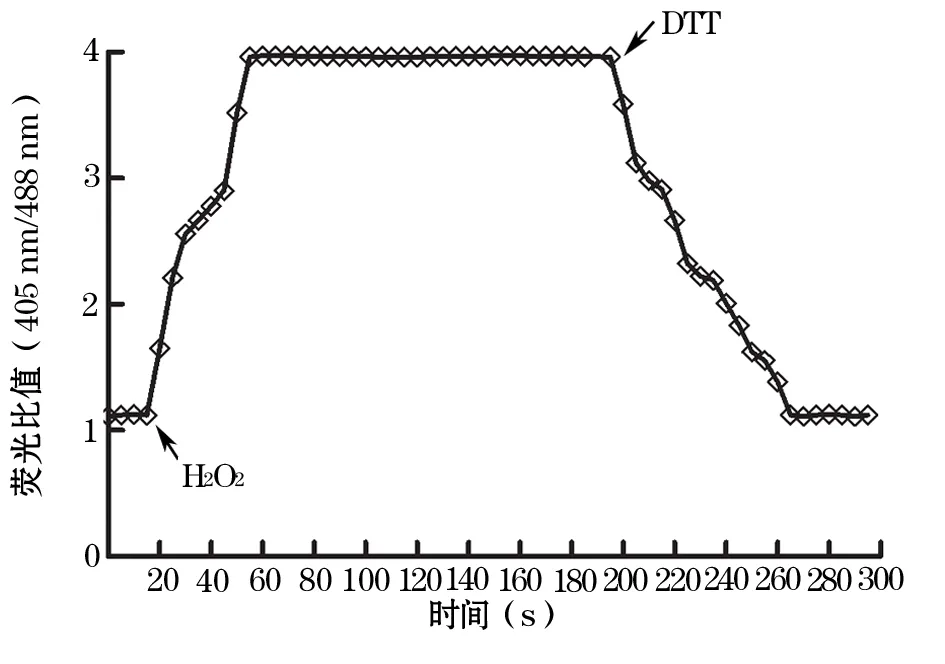
图1 mt-roGFP2探针响应H2O2和DTT引起的HepG2细胞线粒体ROS变化
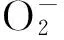
荧光成像技术具有时空分辨率高、生物相容性好、敏感性高等优势,已成为实时监测细胞及活体内生物活性分子的有力工具。基于遗传编码的roGFP荧光探针通过巯基-二硫键转换能实时成像显示细胞内氧化还原状态变化,其最大特征是细胞内氧化还原状态由两个激发光波长的荧光比值表示,能降低光漂白作用、探针浓度差异、激光光源稳定性、激发光路以及荧光在细胞内或细胞间分布不一致等造成的实验误差[17]。本研究应用的mt-roGFP荧光探针是roGFP探针系列的一种,通过添加线粒体定位序列,将roGFP蛋白在HepG2细胞线粒体内稳定表达,首次实现了对HepG2细胞线粒体ROS水平的实时动态、可逆性和特异性检测和成像,为研究抗癌药物所致线粒体ROS水平变化的研究提供了一个新方法。
综上所述,靶向线粒体的roGFP2荧光探针能够实时动态、可逆性地检测HepG2细胞线粒体ROS水平变化并实时成像。这将为阐明氧化还原状态变化在各种肿瘤细胞生命活动过程中的作用提供了一种新工具。
参考文献:
[1] Gao X, Schottker B. Reduction-oxidation pathways involved in cancer development: a systematic review of literature reviews[J]. Oncotarget, 2017,8(31):51888-51906.
[2] Tochhawng L, Deng S, Pervaiz S, et al. Redox regulation of cancer cell migration and invasion[J]. Mitochondrion, 2013,13(3):246-253.
[3] Parri M, Chiarugi P. Redox molecular machines involved in tumor progression[J]. Antioxid Redox Signal, 2013,19(15):1828-1845.
[4] Zhang L, Wang K, Lei Y, et al. Redox signaling: potential arbitrator of autophagy and apoptosis in therapeutic response[J]. Free Radic Biol Med, 2015(89):452-465.
[5] Lei K, Tan S, Du W, et al. 3B, a novel of photosensitizer, exhibited anti-tumor effects via mitochondrial apoptosis pathway in MCF-7 human breast carcinoma cells[J]. Tumour Biol, 2015,36(7):5597-5606.
[6] Ezerina D, Morgan B, Dick TP. Imaging dynamic redox processes with genetically encoded probes[J]. J Mol Cell Cardiol, 2014(73):43-49.
[7] Kolossov VL, Hanafin WP, Beaudoin JN, et al. Inhibition of glutathione synthesis distinctly alters mitochondrial and cytosolic redox poise[J]. Exp Biol Med (Maywood), 2014,239(4):394-403.
[8] Albrecht SC, Sobotta MC, Bausewein D, et al. Redesign of genetically encoded biosensors for monitoring mitochondrial redox status in a broad range of model eukaryotes[J]. J Biomol Screen, 2014,19(3):379-386.
[9] Galvan DL, Badal SS, Long J, et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy[J]. Kidney Int, 2017,92(5):1282-1287.
[10] Hu Q, Gao M, Feng G, et al. Mitochondria-targeted cancer therapy using a light-up probe with aggregation-induced-emission characteristics[J]. Angew Chem Int Ed Engl, 2014,53(51):14225-14229.
[11] Choi YJ, Choi YK, Lee KM, et al. SH003 induces apoptosis of DU145 prostate cancer cells by inhibiting ERK-involved pathway[J]. BMC Complement Altern Med, 2016,16(1):507.
[12] Choi YJ, Hur JM, Lim S, et al. Induction of apoptosis by deinoxanthin in human cancer cells[J]. Anticancer Res, 2014,34(4):1829-1835.
[13] Qiao J, Arthur JF, Gardiner EE, et al. Regulation of platelet activation and thrombus formation by reactive oxygen species[J]. Redox Biol, 2017(14):126-130.
[14] Su C, Shi A, Cao G, et al. Fenofibrate suppressed proliferation and migration of human neuroblastoma cells via oxidative stress dependent of TXNIP upregulation[J]. Biochem Biophys Res Commun, 2015,460(4):983-988.
[15] Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean[J]. Br J Pharmacol, 2004,142(2):231-255.
[16] Zielonka J, Kalyanaraman B. Hydroethidine- and MitoSOX-derived red fluorescence is not a reliable indicator of intracellular superoxide formation: another inconvenient truth[J]. Free Radic Biol Med, 2010,48(8):983-1001.
[17] 赵玉政,张卓,杨弋.监测细胞内氧化还原代谢状态的遗传编码荧光探针[J].中国科学:生命科学,2017,47(5):508-521.
