CHOP依赖内质网应激通路在雷公藤内酯醇诱导黑素瘤A375细胞凋亡中的作用机制
2018-05-15张亚美孙悦鑫陶玥包军
张亚美 孙悦鑫 陶玥 包军
210008南京大学医学院附属鼓楼医院皮肤性病科
恶性黑素瘤是恶性程度高、侵袭性强的皮肤肿瘤[1⁃2]。近年来新兴的靶向药物,如抗程序性细胞死亡1受体及其配体单抗、抗细胞毒性T淋巴细胞抗原4单抗、BRAF基因突变抑制剂等均显示了较好的疗效,但不能有效控制复发及转移,容易出现耐药性,且性价比低,因此寻求有效、经济的新型抗黑素瘤药物十分必要[3]。随着对细胞凋亡机制的阐明,以特异性诱导肿瘤细胞凋亡为目标的分子靶向药物逐渐引起关注。我们的前期[4]研究证实,雷公藤内酯醇(triptolide)可诱导人黑素瘤A375细胞凋亡。已有研究表明,雷公藤内酯醇可通过多条信号通路诱导多种肿瘤细胞凋亡,包括内质网通路,其中CHOP(C/EBP同源蛋白)表达显著增加是引起细胞凋亡的启动因素[5]。本研究旨在探讨CHOP依赖的内质网通路在雷公藤内酯醇诱导黑素瘤A375细胞凋亡中的作用。
材料与方法
一、材料
雷公藤内酯醇产自美国Selleck公司;人恶性黑素瘤A375细胞产自美国ATCC细胞库;高糖DMEM、胎牛血清、0.25%胰酶、双抗产自美国Gibco公司;CCK8试剂盒产自日本同仁化学研究所;细胞凋亡检测试剂盒产自美国BD公司;反转录试剂盒、实时荧光定量PCR试剂盒、葡萄糖调节蛋白78(GRP78)引物、蛋白激酶样内质网激酶(PERK)引物、CHOP引物产自日本Takara公司;GRP78抗体产自美国CST公司;PERK、p⁃PERK抗体、CHOP抗体、β肌动蛋白抗体产自英国Abcam公司。
二、方法
1.细胞培养及药物配制:将A375细胞接种于含有1%青链霉素和10%胎牛血清的高糖DMEM,置于37℃,5%CO2培养箱中培养,取对数生长期细胞用于各项实验。将雷公藤内酯醇溶解于二甲基亚砜(DMSO),使其终浓度分别为12.5、25、50、100、200 nmol/L;DMSO在培养基中的最大终浓度<0.1%,经预实验证实对细胞增殖无影响。
2.光镜观察细胞形态:取对数生长期A375细胞按每孔1×106接种于6孔板,预培养24 h,加入不同浓度雷公藤内酯醇(12.5、25、50、100、200 nmol/L),阴性对照组不加雷公藤内酯醇,继续培养24 h,在光镜下观察、拍照。
3.CCK8检测细胞增殖:取对数生长期A375细胞按每孔5×103接种于96孔板,预培养24 h,加入不同浓度雷公藤内酯醇(12.5、25、50、100、200 nmol/L),每一浓度设3个复孔;阴性对照组不加雷公藤内酯醇;空白组无细胞只加培养基。各组细胞分别孵育24、48、72 h后加入CCK8试剂孵育2 h;用酶标仪测定450 nm处各孔A值,细胞增殖抑制率=[1-(待测物各浓度A值-空白组平均A值)/(阴性对照组A值-空白组A值)]×100%。
4.流式细胞仪检测细胞凋亡:取对数生长期A375按1×106/孔接种于6孔板,预培养24 h;去上清液,加入不同浓度雷公藤内酯醇,阴性对照组不加雷公藤内酯醇,继续培养24 h;用不含乙二胺四乙酸(EDTA)的胰酶消化、收集细胞,移至流式管,PBS洗涤2次,1×结合缓冲液洗涤1次,100 μl 1×结合缓冲液重悬细胞,加入5 μl膜联蛋白V混匀后,加入5 μl碘化丙锭,混匀,室温下避光孵育15 min;每管加入400 μl 1×结合缓冲液,混匀,送流式细胞仪检测细胞凋亡。
5.透射电镜观察内质网形态:将A375细胞接种于6孔板,加入200 nmol/L雷公藤内酯醇处理24 h后,消化收集细胞,戊二醛和锇酸先后固定,脱水,包埋,固化,切片,采用醋酸铀-枸橼酸铅双染色法,透射电镜观察、拍照。
6.Western印迹检测 GRP78、p⁃PERK、PERK、CHOP蛋白水平:用不同浓度雷公藤内酯醇预处理A375细胞,同时设置阴性对照组(无雷公藤内酯醇),24 h后提取蛋白,测定蛋白浓度,电泳,PVDF转膜,脱脂奶粉室温封闭,加一抗(PERK和p⁃PERK抗体、CHOP抗体、β肌动蛋白抗体)4℃孵育过夜后,加二抗室温孵育1 h,化学发光法检测反应条带。应用BandScan 4.5图像分析软件分析,以β肌动蛋白灰度值为内参照,计算PERK、p⁃PERK、CHOP的相对表达水平。
另取部分A375细胞,用不同浓度雷公藤内酯醇分别预处理24、48、72 h,同时设置阴性对照组,按上述方法提取蛋白并作相应处理后,加一抗(GRP78抗体、β肌动蛋白抗体)4℃孵育过夜,加二抗室温孵育1 h,化学发光法检测反应条带。对图像进行分析,应用BandScan 4.5图像分析软件,以β肌动蛋白的表达灰度值为内参照,计算GRP78相对表达水平。
7.qPCR检测GRP78、PERK及CHOP mRNA水平:检索基因库,应用Primer5.0软件设计正、反向引物。GRP78:正向引物5′⁃ATTTCACAGCCAGCCTTC TTACT⁃3′,反向引物 5′⁃CATTTTGTCCTTCTCTGCTT CAG⁃3′;PERK:正向引物5′⁃CTCACAGGCAAAGGA AGGAG⁃3′,反向引物 5′⁃AACAACTCCAAAGCCAC CAC⁃3′;CHOP:正向引物5′⁃CACCTATATCTCATCC CCAGGA⁃3′,反向引物5′⁃ACCACTCTGTTTCCGTTT CCTA⁃3′;β肌动蛋白:正向引物5′⁃GTTTGAGACCT TCAACACCCC⁃3′,反向引物5′⁃GTGGCCATCTCTCT TGCTCGAAGTC⁃3′。用不同浓度雷公藤内酯醇作用A375细胞24 h,阴性对照组不用雷公藤内酯醇处理。提取RNA,使用反转录试剂盒合成cDNA,进行定量PCR反应,反应体系10 μl,分别为SYBR Mix 5 μl、正反向引物各 0.4 μl,ROX 0.2 μl、cDNA 1 μl、ddH2O 3 μl,反应条件为95℃预变性30 s,95℃变性5 s,60℃退火延伸30 s,共40个循环。反应结束后确认各个基因的阈值循环数(Ct),利用β肌动蛋白校正,ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)阴性对照组,计算GRP78、PERK、CHOP基因的相对表达水平(2⁃△△C)t。
三、统计分析
用SPSS 17.0进行统计学分析。数据均以±s表示。不同浓度组间观察指标的变化采用单因素方差分析,不同时间和浓度组间比较采用可重复的双因素方差分析,两两多重比较采用LSD⁃t检验,P<0.05为差异有统计学意义。
结 果
一、雷公藤内酯醇对A375形态的影响
光镜下观察,阴性对照组A375细胞形态无变化,贴壁生长,呈长梭形或多角形,细胞生长密集,细胞形态一致。雷公藤内酯醇作用24 h后,随着浓度增高,细胞数渐减少,形态变为细长梭形,胞质变少,细胞大小不一,形状不规则,出现较多突起,见图1。
二、雷公藤内酯醇对A375增殖抑制率的影响
见图2。双因素方差分析显示,雷公藤内酯醇对A375增殖的抑制呈浓度(F浓度=34.898,P<0.05)和时间(F时间=3.191,P<0.05)依赖性。两两多重比较显示,12.5、25、50、100、200 nmol/L雷公藤内酯醇作用24、48、72 h后,A375增殖抑制率均显著高于各自的阴性对照组(增殖抑制率为0),差异有统计学意义(均P<0.05)。相同作用浓度下,雷公藤内酯醇作用不同时间,除12.5 nmol/L浓度组作用24 h与48 h和100 nmol/L浓度组作用48 h和72 h外,各组与其他组比较,差异有统计学意义(均P<0.05)。雷公藤内酯醇处理A375细胞24、48、72 h时半数抑制浓度(IC50)分别为308、83、55 nmol/L。
三、雷公藤内酯醇对A375凋亡的影响
12.5、25、50、100、200 nmol/L雷公藤内酯醇作用24 h后,细胞凋亡率由阴性对照组的3.3%±0.4%分别上升至10.3%±0.1%、14.6%±0.8%、17.4%±0.7%、21.1% ±1.0%、29.5% ±1.1%(F=429.921,P<0.01,图3)。随药物浓度增加,细胞凋亡率逐渐增加,各浓度雷公藤内酯醇组与阴性对照组比较,差异有统计学意义(P<0.05),各浓度组间比较,差异亦有统计学意义(均P<0.05)。

图1 不同浓度雷公藤内酯醇作用A375细胞24 h后细胞形态变化(×100) 雷公藤内酯醇作用后,细胞数量减少,形态不规则,变为细长梭形并出现较多突起,大小不一,且随药物浓度的增加更加明显
四、雷公藤内酯醇对A375细胞内质网形态的影响
由图4可见,正常A375细胞腔内可见较多粗面内质网,排列整齐,呈扁平囊状,200 nmol/L雷公藤内酯醇作用A375细胞24 h后粗面内质网数量明显减少,出现肿胀、不规则扩张、断裂以及扭曲。
五、雷公藤内酯醇对A375细胞内质网应激相关蛋白表达的影响

图2 不同浓度雷公藤内酯醇作用24、48、72 h后A375细胞增殖抑制率

图3 不同浓度雷公藤内酯醇作用A375细胞24 h后凋亡率Q2和Q4区间代表细胞凋亡率
1.对p⁃PERK、PERK及CHOP蛋白表达的影响:12.5、25、50、100、200 nmol/L 雷公藤内酯醇作用A375细胞24 h后,p⁃PERK、PERK及CHOP蛋白表达水平随雷公藤内酯醇浓度升高均逐渐增加,且各雷公藤内酯醇组与阴性对照组比较,差异有统计学意义(均P<0.05)。除50、100、200 nmol/L组间差异无统计学意义外,其他浓度组间p⁃PERK、CHOP表达水平差异均有统计学意义(P<0.05);而PERK蛋白水平除在12.5 nmol/L与25 nmol/L组间差异无统计学意义外,其他组间两两比较差异均有统计学意义(P<0.05)。见图5、表1。

图4 雷公藤内酯醇作用A375细胞24 h后内质网形态变化4A:阴性对照组内质网排列整齐,呈扁平囊状结构;4B:200 nmol/L雷公藤内酯醇组粗面内质网数量明显减少,出现肿胀、不规则扩张、断裂以及扭曲
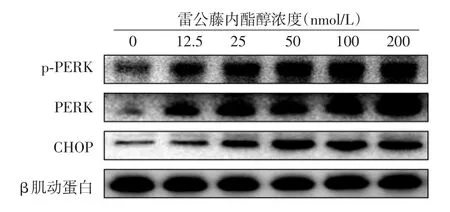
图5 不同浓度雷公藤内酯醇作用A375细胞24 h后p⁃PERK、PERK、CHOP蛋白表达水平 PERK:蛋白激酶样内质网激酶;p⁃PERK:磷酸化PERK;CHOP:C/EBP同源蛋白
表1 不同浓度雷公藤内酯醇作用A375细胞后p⁃PERK、PERK、CHOP、GRP78蛋白表达(±s,n=3)

表1 不同浓度雷公藤内酯醇作用A375细胞后p⁃PERK、PERK、CHOP、GRP78蛋白表达(±s,n=3)
注:a与对照组比较,差异有统计学意义(P<0.05);b与上一浓度组相比,差异有统计学意义(P<0.05)。PERK:蛋白激酶样内质网激酶;p⁃PERK:磷酸化PERK;CHOP:C/EBP同源蛋白;GRP78:葡萄糖调节蛋白78
雷公藤内酯醇浓度0(对照组)12.5 nmol/L 25.0 nmol/L 50.0 nmol/L 100.0 nmol/L 200.0 nmol/L F值P值p⁃PERK PERK CHOP GRP78 1 1 1 3.288±0.231a 5.910±0.216a b 6.977±0.154a b 7.287±0.194a 7.451±0.231a 574.254<0.05 3.894±0.114a 4.009±0.140a 4.621±0.384a b 5.974±0.224a b 7.925±0.378a b 257.788<0.05 1.451±0.093a 2.592±0.239a b 3.867±0.208a b 3.957±0.147a 4.037±0.127a 223.769<0.05 24 h 1 2.326±0.173a 3.197±0.202a b 3.292±0.252a 3.320±0.225a 3.588±0.153a 82.359<0.05 48 h 1 1.488±0.144a 1.577±0.083a 2.320±0.271a b 2.447±0.264a 2.395±0.196a 30.926<0.05 72 h 1 1.379±0.320 1.375±0.333 1.641±0.119a 2.130±0.121a 2.572±0.262a 19.039<0.05
2.对A375细胞GRP78蛋白表达的影响:见图6、表1。与阴性对照组比较,12.5、25、50、100、200 nmol/L雷公藤内酯醇作用细胞不同时间(24、48、72 h)后,GRP78蛋白水平均随药物浓度增加逐渐升高;随着药物作用时间延长,各浓度组(200 nmol/L组除外)细胞的GRP78蛋白水平均呈逐渐下降趋势。双因素方差分析显示,不同浓度及不同作用时间下,GRP78蛋白表达量不同(F时间=15.888,F浓度=10.540,均P< 0.05);两两多重比较显示,除12.5 nmol/L与25 nmol/L雷公藤内酯醇作用72 h外,各雷公藤内酯醇组与阴性对照组比较差异均有统计学意义(均P<0.05);各浓度组作用48、72 h分别与24 h比较,差异均有统计学意义(P<0.05)。

图6 不同浓度雷公藤内酯醇作用24、48、72 h对A375细胞GRP78蛋白表达的影响
表2 不同浓度雷公藤内酯醇作用24 h后A375细胞GRP78、PERK、CHOP mRNA相对表达量(±s)

表2 不同浓度雷公藤内酯醇作用24 h后A375细胞GRP78、PERK、CHOP mRNA相对表达量(±s)
注:n=3。与对照组(0 nmol/L)比较,aP <0.05;bP <0.01。GRP78:葡萄糖调节蛋白78;PERK:蛋白激酶样内质网激酶;CHOP:C/EBP同源蛋白
雷公藤内酯醇浓度0(对照组)12.5 nmol/L 25.0 nmol/L 50.0 nmol/L 100.0 nmol/L 200.0 nmol/L F值P值GRP78 1 1.337±0.188a 1.634±0.204b 2.380±0.190b 3.029±0.069b 3.219±0.162b 105.045<0.01 PERK 1 1.616±0.226 2.687±0.347b 3.893±0.783b 4.664±0.380b 6.065±0.370b 62.011<0.01 CHOP 1 1.954±0.486a 3.551±0.317b 4.652±0.284b 6.206±0.488b 7.693±0.671b 104.509<0.01
六、雷公藤内酯醇对A375细胞GRP78、PERK及CHOP mRNA表达的影响
不同浓度雷公藤内酯醇作用A375细胞24 h后,GRP78、PERK及CHOP mRNA的表达水平均随雷公藤内酯醇浓度升高而增加(表2)。其中,各雷公藤内酯醇组细胞GRP78及CHOP mRNA水平与阴性对照组相比差异均有统计学意义(P<0.05);而PERK mRNA表达量除12.5 nmol/L浓度外,各浓度雷公藤内酯醇组与阴性对照组比较,差异均有统计学意义(均P<0.05)。GRP78除100 nmol/L与200 nmol/L浓度组间没有差异外,其余各雷公藤内酯醇组间两两比较差异均有统计学意义(P<0.05);PERK及CHOP在各浓度组间两两比较差异亦均有统计学意义(P< 0.05)。
讨 论
雷公藤内酯醇是从中药雷公藤中分离的有效活性成分,对多种肿瘤细胞具有抑制作用[4,6⁃7]。我们曾报道雷公藤内酯醇能够诱导人黑素瘤A375细胞凋亡[4],但尚无雷公藤内酯醇通过内质网应激诱导黑素瘤细胞凋亡相关机制的报道。本研究显示,雷公藤内酯醇作用于A375细胞24 h后,细胞数量减少,形态不规则,且随药物浓度的增加更加明显。CCK8检测显示,雷公藤内酯醇对A375细胞的增殖抑制作用具有浓度依赖性和时间依赖性。流式细胞仪检测发现,随雷公藤内酯醇浓度的增加,A375细胞凋亡率逐渐上升,提示雷公藤内酯醇能够促进A375细胞凋亡。进一步利用透射电镜观察发现,雷公藤内酯醇作用后,A375细胞中内质网形态发生损伤性变化。
未折叠蛋白反应(unfolded protein response,UPR)作为内质网应激(endoplasmic reticulum stress,ERS)最重要的信号通路,是由GRP78和3个跨膜感受蛋白介导的保护性应激反应,3个蛋白分别是PERK、激活转录因子6和肌醇酶1。该反应具有复杂的调节机制,适度的ERS有利于细胞在各种内外界刺激下维持自身稳定,主要表现为蛋白合成减少或增加错误折叠蛋白的降解[8]。但持续或过强的ERS则会引起细胞的一系列病理变化甚至凋亡[8⁃9],激活下游的凋亡信号分子,触发促凋亡信号[10]。其诱导细胞凋亡主要有C/EBP同源蛋白(CHOP)、c⁃Jun氨基末端激酶(JNK)和半胱氨酸天冬氨酸酶12(caspase⁃12)三条信号通路。因此,ERS既是细胞抵抗应激的保护性措施,也是应激损伤细胞的重要途径。该应激过程主要涉及GPR78和CHOP两种类型的效应分子,二者通常被当做检测内质网应激的标志[5]。其中GRP78是ERS激活的特征性标志物,主要促进细胞生存;而CHOP被认为是ERS相关性凋亡标志因子,介导细胞凋亡[11],综合二者可以反映细胞ERS相关性凋亡。本研究显示,PERK及pPERK蛋白相对表达量和PERK mRNA水平均随药物浓度升高增加,证实雷公藤内酯醇作用下PERK内质网应激信号通路被激活,参与诱导凋亡发生。雷公藤内酯醇作用下A375细胞GRP78蛋白表达量和mRNA水平呈现短暂表达上升趋势,随药物浓度的增加而增加,提示药物作用下细胞产生保护性的内质网应激性反应。但是,随着雷公藤内酯醇作用时间的延长,GRP78蛋白表达量逐渐下降,原因可能为持续发生的内质网应激启动了细胞的反应性凋亡,GRP78作为内质网应激感受蛋白的抑制剂及抗凋亡分子,其表达下调有利于激活ERS下游3条信号通路,进而激活凋亡通路,诱导凋亡的发生。关于雷公藤内酯醇作用于A375细胞后引起的内质网通路中是否有其他如Caspase12、JNK介导的细胞凋亡的参与,以及起主要作用的信号通路等,尚待进一步研究。
参考文献
[1]李小静,李志锋,李显平,等.丹参酮ⅡA体外促进黑素瘤A375细胞自噬及信号通路的实验研究[J].中华皮肤科杂志,2017,50(1):29⁃32.doi:10.3760/cma.j.issn.0412⁃4030.2017.01.008.
[2]Aung PP,Nagarajan P,Prieto VG.Regression in primary cuta⁃neous melanoma:etiopathogenesis and clinical significance[J/OL].Lab Invest,2017.doi:10.1038/labinvest.2017.8.[published online ahead of print Feb 27,2017].
[3]Maverakis E,Cornelius LA,Bowen GM,et al.Metastatic mela⁃noma ⁃a review of current and future treatment options[J].Acta Derm Venereol,2015,95(5):516⁃524.doi:10.2340/00015555⁃2035.
[4]Tao Y,Zhang ML,Ma PC,et al.Triptolide inhibits proliferation and induces apoptosis of human melanoma A375 cells[J].Asian Pac J Cancer Prev,2012,13(4):1611⁃1615.
[5]Zheng YZ,Cao ZG,Hu X,et al.The endoplasmic reticulum stress markers GRP78 and CHOP predict disease⁃free survival and responsiveness to chemotherapy in breast cancer[J].Breast Cancer Res Treat,2014,145(2):349⁃358.doi:10.1007/s10549⁃014⁃2967⁃x.
[6]陶玥,马鹏程,孙建方,等.雷公藤内酯醇对人黑素瘤M14细胞系增殖与凋亡的影响[J].中华皮肤科杂志,2012,45(9):641⁃643.doi:10.3760/cma.j.issn.0412⁃4030.2012.09.010.
[7]Hung FM,Chen YL,Huang AC,et al.Triptolide induces S phase arrest via the inhibition of cyclin E and CDC25A and triggers apoptosis via caspase⁃and mitochondrial⁃dependent signaling pathways in A375.S2 human melanoma cells[J].Oncology Reports,2013,29(3):1053⁃1060.doi:10.3892/or.2013.2230.
[8]Moriya S,Che XF,Komatsu S,et al.Macrolide antibiotics block autophagy flux and sensitize to bortezomib via endoplasmic reticulum stress⁃mediated CHOP induction in myeloma cells[J].Int J Oncol,2013,42(5):1541⁃1550.doi:10.3892/ijo.2013.1870.
[9]Zhang Q,Liu J,Chen S,et al.Caspase⁃12 is involved in stretch⁃induced apoptosis mediated endoplasmic reticulum stress[J].Apoptosis,2016,21(4):432⁃442.doi:10.1007/s10495⁃016⁃1217⁃6.
[10]Sanchez⁃Lopez E,Zimmerman T,Gomez dPT,et al.Choline kinase inhibition induces exacerbated endoplasmic reticulum stress and triggers apoptosis via CHOP in cancer cells[J].Cell Death Dis,2013,4:e933.doi:10.1038/cddis.2013.453.
[11]Li H,Zhu X,Fang F,et al.Down⁃regulation of GRP78 enhances apoptosis via CHOP pathway in retinal ischemia⁃reperfusion injury[J].Neurosci Lett,2014,575:68 ⁃73.doi:10.1016/j.neulet.2014.05.042.
