低氧对肥胖小鼠棕色脂肪组织相关基因表达的影响及其机制*
2018-05-15龚丽景付鹏宇朱鑫
龚丽景,付鹏宇,朱鑫,汪 蕾,胡 扬△
(1.北京体育大学中国运动与健康研究院,2.运动人体科学学院,北京100084)
自从利用氟脱氧葡萄糖-正电子发射体层摄影(fluorodeoxyglucose-position emission tomography,FDGPET)技术探查到成人体内也存在活性棕色脂肪(brown adipose tissue,BAT)[1]后,学者试图寻找活化BAT的方法,发挥其产热、促进能量代谢和消耗脂肪的作用,以达到减脂控重的目的。目前认为BAT有两种来源:一是与白色脂肪(white adipose tissue,WAT)细胞同源,二是和肌肉细胞同源[2]。而低氧暴露作为影响肌肉功能的敏感因素和调控能量代谢的有效手段[3],其对BAT的影响还鲜有研究,而mRNA表达谱芯片作为一种快速、高敏、高效的生物信息学手段,可将不同生理病理状态(正常与肥胖)下或对照和处理(低氧和常氧)的细胞或组织的mRNA进行定性和定量比较,从而为基因层面全面研究低氧对肥胖机体BAT的影响提供思路。因此,本实验拟利用mRNA表达谱芯片分析4周的低氧暴露对肥胖小鼠BAT的差异表达基因和通路,以探讨低氧如何通过棕色脂肪组织产热过程达到减肥的可能机制。
1 材料与方法
1.1 实验动物及分组
离乳雄性C57BL/6J小鼠30只(北京维通利华实验动物技术有限公司,许可证号:SCXK-(京)2015-0004),初始体重为(8.2±0.1)g,随机分为普通对照组(N,n=8),喂以普通维持饲料;高脂组(HD,n=22)喂以高脂饲料(D12109C:Rodent Diet with 40 kcal%Fat,Research Diet公司)。饲喂8周建立肥胖模型后(以HD组大于N组平均体重的20%作为肥胖模型建立成功判断标准),随机分为:肥胖对照组(OB,n=8)和肥胖低氧组(H,n=8),H组的低氧方案为 8 h/d、6天/周,氧浓度为 11.2%(相对于海拔4 500 m),共4周的低氧暴露[通过制氮机(北京创文气体有限公司)、冻干机(杭州超滤)和空气压缩机(美国英格索兰)共同作用将空气中的氮气通入动物饲养室内达到氧浓度]。每周记录各组小鼠体重和摄食量。饲养与低氧暴露均在北京体育大学动物实验室[许可证号:SYXK(京)2011-0034]内进行。本实验经过北京体育大学运动科学伦理审查委员会的批准(批准号:2015040)。
1.2 取材
4周低氧暴露结束,禁食12 h,小鼠腹腔注射2%戊巴比妥钠溶液,心脏取血后收集血清,肩胛处取BAT置于RNA store样本保存液(DP408-02,北京天根生化科技有限公司)中,均-20℃保存。
1.3 血液生化指标检测
日立7020全自动生化分析仪测试血液中甘油三酯(triglyceride,TG)、总胆固醇(cholesterol,CHO)和血糖(glucose,GLU)水平。
1.4 总RNA的提取和荧光标记
采用 mirVana miRNA Isolation Kit试剂盒提取BAT中的总RNA,并用NucleoSpin®RNA clean-up试剂盒(MACHEREY-NAGEL,Germany)纯化,分光光度计定量,甲醛变性胶电泳质检。RNA的纯度(A260/280≥1.90),总量(≥10μg)和完整性均达要求后进行后续实验。RNA逆转录为 cDNA,以 Random Primer为引物进行KLENOW酶标记,标记产物用PCR NucleoSpinExtract II Kit(MN)纯化并抽干。DNA标记后溶于杂交液中(2×GExHyb Buffer(HI-RPM),25%甲酰胺)45℃杂交过夜。杂交结束后,先在42℃左右含0.2%SDS,2×SSC的液体中洗 5 min,而后在0.2×SSC中室温洗5 min。玻片甩干后即可用于扫描。
1.5 基因芯片的扫描和数据分析
使用Agilent G2565CA Microarray Scanner进行扫描芯片(Mouse(V2)Gene Expression Microarray,8 x 60 K,Agilent),得到杂交图片。Feature Extraction软件分析芯片图像并将其转化为数字信号。所得数据输入GeneSpring GX软件中,percentile shift方法对信号值进行归一化处理。以 Absolute Fold change[FC(abs)]≥1.5,同时Flag标记为Detected的标准进行差异基因筛选。Cluster3.0软件进行聚类分析。对所筛选的差异基因用 KOBAS2.0(KEGG Orthology Based Annotation System)软件进行基因功能注释(Gene Ontology,GO)和信号通路富集度统计分析。每组随机取3个BAT样本用于芯片测试;1.4和1.5过程中的操作均完成于北京博奥晶典生物有限公司。
1.6 实时荧光 qPCR(Real time-qPCR,RT-qPCR)验证芯片准确性
按MiniBEST Universal RNA Extraction Kit试剂盒(TaKaRa公司)要求提取所有样品总 RNA,Prime-ScriptTMRT Master Mix试剂盒(TaKaRa公司)逆转录获取cDNA。使用Primer5软件设计扩增待验证基因引物,并在上海生工生物工程股份有限公司合成引物,序列如下:Mstn:5’-CCTGGGAAGGTTACAGCAAG-3’和 5’-GGCACTGGTATTTGGCAGAG-3’;Fbp1:5’-ACATCGTTCCCACCGAGAT-3’和 5’-CACTTGGCTTTGTGCTTCCT-3’;Mttp:5’-CGGACCAGATGAAGAAGCAT-3’和 5’-CAGAGAGGCGAGAAGAGCAT-3’;Ptgis:5’-GCCTTCTCCTCTTTCCCTTC-3’和 5’-GCCGTTTCCCATCTTTGTAA-3’; Nrg2: 5’-CATCCTCCACCCTCACTTTG-3’和 5’-CCTCCTATCGCTGGTTCAAG-3’;UCP1:5’-TGGCGTGGCGGTATTCA-3’和 5’-TGGCTTTGTGCTGTGTGA-3’。以 18S(德 国 QIAGEN QT01036875)作为内部参照基因。用SYBR Premix Ex TaqII(Tli RNaseH Plus)试剂盒进行RT-qPCR反应操作。反应体系为:10μl SYBR Premix Ex TaqII(Tli RNaseH Plus)(2×),0.4μl ROX Reference Dye II,0.8 μl PCR Forward Primer(10μmol/L),0.8μl PCR Reverse Primer(10μmol/L),2μl cDNA模板,6μl RNasefree dH2O;采用两步法PCR扩增标准程序:95℃预变性30 s,循环扩增 95℃ 5 s→60℃ 34 s(循环 40次),添加熔解曲线。采用△△Ct法(比较阈值法)表示目的基因的相对表达[4]。
1.7 统计学分析
所得实验数据采用均数±标准差(±s)表示,采用SPSS 19.0统计软件进行分析,统计学分析采用单因素方差分析。
2 结果
2.1 体重和摄食量
肥胖模型建立前各组小鼠体重无显著性差异;8周构建肥胖模型成功后,进行4周低氧暴露后,H组体重显著低于OB组(P<0.05);低氧暴露前后H组与OB组相比的日平均摄食量无显著性差异(表1)。
Tab.1 Body weight and food intake before and after hypoxia exposure(±s,n=8)

Tab.1 Body weight and food intake before and after hypoxia exposure(±s,n=8)
N:Normal diet control group;OB:High-fat diet control group;H:High-fat diet hypoxia group*P<0.05 vs OB after hypoxia exposure group
Group Body weight(g) Food intake(g/d )N 1.87±0.08 Before 20.27±0.14 1.90±0.13 After 26.21±0.75 1.85±0.21 OB Before 24.79±0.24 1.72±0.20 After 27.53±0.61 1.79±0.12 H Before 24.79±0.24 1.72±0.20 After 26.65±1.24*
2.2 各组血液生化指标的改变
与N组相比,OB组血液各项指标均出现显著上升(P<0.05)。H组较OB组血清TG水平无显著性差异,但血糖和CHO水平出现显著下调(P<0.05,表 2)。
Tab.2 Results of TG、CHO and GLU in blood(mmol/L,±s,n=8)

Tab.2 Results of TG、CHO and GLU in blood(mmol/L,±s,n=8)
N:Normal diet control group;OB:High-fat diet control group;H:High-fat diet hypoxia group;TG:Triglyceride;CHO:Cholesterol;GLU:Glucose*P<0.05 vs N group;#P<0.05 vs OB group
Group TG CHO GLU N 0.29±0.02 2.03±0.09 8.5±0.78 OB 0.34±0.03* 4.54±0.30* 10.22±1.77*H 0.35±0.16 3.98±0.30# 8.06±1.29#
2.3 各组芯片扫描分析结果
2.3.1 聚类分析图 运用Gene Spring GX软件筛选OB组与N组及H组与OB组的表达差异基因(筛选条件错误检出率(false discovery rate,FDR)设定为5%以内,FC(abs)为1.5倍。用 Cluster 3.0软件对筛选的表达基因进行层次聚类分析(图1,见彩图页Ⅳ)。a为OB vs N聚类图,b为H vs OB聚类图。图中每一条线代表一个基因,红色表示上调表达数据,绿色表示下调,黑色表示消除或缺失(n=3)。
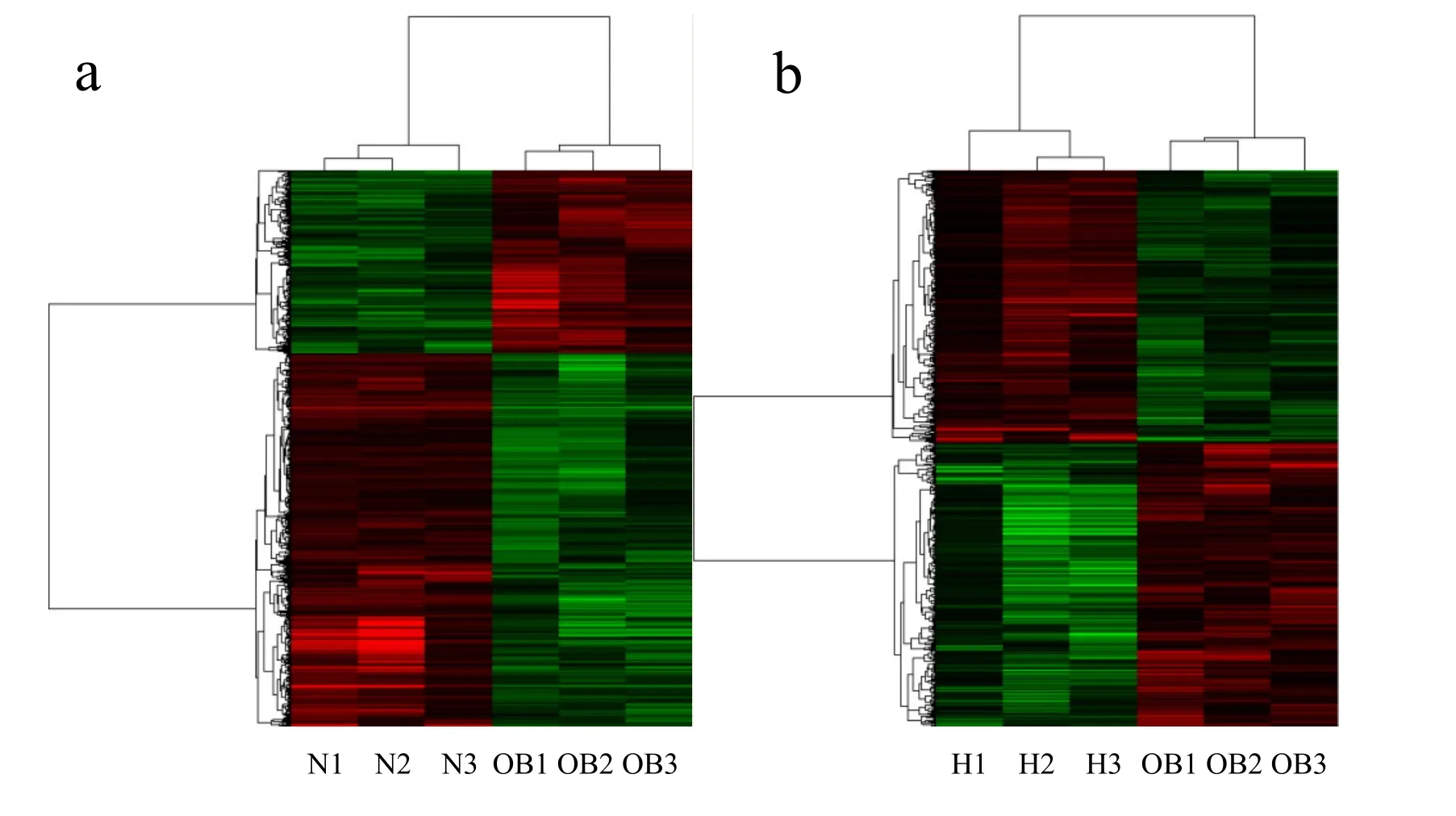
Fig. 1 Clusters graph of OB vs N(a)and H vs OB(b)
2.3.2 差异基因的分析 以 FC(abs)≥1.5倍,P<0.05为标准筛选差异表达基因后,发现OB组与N组相比,共有1 977个差异基因,其中上调基因802个,下调1 175个,差异基因主要生物学过程(biological Process,BP)主要涉及糖脂合成代谢及免疫炎症反应过程;H组与OB组相比,共有525个差异基因,其中上调297个,下调228个,BP主要包括糖脂代谢、脂质转运和脂肪细胞分化过程,肌肉组织发育过程及脉管系统发育过程。KOBAS2.0软件分析发现,低氧暴露肥胖机体BAT过程中显著变化的通路包括:HIF-1信号通路、PI3K-Akt信号通路、FoxO信号通路、ErbB信号通路等过程。这些关键基因所在通路具有调节和参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能。
2.3.3 关键差异基因的筛选 根据差异基因的差异倍数、生物功能和所在通路,筛选以下基因作为要验证的关键差异基因:Mstn、Fbp1、Mttp、Ptgis、Nrg2和UCP1(表 3)。
2.4 RT-qPCR验证芯片结果
OB组 BAT中 Fbp1、Mttp、Ptgis和 Nrg2 mRNA水平较N组显著降低,UCP1 mRNA水平有降低的趋势,Mstn mRNA水平显著上升;H组的 Fbp1、Mttp、Ptgis和Nrg2 mRNA水平较N组显著降低,UCP1 mRNA水平显著升高(P<0.05,P<0.01)。其中 H组 Mttp和 Nrg2 mRNA较 OB组明显上升,Fbp1、Ptgis和UCP1 mRNA水平有上升的趋势,Mstn mRNA回降(表4)。基因RT-qPCR检测结果与芯片结果一致,证明芯片结果的准确性。
3 讨论
BAT是一种通过线粒体脂质氧化产热而促进人体的能量平衡的脂肪组织。就BAT颜色、氧化代谢方式和线粒体数量而言,其与骨骼肌的相似度远远高于WAT,且骨骼肌内含有少量BAT前体细胞[5]。基于BAT产热耗能的作用,增加体内BAT量和/或增强BAT活性可以有效抑制肥胖发生和发展。寒冷和运动等刺激可以活化BAT。BAT对机体的调控作用为减少机体WAT及调节糖脂代谢水平。
BAT与骨骼肌发育功能及糖脂代谢相关过程紧密联系。肌肉生长抑制素(Mstn)在低氧抑制肌肉生长过程中发挥着重要的作用[6],同时参与调节脂代谢和能量消耗。本研究提示低氧会下调肥胖机体BAT中Mstn水平。Mstn缺失可通过激活脂解相关酶而促进外周和线粒体中FA的氧化,诱导WAT棕色化以增加产热[7];同时,使用Mstn抑制剂可以调控BAT分化,促进 PRDM16和UCP1的表达,提高BAT活性[8];果糖二磷酸酶 1(Fbp1)在糖异生中发挥关键作用,可将果糖-l,6-二磷酸转变成果糖-6-磷酸。Fbp1在BAT和骨骼肌中活性高于WAT,在儿茶酚胺的调控下,寒冷会增加Fbp1活性。本研究中OB组Fbp1水平显著下降,说明肥胖下调BAT的糖代谢水平;微粒体甘油三酯转移蛋白(Mttp)是一种重要的脂质转运蛋白,可促进TG、CHO和磷脂酰胆碱转运[9]。高脂饮食饲喂 BAT缺失鼠会出现Mttp水平的降低,导致血脂异常和高胰岛素血症[10]。

Tab.3The information of key differential genes

Tab.4 Relative mRNA expression of differentially expressed genes(n=6)
低氧暴露可增加基础代谢量,促使能量失衡,从而使体脂率和肌肉量下降[11]、棕色脂肪占总脂肪比率及PGC-1α等基因表达显著升高[12]。本研究H组Fbp1和Mttp含量较OB组显著上调,提示低氧可以促进肥胖机体BAT的糖脂代谢。机体细胞在氧含量不足时会首先切换至糖分解模式以产生能量[13],Fbp1是糖异生中重要的限速酶,故低氧暴露会上调Fbp1含量以产能;而缺氧会使心肌细胞Mttp蛋白水平显著上调,避免TG在心肌细胞的积累[14]。同时,H组UCP1和产热相关基因前列腺素I2合成酶(Ptgis)mRNA水平较OB组出现上调,提示低氧暴露对BAT具有活化作用,其发挥作用可能通过以下途径:血管内皮生长因子(vascular endothelial cell growth factor,VEGF)是重要的促血管生成因子,参与肥胖的发生发展。大量表达于肌肉和BAT的VEGF-B是其家族成员之一,参与脂肪酸的摄取和代谢[15,16]。低氧可通过上调VEGF基因表达而使高原土著动物适应低氧环境[17]。本研究提示低氧暴露后HIF-1通路出现显著变化,且Ptgis显著上调,说明低氧暴露可通过上调 HIF-1/VEGF/环氧化酶-2(cyclooxygenase-2,COX-2)/前列腺素(prostaglandin,PG)信号通路而提高BAT活性。同时,COX-2下游的前列腺素I2(环前列腺素)(prostaglandin I2,PGI2)/Ptgir/PPARγ信号通路可促使间质祖细胞向BAT细胞分化,有助于产热和增加肥胖机体的能耗[18];叉头状转录因子O(forkhead transcription factor O,FoxO)是一种重要的肿瘤抑制因子,与肥胖与2型糖尿病发病密切相关。肥胖会导致FoxOmRNA水平显著升高,且与胰岛素抵抗程度及血TG水平呈正相关,此过程可能通过增加肝脏葡萄糖的输出和TG生成而实现[19]。菊苣酸可通过PI3K/Akt信号通路下调3T3-L1前脂肪细胞中 PGC-1α和 FoxO4蛋白表达[20],以发挥抗肥胖作用。本研究提示低氧暴露可通过下调 BAT中PI3K/Akt/FoxO通路而调控肥胖所致的糖脂代谢紊乱;神经调节蛋白(Nrg)是表皮生长因子大家族中一类相关蛋白质群的总称,与代谢密切相关。如Nrg 4在BAT分化时高表达,可通过激活BAT中的ErbB信号通路,负调控脂肪的生成,改善肥胖所致的代谢紊乱[21]。而Nrg1是调节骨骼肌代谢的重要蛋白,高脂高糖转普通饮食可使肥胖机体Nrg1/ErbB通路活性显著上调[21]。本研究中H组Nrg2水平较OB组显著上调,且ErbB信号通路出现显著变化,提示低氧可通过调节BAT中Nrg/ErbB通路而控制肥胖的发生。
肥胖机体在血糖血脂和体重上升同时伴随着BAT中糖脂代谢相关基因的改变,而低氧暴露可通过调节HIF-1、PI3K-Akt、FoxO和ErbB信号通路来调节BAT的糖脂代谢,肌肉和脉管系统发育及产热功能,从而达到提高BAT活性,改善肥胖机体代谢紊乱的作用。
【参考文献】
[1] Truong MT,Erasmus JJ,Munden RF,et al.Focal FDGuptake in mediastinal brown fat mimicking malignancy:a potential pitfall resolved on PET/CT[J].AJR Am J Roentgenol,2004,183(4):1127-1132.
[2] Seale P,Bjork B,Yang W,et al.PRDM16 controls a brown fat/skeletal muscle switch[J].Nature,2008,454(7207):961-67.
[3] Faucher M,Guillot C,Marqueste T,et al.Matched adaptations of electrophysiological,physiological,and histological properties of skeletal muscles in response to chronic hypoxia[J].Pflugers Arch,2005,450(1):45-52.
[4] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[5] Crisan M,Casteilla L,Lehr L,et al.A reservoir of brown adipocyte progenitors in human skeletal muscle[J].Stem Cells,2008,26(9):2425-2433.
[6] 贺道远,曾凡星,倪吉祥.间歇低氧对大鼠骨骼肌IGF-1和myostatin基因表达的影响[J].中国应用生理学杂志,2008,24(4):442-443.
[7] Zhang C,Mcfarlane C,Lokireddy S,et al.Inhibition of myostatin protects against diet-induced obesity by enhancing fatty acid oxidation and promoting a brown adipose phenotype in mice[J].Diabetol,2012,55(1):183-193.
[8] Braga M,Pervin S,Norris K,et al.Inhibition of in vitro and in vivo brown fat differentiation program by myostatin[J].Obesity(Silver Spring),2013,21(6):1180-1188.
[9] 陈仕均,唐海蓉.微粒体甘油三酯转运蛋白研究进展[J].动物医学进展,2007,28(12):84-89.
[10] Siri P,Candela N,Zhang YL,et al.Post-transcriptional stimulation of the assembly and secretion of triglyceride-rich apolipoprotein B lipoproteins in a mouse with selective deficiency of brown adipose tissue,obesity,and insulin resistance[J].J Biol Chem,2002,276(49):46064-46072.
[11]Lippl FJ,Neubauer S,Schipfer S,et al.Hypobaric hypoxia causes body weight reduction in obese subjects[J].Obesity(Silver Spring),2010,18(4):675-681.
[12]付鹏宇,龚丽景,段佳妍,等.低氧运动对肥胖小鼠脂肪UCP-1和PGC-1α表达的影响[J].中国运动医学杂志,2015,34(11):1070-1075.
[13]Minchenko O,Opentanova I,Caro J.Hypoxic regulation of the 6-phosphofructo-2-kinase/fructose-2, 6-bisphosphatase gene family(PFKFB-1-4)expression in vivo[J].FEBS Lett,2003,554(3):264-270.
[14] Nielsen LB,Perko M,Arendrup H,et al.Microsomal triglyceride transfer protein gene expression and triglyceride accumulation in hypoxic human hearts[J].Arterioscler Thromb Vasc Biol,2002,22(9):1489-1494.
[15] Hagberg CE,Falkevall A,Wang X,et al.Vascular endothelial growth factor Bcontrols endothelial fatty acid uptake[J].Nature,2010,464(7290):917-921.
[16]Li X.VEGF-B:a thing of beauty[J].Cell Res,2010,20(7):741-744.
[17]赵伟民,贾桂花,周婷婷,等.低氧环境对高原鼢鼠不同组织VEGF-(165b)基因表达量及微血管密度的影响[J].中国应用生理学杂志,2017,33(1):68-70.
[18]徐灵均,廖信辉,张吉翔.环氧合酶-2与肥胖[J].生命的化学,2011,31(6):912-915.
[19]马晓君,秦贵军,闫晓洁,等.高脂肥胖大鼠肝脏组织中叉头状转录因子O1的表达及其与糖脂代谢的关系[J].郑州大学学报(医学版),2010,45(1):44-47.
[20]肖海芳,袁 莉,王 静,等.菊苣酸下调3T3-L1前脂肪细胞中PGC-1α及FoxO4蛋白表达[J].食品科学,2013,34(21):297-301.
[21]Ennequin G,Boisseau N,Caillaud K,et al.Exercise training and return to a well-balanced diet activate the neuregulin 1/ErbBpathway in skeletal muscle of obese rats[J].J Physiol,2015,593(12):2665-2677.
