6周大强度训练对大鼠肾功能的影响及其机制*
2018-05-15牛衍龙曹建民周海涛
牛衍龙,曹建民,周海涛,李 浩
(1.北京体育大学,北京100084,2.北京联合大学,北京100023)
竞技体育与军事训练中,受训人员以长期大强度训练提高运动和作战能力。由于负荷过大,超出机体的承受能力,且疲劳长时间得不到有效地恢复,极易引发过度训练综合症并导致肾脏损伤,表现为蛋白尿、血尿、电解质紊乱等临床症状[1]。运动性蛋白尿的发生原理尚不完全清楚,目前认为与外伤、酸性代谢产物的刺激、肾血管收缩造成的缺血及肾小球滤过屏障通透性改变等有关[2]。过度的运动应激可导致肾脏滤过屏障结构发生改变进而功能下降,蛋白渗出后远超肾小管重吸收阈值(或伴有肾小管损伤),产生运动性蛋白尿[3]。裂孔隔膜(slit diaphragm,SD)是肾脏滤过屏障三层膜中最重要和最具生物学活性的一部分,Nephrin作为SD的主要结构蛋白,参与足细胞内的信号传导[4]。过度训练对肾脏组织中Nephrin的蛋白表达量的影响及其影响机制尚不清楚。研究表明[5],肾素-血管紧张素系统(renin angiotensin system,RAS)参与蛋白尿的发生、炎症反应、肾小球硬化等的发生发展,其过度兴奋可导致肾脏的不可逆损伤。本实验通过观察6周大强度训练对大鼠肾脏组织形态学的改变并检测相关肾脏损伤标志物的影响,判断是否引发过度训练、运动性肾损伤及运动性蛋白尿;结合肾脏内Nephrin蛋白的表达量及肾脏局部及循环系统血液中RAS指标变化,探索长期大强度运动对肾脏结构、功能的影响及运动性蛋白尿的发生机制。
1 材料与方法
1.1 实验动物与分组
SD雄性大鼠 36只(6周龄),体重(212.76±5.23),由北京维通利华实验动物技术有限公司提供,动物生产合格证编号 SCXK(京)2012-0001。随机分为两组:对照组(C组,n=12)、大强度训练组(M,n=24)。北京体育大学动物房SPF级屏障环境下饲养,湿度 50%~70%,室温 20°C~24°C。
1.2 训练方案
大鼠适应性饲养4 d后,C组不进行任何运动,M组采用6周递增负荷游泳训练,每周训练6 d,每天训练1次。第4周起开始负重(体重的1%)并逐渐递增(体重的6%),具体训练方案详见表1[6]。若发现大鼠有力竭表现,即沉入水下10 s不能上浮,则托出水面休息5~10 min后再继续游泳训练至完成训练方案。

Tab.1 Specific training protocol(s,n=24)
1.3 实验动物取材
训练结束后,受训练强度、频度、负重情况、恢复时间等因素影响,M组大鼠出现意外死亡,仅剩21只。末次训练结束后30 min(此时蛋白尿排泄量最大)[7]随机选取 C组与 M组大鼠各8只取单次尿液:将大鼠放在铺有塑料薄膜的饲养笼中,待其排尿后,用加样枪吸出放入至离心管中,3 000 r/min离心20 min,收集上清液待测。末次训练后24 h,C组、M组大鼠注射2%戊巴比妥钠溶液2 ml麻醉,腹主静脉取血,37℃自然凝固,待血清出现后放入冰箱24 h,3 000 r/min离心 10 min,分离制备血清,置-20℃冰箱中保存待测。取左侧肾脏浸入4%多聚甲醛固定液中,右侧肾脏剔除筋膜,置于预冷的生理盐水中洗净血污,迅速投入液氮暂存,随后保存于-80℃冰箱冻存待测。
1.4 肾脏病理学变化测评
固定液中取出肾脏,洗涤12 h,梯度酒精脱水后透明,然后浸入石蜡包埋,4μm切片后HE染色,显微镜400倍镜下观察肾脏肾小球组织形态结构,并参照Paller标准[8],随机选择5个视野中10个肾小管进行肾脏损伤评分,由两名技术员双盲计算,取平均值。
1.5 其他指标测试方法
比色法检测尿总蛋白含量(total protein,TP),由Thermo Fisher Scientific公司提供;Elisa法检测尿液微量白蛋白(microalbumin,mAlb)、大鼠尿液中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin,NGAL),由上海科华生物工程股份有限公司和 CLOUD-CLONE CORP.提供,通过 Bio-RadxMark酶标仪读取数值。KHB-1280全自动生化仪检测尿肌酐(urine creatinine,CRE)、血清肌酐(serum creatinine,SCr)、尿素氮(blood urea nitrogen,BUN),试剂盒由北京金海科隅生物科技发展有限公司和北京华英生物技术研究所提供。Western blot检测肾脏Nephrin表达:将于-80℃保存的肾脏样品取出研磨裂解,每孔道加等量蛋白经6%SDS-PAGE分离电泳后,转至聚偏二氯乙烯膜。BSA封闭后一抗孵育过夜,洗涤后再二抗孵育。抗体以及稀释浓度为:Nephrin兔单克隆抗体(Sigma,PRS2265),稀释浓度 1∶2 000;GAPDH鼠单克隆抗体(CST,D16H11),稀释浓度1∶20 000。Thermo Pierce ECL化学发光液显色,X光暴露成像,采用软件Image Lab 4.0进行灰度分析。XH-6020全自动放免计数仪(西安核仪器厂提供)进行放射免疫法测试:血清睾酮(testosterone,T)、皮质酮(corticosterone,Cor);肾素活性(renin activity,Ra)、血管紧张素(angiotensinⅡ,AngⅡ)分别取低温保存肾脏小部分研磨定量后测定肾脏内部Ra、AngⅡ,而循环系统中Ra、AngⅡ则取样血清进行测试,试剂盒均由北京华英生物技术研究所提供。
1.6 统计方法
所有数据以均数±标准差(±s)表示,统计处理用 SPSS 20.0软件进行分析,采用单因素方差(one-way ANOVA)分析。
2 结果
2.1 大强度运动训练对大鼠肾脏组织结构的影响
C组大鼠肾小球内血管系膜紧凑有致,血管球与囊腔壁界限明显,血管内红细胞分布规律;M组大鼠肾脏肾小球囊腔和血管球出现严重膨大现象,血管系膜结构破坏,血管球与囊腔壁界限模糊,小管上皮细胞水肿、空泡变性、管腔扩张严重,管腔有少量脱落绒毛和上皮细胞,出现各种管型(图1)。M组大鼠肾小管 Paller评分(14.01±3.53)显著高于 C组(2.36±1.19)(P<0.01)。

Fig.1 Glomerulus morphology in the two groups(HE×400)
2.2 大强度运动对血清睾酮/皮质酮的影响
M组血清睾酮较C组显著降低(P<0.01);血清皮质酮组间无显著性变化;血清T/C,M组较C组显著降低(P<0.01,表 2)。
Tab.2 Comparison of serum testosterone/corticosterone between the two groups(±s,n=12,21)

Tab.2 Comparison of serum testosterone/corticosterone between the two groups(±s,n=12,21)
T:Testosterone;Cor:Corticosterone**P<0.01 vs group C
?
2.3 大强度运动对尿液指标的影响
M组尿液 TP、mAlb,NGAL显著高于 C组(P<0.01);排除尿量对判定指标的影响,M组 mAlb/CRE显著高于 C组(P<0.01,表 3)。
Tab.3 Changes of urine index induced by strength training(±s,n=8)

Tab.3 Changes of urine index induced by strength training(±s,n=8)
TP:Total protein;mAlb:Microalbumin;CRE:Creatinine;NGAL:Neutrophil gelatinase associated lipocalin**P<0.01 vs group C
Group TP(μg/ml)mAlb(μg/L)CRE(μmol/L)mAlb/CRE(10-4)NGAL(ng/ml )0.963±0.369 13.33±2.38 7598.8±1000.7 17.89±4.27 2.98±1.57 M 1.899±0.368** 19.15±3.23** 4123±634.6** 47.55±12.49** 13.04±6.25 C**
2.4 大强度运动训练对肾脏损伤指标的影响
血清 BUN、SCr,M组显著高于 C组(P<0.01,表 4)。
Tab.4 Comparison of renal injury index between the two groups(±s,n=12,21)
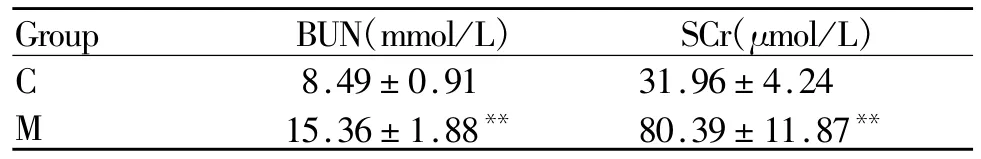
Tab.4 Comparison of renal injury index between the two groups(±s,n=12,21)
BUN:Blood urea nitrogen;SCr:Serum creatinine**P<0.01 vs group C
Group BUN(mmol/L) SCr(μmol/L )8.49±0.91 31.96±4.24 M 15.36±1.88** 80.39±11.87 C**
2.5 大强度运动训练对肾脏组织Nephrin的影响
M组肾脏组织 Nephrin蛋白表达量(0.634±0.293)较 C组显著降低(P<0.01,图 2)。
2.6 大强度运动训练对肾脏局部和循环系统RAS相关指标的影响
M组大鼠肾脏局部和循环系统中Ra,AngⅡ显著性升高,明显高于 C组(P<0.01,表 5)。
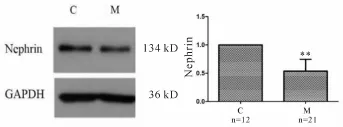
Fig.2 Expression of nephrin and trend chart
Tab.5 RASindex in the two groups(±s,n=12,21)

Tab.5 RASindex in the two groups(±s,n=12,21)
RAS:Renin angiotensin system;iRa:Intrarenal Renin activity;iAngII:IntrarenalAngiotensinⅡ;cRa:Circulatory system renin activity;cAngII:Circulatory system angiotensinⅡ**P<0.01 vs group C
Group iRa(ng/mg·h) iAngII(pg/mg) cRa(ng/ml·h) cAngII(pg/ml )0.334±0.024 6.442±0.646 2.832±0.562 97.475±17.841 M 0.426±0.060** 7.932±1.103** 3.915±0.698** 128.670±19.682 C**
3 讨论
睾酮与皮质酮间的比值可以有效地反映机体分解和合成代谢的平衡状况,是判断机体出现过度训练综合症的重要指标,M组大鼠睾酮与皮质酮的比值较C组大鼠下降37%,超过了冯炜权教授等多位学者[9]提出的过度训练的诊断参考标准,说明6周的大强度训练导致大鼠出现过度训练综合征。尿TP是肾脏功能异常的最直接的检测指标。mAlb作为评估早期肾小球损伤的有效指标之一,在肾小球压力增加、滤过屏障受损或白蛋白吸收异常,排泄量会增加[10]。正常人体肾脏中NGAL的表达水平较低,但当肾小管缺血性损伤时NGAL呈高表达,并在2 h内出现于尿液[11]。检测血清肌酐(SCr)和尿素氮(BUN)变化可以进一步明确肾损伤程度[12]。本实验说明6周的大强度训练导致大鼠出现运动性肾脏损伤及运动性蛋白尿。
Nephrin是特异的表达于足细胞的一种蛋白,对于维持肾小球滤过屏障结构与功能完整性起关键作用。Nephrin表达减少可引起SD的组成发生改变,足突间的分子连接减少或中断、足细胞损伤脱落,破坏肾小球滤过屏障、通透性增加,导致尿蛋白排出增加;此外Nephrin是足细胞重要的信号传递因子,其表达下调,可使细胞内外信号传递发生障碍,引起足细胞结构功能的进一步破坏,从而形成恶性循环[13]。RAS活性的增加是肾脏功能异常与慢性肾脏疾病的重要诱因之一[14],Ra和AngⅡ是RAS的主要效应指标,它们通过调节肾脏血管的紧张度和水、钠的重吸收发挥其血流动力学作用。AngⅡ的过度表达可以破坏SD结构和功能的完整性,进而引起肾小球损伤[15,16]。在糖尿病肾病和多种肾小球疾病状态下,血管紧张素Ⅱ转化酶抑制剂或AngⅡ受体拮抗剂可减轻足细胞损伤、稳定Nephrin等SD结构分子的表达。本实验中M组大鼠肾脏组织和循环系统血液中Ra、AngⅡ出现显著升高,同时Nephrin表达下调明显,说明6周大强度训练使得RAS在训练结束后24 h仍然处于高度兴奋的状态,AngⅡ随着Ra增加同步升高,而Nephrin在肾脏内部与循环血液中高浓度的AngⅡ作用下呈现持续性的低表达状态。有研究表明[17],一次性力竭运动可造成肾脏内部Ra和AngⅡ升高,RAS兴奋性增加,并肾静脉进入血液,以启动循环系统的RAS链式反应,造成循环系统血液中的Ra和AngⅡ增加。本实验采用的6周大强度训练方案造成运动性肾损伤的原因可能为过度训练引发运动性肾缺血再灌注,在停止运动后肾脏内Ra和AngⅡ升高的同时,不断向血液中分泌,引起循环系统RAS活性随之增加,且在损伤峰值点(停止运动后24 h)肾脏内部与循环系统RAS均表现出较高的兴奋状态。持续兴奋的RAS引发的高浓度AngⅡ作用于肾脏内足细胞,导致Nephrin蛋白下调,SD出现异常,引发运动性肾损伤及运动性蛋白尿。然而本研究受条件所限,没有针对运动后不同时间节点下肾脏内部与循环系统中RAS的活性情况进行深入和展开,有待进一步研究。
【参考文献】
[1] Lipman GS,Krabak BJ,Waite BL,et al.A prospective cohort study of acute kidney injury in multi-stage ultramarathon runners:the Biochemistry in Endurance Runner Study(BIERS)[J].Res Sports Med,2014,22(2):185-192.
[2] 王 欣.运动性蛋白尿发生的机制及其诊断方法[J].盐城工学院学报(自然科学版),2005,(03):58-60.
[3] Mundel P,Reiser J.Proteinuria:an enzymatic disease of the podocyte[J].Kidney International,2010,77(7):571-580.
[4] Patrakka J,Tryggvason K.Nephrin-a unique structural and signaling protein of the kidney filter[J].Trends Mol Med,2007,13(9):396-403.
[5] Brewster UC,Perazella MA,Setaro JF.The Renin-Angiotensin-Aldosterone System:Cardiorenal Effects and Implications for Renal and Cardiovascular Disease States[J].Am J Med Sci,2003,326(1):15-24.
[6] 崔笑梅,曹建民,周海涛,等.黑果枸杞子对过度训练大鼠骨骼肌MAPK信号通道蛋白表达及抗氧化应激损伤能力的影响[J].中国实验方剂学杂志,2017,23(03):122-127.
[7] Mundel P,Reiser J.Proteinuria:an enzymatic disease of the podocyte[J].Kidney Int,2010,77(7):571-580.
[8] Paller MS,Hoidal JR,Ferris TF.Oxygen free radicals in ischemic acute renal failure in the rat[J].J Clin Invest.,1984,74(4):1156-1164.
[9] 冯炜权.运动疲劳及过度训练的生化诊断—运动生物化学动态之三[J].北京体育大学学报,2000,23(04):498-502.
[10]MoubarakM,JabbourH,SmayraV,et al.Cardiorenal syndrome in hypertensive rats:microalbuminuria,inflammation and ventricular hypertrophy[J].Physiol Res,2012,61(1):13-24.
[11] Devarajan P.Neutrophil gelatinase-associated lipocalin(NGAL):a new marker of kidney disease[J].Scand J Clin Lab Invest Suppl,2008,68(241):89-94.
[12] DennenP,ParikhCR.Biomarkers of acute kidney injury:can we replace serum creatinine[J].Clin Nephrol,2007,68(5):269-278.
[13]Zhu J,Sun N,Aoudjit L,et al.Nephrin mediates actin reorganization via phosphoinositide 3-kinase in podocytes[J].Kidney Int,2008,73(5):556-566.
[14]Denhez B,Geraldes P.Regulation of Nephrin Phosphorylation in Diabetes and Chronic Kidney Injury[J].Adv Exp Med Biol,2017,62(5):1-13
[15] Yu S.Role of nephrin in podocyte injury induced by angiotensionII[J].J Recept Signal Transduct Res,2014,36(1):1-5.
[16]Benigni A,Gagliardini E,Remuzzi G.Changes in glomerular perm-selectivity induced by angiotensin II imply podocyte dysfunction and slit diaphragm protein rearrangement[J].Semin Nephrol,2004,24(2):131-140.
[17]Maeda S,Iemitsu M,Jesmin S,et al.Acute exercise causes an enhancement of tissue renin-angiotensin system in the kidney in rats[J].Acta Physiol Scand,2005,185(1):79-86.
