吉西他滨联合顺铂对晚期非小细胞肺癌患者生存质量、预后及血清CYFRA21-1、IGF-1水平的影响
2018-05-11谭兴平刘娜娜蒋义成魏武杰
谭兴平 刘娜娜 付 愚 蒋义成 潘 放 魏武杰 韩 燕 文 超
(重庆市合川区人民医院肿瘤科,重庆 401520)
肺癌在全球范围内都有较高的发病率和病死率,其中84.3%以上的患者属非小细胞肺癌(NSCLC),大多数患者在确诊时都已发展到病理晚期,治疗难度较大〔1〕。故目前临床治疗主要采用放化疗的措施来延长患者的生存期、提高患者的生存质量。顺铂是一种治疗多种癌症的经典药物,通过抑制癌细胞的DNA复制来发挥抗肿瘤的作用,单独应用治疗NSCLC的有效率仅为39.6%左右〔2〕。吉西他滨是一种人工合成的新型嘧啶类核苷酸药物,对癌细胞的DNA具有明显的破坏作用〔3〕。血清细胞角蛋白19片段(CYFRA21-1)和胰岛素样生长因子(IGF)-1是常见的用于评价NSCLC疗效及预后的血清学指标。本研究主要探讨吉西他滨联合顺铂对晚期NSCLC患者生存质量、预后及血清CYFRA21-1、IGF-1水平的影响,为NSCLC的治疗提供参考。
1 资料与方法
1.1一般资料 选择2015年7月至2016年7月合川区人民医院收治的80例晚期NSCLC患者作为研究对象。病例纳入标准:(1)通过影像学检查与病理组织检测确诊为NSCLC;(2)TNM分期为:Ⅲb~Ⅳ期,卡氏功能评分(KPS)>60分〔4〕;(3)预计生存时间>3个月。病例排除标准:(1)合并有肝、肾等疾病患者;(2)合并有心脑疾病患者;(3)合并有精神类疾病患者;(4)有化疗禁忌证患者。按照随机数字表法将80例纳入病例均分为对照组和治疗组,每组40例。对照组男26例、女14例;年龄45~75岁,平均(60.38±7.14)岁;TNM分期:Ⅲb期27例、Ⅳ期13例;病理类型:腺癌21例、鳞癌15例、其他4例。治疗组男25例、女15例;年龄45~77岁,平均(62.10±9.52)岁;TNM分期:Ⅲb期28例、Ⅳ期12例;病理类型:腺癌23例、鳞癌14例、其他3例。两组性别、年龄、TNM分期及病理类型等一般资料比较差异均无统计学意义(P>0.05),具有可比性。所有患者对本研究知情同意并签署知情同意书,本研究经医院医学伦理委员会批准。
1.2治疗方法 对照组单纯给予吉西他滨(江苏豪森药业股份有限公司,国药准字H20030104,规格0.2 g/支)治疗,具体为:治疗第1天、第8天给予吉西他滨,静脉滴注,剂量1 000 mg/m2,分2次给药,3 w为1个疗程,连续治疗4个疗程。治疗组给予吉西他滨联合顺铂(江苏豪森药业股份有限公司,国药准字H20040813,规格30 mg/支)治疗,具体为:吉西他滨给药方法同对照组;顺铂,第1天、第2天静脉注射给药,剂量75 mg/m2,3 w为1个疗程,连续给予治疗4个疗程。两组患者在治疗期间均给予水化、利尿等常规辅助治疗。
1.3临床疗效〔5〕两组患者治疗后1个月评价并比较近期疗效。临床疗效主要分为4个等级:(1)完全缓解(CR):临床症状完全缓解,病灶完全消失,且持续时间在1个月以上;(2)部分缓解(PR):临床症状有所缓解,病灶最大直径及其最大垂直径和乘积减少一半以上,且持续时间在1个月以上;(3)疾病稳定(SD):临床症状改善不明显,病灶最大直径及其最大垂直径和乘积减少一半以下,或增加不超过四分之一;(4)疾病进展(PD):临床症状加重,病灶最大直径及其最大垂直径和乘积增大四分之一以上。总缓解率=(CR+PR)/总例数×100%。治疗后1年内对两组患者进行随访,统计并比较生存率。
1.4观察指标
1.4.1生存质量评价 应用生存质量测评量表(QOL)评分评价患者的生存质量改善情况。QOL评分量表共包括食欲、睡眠、疲劳、疼痛、功能状况、精神状态、情感状况、不良反应、日常生活状态、对家庭的态度、与医生的关系、附加关注12项内容,每项5分,总分为60分,总评分越高表明患者的生存质量越好〔6〕。
1.4.2血清检测指标 所有患者均在清晨8点空腹状态下采集静脉血5 ml,以离心半径10 cm,3 000 r/min离心10 min,取上清液密封后放置于-20℃冰箱中待用。检测并比较治疗前后两组CYFRA21-1、IGF-1在血清中的表达水平。血清CYFRA21-1、IGF-1水平均采用双抗夹心酶联免疫(ELISA)检测试剂盒,所用试剂及检测试剂盒均购自上海基免实业有限公司,所有操作均符合试剂盒说明书中的试验规程与指南要求。
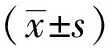
2 结 果
2.1两组近期疗效比较 治疗组的总缓解率为47.50%(19/40),明显高于对照组的22.50%(9/40),差异具有统计学意义(χ2=5.495,P=0.019)。见表1。
2.2两组治疗后1年内生存率比较 两组在治疗后随访1年,期间均无失访病例,治疗组1年内的生存率为45.00%(18/40),明显高于对照组的17.50%(7/40),差异具有统计学意义(χ2=7.040,P=0.008)。
2.3两组治疗前后QOL评分比较 两组治疗前QOL评分比较差异无统计学意义(P>0.05);治疗后两组QOL评分比治疗前均明显提高,且治疗组QOL评分高于对照组,差异均具有统计学意义(P<0.05)。见表2。
2.4两组治疗前后血清CYFRA21-1、IGF-1水平比较 两组治疗前血清CYFRA21-1、IGF-1水平比较差异均无统计学意义(P>0.05);两组治疗后血清CYFRA21-1、IGF-1水平均明显降低,且治疗组水平比对照组明显偏低,差异均具有统计学意义(P<0.05)。见表3。

表1 两组近期疗效比较〔n(%),n=40〕
与对照组比较:1)P<0.05

表2 两组治疗前后QOL评分比较分)
与治疗前比较:1)P<0.05;与对照组比较:2)P<0.05。下表同

表3 两组治疗前后血清CYFRA21-1、IGF-1水平比较
与治疗前比较:1)P<0.05;与对照组比较:2)P<0.05
3 讨 论
研究表明〔7〕,NSCLC的发生发展与遗传、二手烟、环境等多种因素有关,临床症状有发热、胸闷、胸痛、咳嗽等。目前,晚期NSCLC的主要治疗方案为以化疗为主的综合疗法,尤其是以铂类为主的两种或三种药物联合化疗〔8〕。顺铂是一种铂类化疗细胞毒性药物,能够通过与肿瘤细胞的DNA结合形成交叉键从而抑制细胞DNA的复制,单独应用治疗NSCLC的有效率约为39.6%,临床大多将其与其他药物联合应用以提高对NSCLC的疗效〔9〕。吉西他滨是一种与阿糖胞苷结构相似的核苷酸还原酶抑制剂,其在细胞内经核苷激酶的作用诱导转化为活性的二、三磷酸核苷,通过抑制肿瘤细胞DNA合成从G1期转化为S期的过程来促使肿瘤细胞的程序化凋亡,从而发挥抗肿瘤的作用〔10〕。
本研究结果显示,吉西他滨联合顺铂治疗晚期NSCLC的临床疗效显著。有文献报道〔11〕,吉西他滨能够提高顺铂与肿瘤细胞DNA结合的稳定性,还能够抑制肿瘤细胞DNA在损伤后的自我修复作用,从而两者联用能够加强对肿瘤细胞的杀灭作用。另外,吉西他滨与顺铂有协同作用,吉西他滨能够抑制顺铂的耐药性,从而诱导肿瘤细胞的死亡,提升抗肿瘤的作用〔12〕。两组在治疗后随访1年显示,治疗组患者1年内的生存率明显高于对照组,提示吉西他滨联合顺铂能够有效提高患者的生存率,长期临床疗效较好。吉西他滨对肿瘤细胞具有直接的明显破坏作用,抑制肿瘤细胞的自我修复,具有彻底杀灭作用,还能够加强顺铂对肿瘤细胞的广谱杀灭作用,两者联合对肿瘤细胞的增殖在较长的时间里均有一定的抑制作用。本研究结果还显示,两组患者治疗后QOL评分相比治疗前均明显提高,治疗组QOL评分高于对照组。提示吉西他滨联合顺铂能够明显提高晚期NSCLC患者的生存质量。这可能是由于吉西他滨联合顺铂的临床疗效显著,两者联用不会增加对患者的肝、肾等脏器损伤,有利于提升患者的生存质量〔13〕。
另外,本研究结果显示,两组患者治疗后血清CYFRA21-1、IGF-1水平均明显降低,且治疗组水平相比对照组明显偏低。提示吉西他滨联合顺铂能够明显降低晚期NSCLC患者的血清CYFRA21-1、IGF-1水平。CYFRA21-1是一种细胞角蛋白19的可溶性片段,在肺炎、肺结核、肺支气管炎、肺癌等多种疾病中的血清水平明显上升,其血清水平与肿瘤的发生发展有密切联系〔14〕。IGF-1是一种临床常见的多功能细胞增殖调控因子,通过肿瘤的自分泌和旁分泌产生,其血清水平可用于判断肺癌的发生发展及预后〔15〕。
吉西他滨联合顺铂可能能够减少肿瘤标记蛋白的合成,还能够促进胰岛素样生长因子结合蛋白-3(IGFBP3)和IGF-1的竞争性结合,而IGFBP3可通过IGF-1依赖及非IGF-1依赖方式来抑制多种肿瘤细胞增殖,诱导肿瘤凋亡,从而发挥抑制肿瘤细胞增殖的作用〔16〕。
1林晓东,吴其年,梁剑菲,等.p-MNK1表达水平与非小细胞肺癌术后生存率的关系〔J〕.实用医学杂志,2017;33(4):623-6.
2卢路定,韩光明,刘洪波,等.培美曲塞联合顺铂治疗晚期非小细胞肺癌的临床疗效观察〔J〕.现代生物医学进展,2014;14(14):2719-22,2674.
3谢忠海,沈琦斌,李鸿伟,等.多西紫杉醇联合吉西他滨和顺铂治疗非小细胞肺癌的临床研究〔J〕.中国临床药理学杂志,2016;32(11):972-4.
4李晓英,谢启超.不同分期非小细胞肺癌与Treg细胞、细胞因子相关研究〔J〕.安徽医科大学学报,2017;52(1):113-6.
5刘爱学,李明淑,周泽强,等.多西他赛与吉西他滨分别联合顺铂治疗晚期非小细胞肺癌的临床疗效观察〔J〕.海南医学,2013;24(2):171-3.
6姚德蛟.康莱特联合吉西他滨、顺铂治疗晚期非小细胞肺癌的临床疗效及安全性评价〔J〕.中国临床药理学杂志,2015;31(15):1495-6.
7Wang R,Yin Y,Qin Y,etal.High-dose-rate three-dimensional conformal radiotherapy combined with active breathing control for stereotactic body radiotherapy of early-stage non-small-cell lung cancer〔J〕.Technol Cancer Res Treat,2015;14(6):677-82.
8Jeremic B,Casas F,Dubinsky P,etal.The trimodality treatment approach in stage Ⅲ/pN2 non-small cell lung cancer:"Usually Appropriate" may well be a very inappropriate treatment option〔J〕.Am J Clin Oncol,2015;38(6):645.
9李小峰,张亚华.顺铂联合吉西他滨与联合紫杉醇治疗晚期非小细胞肺癌疗效分析〔J〕.现代肿瘤医学,2014;22(5):1087-8.
10陈传喜,袁 红,杨志勇,等.吉西他滨与奥沙利铂联合三维适形同步放化疗治疗Ⅲ期非小细胞肺癌的临床观察〔J〕.西部医学,2014;26(4):442-4.
11马克威,李恩喜,郭 晔,等.核糖核苷酸还原酶M1表达与非小细胞肺癌术后吉西他滨联合顺铂辅助化疗患者预后的关系〔J〕.中华肿瘤杂志,2014;36(7):505-10.
12曾 勇,王赤华,徐立军,等.鸦胆子油联合吉西他滨和顺铂治疗晚期非小细胞肺癌的临床观察〔J〕.中国药房,2017;28(14):1945-8.
13徐经芳.培美曲塞联合顺铂与吉西他滨联合顺铂治疗晚期非小细胞肺癌的临床研究〔J〕.现代肿瘤医学,2014;22(7):1572-4.
14汤自洁,李 丽,丛 辉,等.血清Cyfra21-1、CEA及SF联合检测在非小细胞型肺癌中的临床应用〔J〕.重庆医学,2015;44(21):2972-5.
15薛 珊,查琼芳,赵旭霁,等.CEA、CA125、CYFRA21-1、NSE和SCC对非小细胞肺癌化疗效果及进展评估的价值〔J〕.山东医药,2015;55(25):8-11.
16周红兵,艾 伟,孙 林,等.紫杉醇脂质体和吉西他滨分别联合顺铂治疗晚期非小细胞肺癌的效果及其与中性粒细胞/淋巴细胞比值的相关性〔J〕.中国医药,2015;10(4):468-72.
