利用CRISPR/Cas9n技术生产抗蓝耳病的基因编辑克隆猪
2018-05-11王少华赵盼盼刘通丁彪罗磊曹祖兵张运海张坤
王少华,赵盼盼,刘通,丁彪,罗磊,曹祖兵,张运海,张坤*
(1.浙江大学动物科学学院,哺乳动物分子胚胎学实验室,杭州310058;2.安徽农业大学动物科技学院,合肥230036)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),又称“猪蓝耳病”,是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的重大传染性猪病,是危害我国养猪生产的第一大病毒性疫病,也是全球性疫病,每年给全球养猪业造成数十亿美元的经济损失。PRRS病毒能感染不同品种和年龄的猪,但最易感染妊娠母猪和1月龄以内的仔猪。妊娠母猪感染PRRS病毒发病后会出现胎儿流产、死亡和木乃伊胎;仔猪感染PRRS病毒发病后会出现严重的腹泻和呼吸窘迫。此外,蓝耳病还会引起猪免疫抑制,造成猪免疫力低下,引起猪群的继发感染[1]。
正因为猪蓝耳病对养猪业健康发展的巨大危害,国内外许多科学家一直致力于研究猪蓝耳病的致病和防控机制。经过多年的研究发现,猪CD163蛋白可能是PRRS病毒感染猪肺泡巨噬细胞的主要受体[2]。2014年,美国密苏里大学PRATHER课题组率先利用CRISPR/Cas9系统的基因编辑技术结合体细胞核移植技术获得了敲除猪CD163基因的基因编辑猪[3],并在之后的攻毒实验中证明,敲除了CD163基因的基因编辑猪能够正常存活并且抵抗PRRS病毒的感染,强有力地证明了CD163是PRRS病毒感染猪的必需受体[4]。考虑到猪CD163蛋白还有其他正常的生物学功能,2017年,英国罗斯林研究所的科学家们利用CRISPR/Cas9系统的基因编辑技术精确地删除了猪CD163蛋白与PRRS病毒直接结合的SRCR5(scavenger receptor cysteinerich domain 5)结构域,获得的基因编辑猪同样能够抵抗PRRS病毒的感染,同时,在基因编辑猪中表达的不含SRCR5结构域的CD163蛋白还能够正常发挥其生物学功能[5]。由此可见,对猪的CD163基因进行编辑是生产可以抵抗蓝耳病病毒感染的猪的一种可行性方法。
CRISPR/Cas9系统是近年来被广泛应用的一种基因编辑技术,可以精确地对基因组进行定点删除、插入或置换等改造。与传统的基因打靶技术相比,CRISPR/Cas9系统极大地提高了对目的基因的编辑效率,使得基因编辑技术在大动物研究中得以广泛的应用。利用CRISPR/Cas9系统的基因编辑技术,我国科学家先后获得了基因编辑猪[6-10]和羊[11]等。
CRISPR/Cas9系统主要由2个重要的元件构成——识别特异DNA序列的单链的导向RNA(sgRNA)和切割DNA双链的Cas9核酸内切酶(Cas9 nuclease)。很多研究表明,与Cas9核酸内切酶相比,使用突变了一个活性域的Cas9切刻酶(Cas9 nickase)和2条sgRNA对目的基因进行编辑可以极大地降低CRISPR/Cas9系统的脱靶效应[12-13],这一系统被称为CRISPR/Cas9n系统。
本研究利用CRISPR/Cas9n系统,构建在同一载体中同时表达2条sgRNA和Cas9切刻酶以及绿色荧光蛋白(green fluorescent protein,GFP)的质粒,瞬时转染猪的成纤维细胞,通过流式细胞仪分选获得表达GFP的细胞,继续培养GFP阳性的细胞至单个细胞长成细胞克隆点,经聚合酶链式反应(polymerase chain reaction,PCR)和DNA测序鉴定获得对CD163基因进行编辑的细胞克隆点。以CD163基因编辑的细胞为供体细胞进行体细胞克隆和胚胎移植,以期获得正常存活的CD163基因编辑猪。
1 材料与方法
1.1 主要试剂
PX461载体(购自Addgene公司,货号48140),pMD18-T载体(购自TaKaRa公司);宿主菌大肠埃希菌DH5α(购自TaKaRa公司);引物合成由生工生物工程(上海)股份有限公司完成;序列测定由上海睿迪生物科技有限公司完成;LA Taq酶、T4 DNA连接酶、限制性内切酶均购自TaKaRa公司;细胞培养基DMEM、PBS和胎牛血清购自Life Technologies公司;脂质体Lipofectamine 2000购自Invitrogen公司。酶切、连接、回收、转化、PCR扩增等常规实验操作步骤参考《分子克隆》(第3版)进行。
1.2 猪CD163基因编辑载体的构建
根据NCBI数据库中猪CD163基因的DNA序列(NC_010447.5)和mRNA序列(NM_213976.1),在CD163基因的第7外显子上设计2条sgRNA(表1中下划线部分的序列),2条sgRNA的正义链和反义链(表1)分别由生工生物工程(上海)股份有限公司合成。

表1 猪CD163基因的sgRNA合成序列Table1 sgRNA sequence of porcine CD163 gene
每条sgRNA的单链正义链和反义链退火后形成小的双链DNA分子,直接连接到经过BbsⅠ酶切的PX461载体上,构建完成同时表达1条sgRNA和Cas9切刻酶以及GFP的载体(PX461-C161和PX461-C185)。
以 PX461-C161为模板,sgRNA-F(GAGGG CCTATTTCCCATGATTCC)和 sgRNA-R(GGGGT ACCTCTAGAGCCATTTG)为引物,利用PCR扩增含有U6启动子的sgRNA-C161序列,并连接到pMD18-T载体上,再经过KpnⅠ酶切后获得两端含有KpnⅠ酶切位点的U6-sgRNA-C161序列,然后连接到经过KpnⅠ酶切的PX461-C185载体上,构建完成同时表达sgRNA C161、C185以及Cas9切刻酶和GFP的载体PX461-C185+C161。同时表达2条针对猪CD163基因的sgRNA和Cas9切刻酶以及GFP的载体构建过程如图1所示。
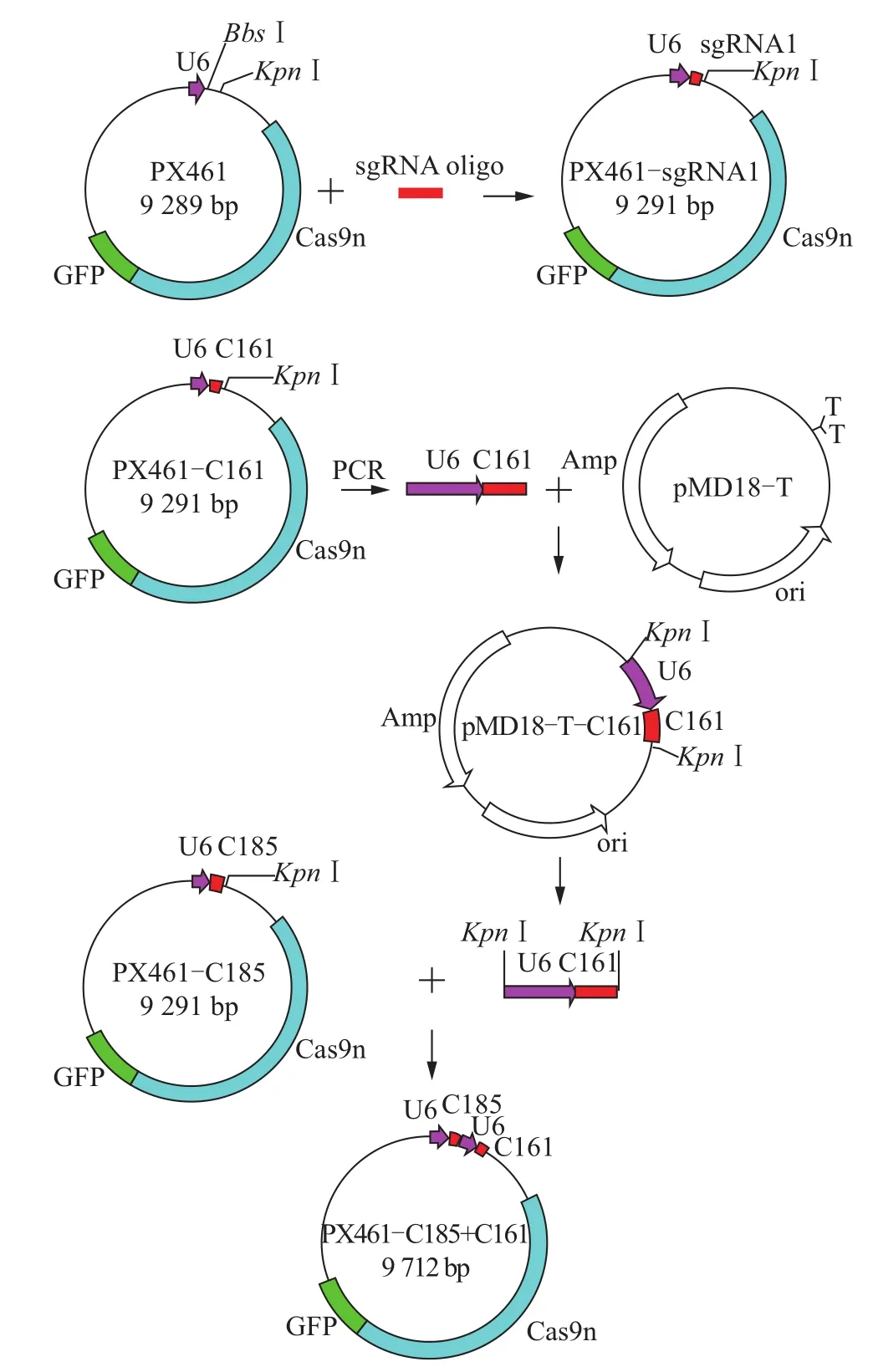
图1 猪CD163基因编辑载体的构建流程Fig.1 Construction process of porcine CD163 gene edit vector
1.3 猪胎儿成纤维细胞的转染及基因编辑细胞克隆点的筛选和鉴定
接种猪胎儿成纤维细胞于6孔细胞培养板中,在含有15%胎牛血清的DMEM(Dulbecco’s modified eagle medium)培养基中培养至50%~70%汇合度时,按照说明书要求,用Lipofectamine 2000脂质体将PX461-C185+C161载体转入细胞中。
转染后的细胞在37℃培养箱中培养48 h,经0.1%胰酶消化后,用流式细胞仪分选出表达GFP的阳性细胞,在含有15%胎牛血清的DMEM培养基中培养9~12 d至长出明显的单细胞克隆点。
将生长状态良好的单细胞克隆点细胞用0.1%胰酶消化后转接到48孔细胞培养板中,待细胞长满需要传代时,取1/10的细胞裂解后作为模板进行PCR,用于鉴定分析CD163基因的编辑情况;剩余细胞接种到24孔细胞培养板中继续培养至长满,然后冻存到液氮中。用来鉴定细胞克隆点CD163基因编辑情况的引物如表2所示。
由于用来分析鉴定的细胞数比较少,所以细胞裂解物先用CD163-39F和CD163-527R引物进行PCR,没有扩增出特异性条带的细胞裂解物再分别用dEX7-Fb/Rb和dEX7-Fs/Rs 2对引物进行巢式PCR。PCR产物切胶回收后,连接到pMD18-T载体上,挑选10个阳性菌落测序。将测序获得的序列与NCBI数据库中对应的猪CD163基因序列进行比对,获得CD163双等位基因都进行了编辑的细胞克隆点。
1.4 CD163基因编辑克隆猪的生产和鉴定
以CD163双等位基因编辑的细胞为供体细胞进行体细胞核移植,选用发情良好、体型较好的母猪为受体,将重构1 d后的胚胎移植到自然发情后1 d的母猪输卵管中,每头受体母猪移植150~240枚。胚胎移植28~30 d后,利用超声波检测妊娠情况,妊娠母猪30 d后每月检测一次,跟踪胎儿发育情况,调整饲养管理,直至基因编辑克隆猪出生。取克隆猪的耳组织提取基因组DNA,用dEX7-Fs/Rs引物进行PCR,扩增产物经切胶回收后,连接到pMD18-T载体上,挑选10个阳性菌落测序。将测序获得的序列与NCBI数据库中对应的猪CD163基因序列进行比对,记录CD163基因的编辑情况。
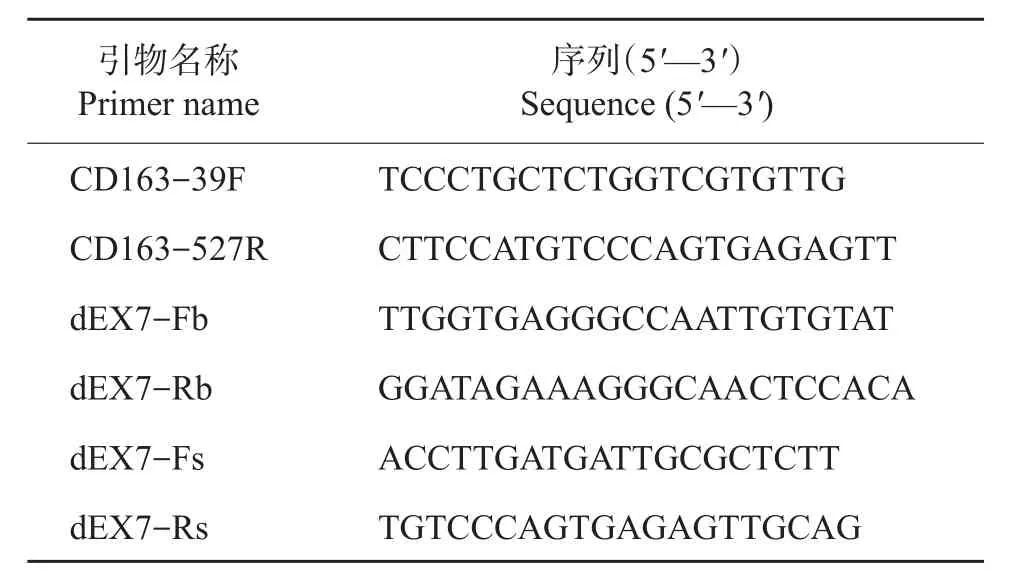
表2 猪CD163基因编辑鉴定引物Table2 Primersfor porcine CD163 geneedit identification
2 结果与分析
2.1 猪CD163基因编辑载体的构建分析
为了方便细胞转染和保证Cas9切刻酶与2条sgRNA的共表达,本研究构建了在同一载体中同时表达2条sgRNA和Cas9切刻酶以及绿色荧光蛋白GFP的质粒PX461-C185+C161,经过测序确定了该载体上包含完整的Cas9切刻酶、绿色荧光蛋白GFP的表达序列、U6启动子和2条sgRNA的表达序列(图1)。
2.2 猪CD163基因编辑细胞克隆点的筛选和鉴定
猪胎儿成纤维细胞转染PX461-C185+C161载体后,经过流式细胞仪的分选和单细胞克隆点的培养,共获得20个细胞克隆点。经鉴定,其中2个细胞克隆点为CD163单等位基因编辑的细胞,16个细胞克隆点为CD163双等位基因编辑的细胞,基因编辑效率达90%。
2.3 CD163基因编辑克隆猪的生产和鉴定结果
取6个细胞克隆点的细胞作为供体细胞进行体细胞克隆,最终获得2头存活的克隆猪,经过PCR和DNA测序鉴定,这2头克隆猪均为CD163基因编辑克隆猪(图2),其CD163基因编辑情况如表3所示。

图2 CD163基因编辑克隆猪Fig.2 CD163 gene-edited cloned pigs

表3 CD163基因编辑克隆猪的基因型Table3 Genotypes of CD163 gene-edited pigs
3 讨论
据估计,我国养猪业每年由疾病造成的经济损失占总成本的35%~50%,其中蓝耳病对养猪业的危害居首位。蓝耳病的感染率占我国生猪饲养量的40%~50%,母猪流产率8%~10%,死亡率通常为10%~15%。目前针对蓝耳病没有好的特效药物,虽然疫苗的使用具有一定的预防效果,但对此类重大的病毒性传染病的控制尚未取得实质性突破,而且随着免疫压力和致病毒株的变异,反而使此类疾病的防控变得越来越复杂。从长远来看,利用基因工程手段获得从遗传本质上抗蓝耳病的猪是防控蓝耳病最为有效的方法。培育抗蓝耳病的新品种猪,不仅是我国养猪产业的重大需求,也是全世界养猪业的需求,更将提升我国养猪业在抗病育种领域的国际地位。
近几年,美欧科学家利用CRISPR/Cas9技术分别实现了对猪CD163基因的编辑,获得的CD163基因编辑猪能够正常存活且不会感染蓝耳病[4-5]。然而,基于CRISPR/Cas9系统的基因编辑技术存在较高的脱靶效应。为了减少脱靶效应,本研究应用的基因编辑技术是基于CRISPR/Cas9内切酶系统改进后的CRISPR/Cas9切刻酶系统,其优点在于CRISPR/Cas9切刻酶系统通过2条sgRNA靶定目的基因,提高了基因编辑的特异性;同时,Cas9切刻酶的存在降低了对非目的基因进行编辑的可能性[12-13]。利用CRISPR/Cas9n系统结合体细胞核移植技术获得的CD163基因编辑猪,除了CD163基因被编辑外不会引入其他任何外源基因,也不会对基因组上非CD163基因的区域进行非特异的编辑,遗传背景干净清晰,极大地减少了后期转基因安全评估工作。
此外,之前由于传统的基因打靶策略效率极低,且猪中没有可用的胚胎干细胞系,所以对猪的功能基因研究一直没有实质性突破。基于CRISPR/Cas9系统的基因编辑技术彻底解决了上述问题,使猪的功能基因研究不再那么困难,为人们研究猪的功能基因提供了可行的方法。
4 结论
本研究利用基于CRISPR/Cas9n系统的基因编辑技术结合体细胞核移植技术,成功获得了2头正常存活的CD163基因编辑克隆猪,为培育抗蓝耳病的新品种猪提供了一种可行的方法。
参考文献(References):
[1] 杨汉春.猪繁殖与呼吸综合征防控中的问题与对策.北方牧业,2014(24):16-17.
YANG H C.Problems and countermeasures in the prevention and control of pig breeding and respiratory syndrome.Beifang Muye,2014(24):16-17.(in Chinese)
[2]CALVERT JG,SLADE D E,SHIELDS S L,et al.CD163 expression confers susceptibility to porcine reproductive and respiratory syndrome viruses.Journal of Virology,2007,81(14):7371-7379.
[3]WHITWORTH K M,LEE K,BENNE JA,et al.Use of the CRISPR/Cas9 system to produce genetically engineered pigs from in vitro-derived oocytes and embryos.Biology of Reproduction,2014,91(3):78.
[4]WHITWORTH K M,ROWLAND R R R,EWEN C L,et al.Gene-edited pigs are protected from porcine reproductive and respiratory syndrome virus.Nature Biotechnology,2015,34(1):20-22.
[5]BURKARD C,LILLICO S G,REID E,et al.Precision engineering for PRRSV resistance in pigs:Macrophages from genome edited pigs lacking CD163 SRCR5 domain are fully resistant to both PRRSV genotypes while maintaining biological function.PLoSPathogens,2017,13(2):e1006206.
[6] HAI T,TENG F,GUO R F,et al.One-step generation of knockout pigs by zygote injection of CRISPR/Cas system.Cell Research,2014,24(3):372-375.
[7] ZHOU X Q,XIN J G,FAN N N,et al.Generation of CRISPR/Cas9-mediated gene-targeted pigs via somatic cell nuclear transfer.Cellular and Molecular Life Sciences,2015,72(6):1175-1184.
[8] RUAN JX,LIH G,XU K,et al.Highly efficient CRISPR/Cas9-mediated transgene knockin at the H11 locus in pigs.Scientific Reports,2015,5:14253.
[9]WANG X L,ZHOU J W,CAO C W,et al.Efficient CRISPR/Cas9-mediated biallelic gene disruption and sitespecific knockin after rapid selection of highly active sgRNAsin pigs.Scientific Reports,2015,5:13348.
[10]NIU D,WEI H J,LIN L,et al.Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9.Science,2017,357(6357):1303-1307.
[11]NI W,QIAO J,HU S W,et al.Efficient gene knockout in goats using CRISPR/Cas9 system.PLoS One,2014,9(9):e106718.
[12]RAN F A,HSU P D,LIN C Y,et al.Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity.Cell,2013,154(6):1380-1389.
[13]SHEN B,ZHANG W S,ZHANG J,et al.Efficient genome modification by CRISPR-Cas9 nickase with minimal offtarget effects.Nature Methods,2014,11(4):399-402.
