亮氨酸对早期断奶仔猪肝中内质网应激的影响
2018-05-11樊启文陈伶俐赵丽石敏晏向华
樊启文,陈伶俐,赵丽,石敏,晏向华*1
(1.华中农业大学动物科技学院/农业微生物学国家重点实验室,武汉430070;2.生猪健康养殖湖北省协同创新中心,武汉430070;3.生猪精准饲养与饲料安全技术湖北省工程实验室,武汉430070)
内质网是细胞内分泌蛋白和跨膜蛋白折叠和成熟的主要场所,它对蛋白质的加工过程依赖其内腔中的多种蛋白酶[1]。当流入内质网内腔中的未折叠或错误折叠蛋白超过其自身处理能力而出现大量积累时,会导致内质网应激发生。未折叠蛋白反应(unfolded protein response,UPR)是细胞内应对内质网应激的关键性细胞信号通路,主要通过减少内质网腔中蛋白质的流入及增强内质网的处理能力,从而维持内质网功能的稳定[1]。当内质网功能障碍不能通过调节恢复时,UPR也能够启动细胞凋亡程序以保证机体免受未折叠或错误折叠蛋白的侵害[2-3]。
UPR能够介导位于内质网膜上的3种内质网应激感受器的激活,包括:活化转录因子6(activating transcription factor-6,ATF6),双链RNA活化蛋白激酶样内质网激酶(protein kinase RNA-like ER kinase,PERK)和肌醇依赖性内质网至细胞核信号激酶1(inositol-requiring ER-to-nucleus signal kinase-1,IRE1)[4-6]。作为一种Ⅱ型跨膜蛋白,ATF6能够被蛋白水解酶激活形成一种可溶性的转录因子,并转位至细胞核中发挥作用[7]。PERK蛋白能够感受内质网腔中的折叠压力,并促进ATF4蛋白的表达[8]。X盒结合蛋白1(X box binding protein 1,XBP1)是一种转录因子,能够被ATF6和IRE1激活,其中ATF6能够促进XBP1基因的表达,而IRE1则参与XBP1 mRNA的剪切,从而表达出具有活性的转录因子[9]。ATF4、ATF6和XBP1都是碱性亮氨酸拉链(basic leucine zipper,bZIP)转录因子,能够直接与内质网应激效应元件(ER stress response element,ERSE)结合,激活UPR靶基因的转录[7,9]。
研究发现,激素和细胞因子的释放、能量状态的改变等都能够改变内质网中蛋白质的通量,从而导致内质网应激的发生[10]。仔猪早期断奶是在猪生产过程中最常见的诱导应激发生的事件之一。仔猪在早期断奶过程中,食物状态的快速转变会引发仔猪严重的饥饿应激。研究表明,早期断奶能够使仔猪肠道消化吸收及黏膜屏障功能受损,同时降低肠道消化酶的活性,引起肠道消化吸收功能的减弱和仔猪营养缺乏[11-12],而由营养饥饿引发的蛋白质代谢的改变可能直接影响到内质网的结构与功能。
多项研究显示,在断奶仔猪日粮中补充特定的氨基酸能够减缓由断奶刺激引发的器官损伤[13-15]。其中,在日粮中添加精氨酸能够促进肠黏膜微血管的发育[16],促进β-防御素基因和血管内皮生长因子的表达[13,17]。而作为一种重要的支链氨基酸,亮氨酸能参与蛋白质生物合成、胰岛素信号传导、骨骼肌的能量调节等过程。此外,在肝中亮氨酸对糖脂代谢具有重要的调节作用[18],并且肝作为机体内蛋白质代谢最旺盛的器官,亮氨酸也能影响其蛋白质的合成,从而影响肝中内质网的功能[19-20]。因此,本试验通过给断奶仔猪饲喂不同含量的亮氨酸日粮以研究亮氨酸对早期断奶引起的肝内质网应激的影响,为仔猪的早期营养调控提供基础资料。
1 材料与方法
1.1 试验材料
动物试验选用的断奶仔猪为华中农业大学国家家畜工程技术中心精品猪场健康仔猪,品种为长×大二元仔猪;所有动物试验的操作均经过华中农业大学动物中心伦理委员会批准。
细胞试验中使用的人肝癌细胞系(human hepatocarcinoma cell,HepG2)由华中农业大学生命科学学院杨在清老师馈赠;细胞试验所用基础培养基(DMEM)、无葡萄糖培养基(glucose-free DMEM)、胎牛血清(fetal bovine serum,FBS)、Earle平衡盐缓冲液(Earle’s balanced salt solution,EBSS)和青霉素-链霉素(penicillin-streptomycin)均购于美国Gibco公司;低葡萄糖基础培养基(low glucose DMEM)和氨基酸缺失培养基(amino acid-free RPMI-1640)购于美国Sigma公司;免疫印迹试验中的XBP1、ATF4、ATF6、HDAC1和β-actin抗体均购于美国Santa Cruz公司,所用二抗购于美国Sigma公司;核质分离试验所用试剂盒购于美国Thermo Fisher科技公司。
1.2 动物试验设计
试验Ⅰ:选取18头体质量接近的阉割仔猪,随机平均分为2组,每组9头,分别为对照组和断奶组。对照组仔猪为哺乳仔猪;断奶组仔猪在14日龄进行断奶,并补充仔猪教槽料,同时试验期间保持自由采食和饮水。于仔猪15日龄和16日龄时,分别从2组中随机各选取3头进行屠宰取样。
试验Ⅱ:选取48头体质量接近的14日龄阉割仔猪,随机平均分为2组,每组3个重复,每个重复8头,分别为对照组和高亮氨酸组。仔猪由14日龄开始进行诱饲,对照组仔猪饲喂基础日粮,日粮亮氨酸含量为1.66%;高亮氨酸组在基础日粮中额外添加0.44%的亮氨酸。日粮组成和营养成分见表1。在21日龄时从2组中各选取3头仔猪进行屠宰取样,剩余仔猪进行断奶处理;断奶后,在22日龄时再从2组中各选取3头仔猪进行屠宰取样。
2次试验均采集仔猪肝组织样品,其中部分样品剪成1 mm×1 mm×1 mm的小块后于2.5%戊二醛中固定;其余样品剪成小块以锡箔纸包裹,于液氮中速冻后放入-80℃冰箱中保存。
1.3 细胞试验处理
1.3.1 营养缺失处理试验
试验前,将HepG2细胞培养于正常完全培养基中,待细胞生长至密度为80%时,将完全培养基分别更换为以下培养基:正常新鲜完全培养基(CK)、含0.75μg/mL衣霉素(内质网应激的诱导剂,作为阳性对照)的完全培养基(tunicamycin,TUN)、完全饥饿培养基(EBSS)、低糖培养基(low glucose,LG)、无糖培养基(no glucose,-G)、无亮氨酸培养基(no leucine,-LEU)和无氨基酸培养基(no amino acid,-AA),处理1 h后收集细胞样品。

表1 基础饲粮组成及营养水平Table1 Composition and nutrient level of basal diets
1.3.2 亮氨酸缺失与再补加试验
亮氨酸缺失处理与营养缺失处理相同,但亮氨酸缺失处理时间分别设置为0、0.5、1、2和4 h,处理完成后统一收集细胞样品。
亮氨酸的再补加试验是在亮氨酸缺失1 h后,向培养基中补加亮氨酸,使培养基中亮氨酸的终浓度分别为1和10 mmol/L。CK为对照组,在TUN组中加入0.75μg/mL衣霉素。
1.4 试验方法
1.4.1 仔猪肝组织的电镜检测
采集肝样品时,保持采集位置的一致性,将所采集的样品用2.5%戊二醛固定2 h后,使用1%锇酸固定液再固定2~3 h;之后通过梯度脱水程序,在37℃条件下,使用Epon包埋2~3 h,并制作超薄切片;最后用3%醋酸铀-枸橼酸铅双染色后在透射电镜下进行观察。
1.4.2 肝组织和细胞样品的核质分离
肝组织和HepG2细胞的核质分离试验均使用美国Thermo Fisher科技公司的核质分离试剂盒完成,相关分离操作依照试剂盒说明书进行。取肝组织研磨成粉末和细胞沉淀,使用预冷的磷酸盐缓冲液洗涤3次,每次洗涤后均于4℃、1 000 r/min下离心5 min。将收集到的沉淀重悬于预冷的细胞质提取试剂CERⅠ溶液(使用前加入1μg/mL亮抑酶肽,1μg/mL胃蛋白酶抑制剂,1μg/mL抑肽酶和50μg/mL苯甲基磺酰氟)中,并按比例加入CERⅡ溶液。经过4℃、1.6万r/min离心5 min后,收集到的上清液即为细胞质蛋白组分。随后,沉淀用细胞核提取试剂NER溶液(使用前加入蛋白酶抑制剂)重悬,冰上裂解10 min后涡旋5 s。将裂解和涡旋操作重复4次后,经过4℃、1.6万r/min离心10 min,所得上清液即为细胞核蛋白组分。
1.4.3 蛋白质样品的免疫印迹检测分析
将肝组织和HepG2细胞中提取的蛋白质样品用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)进行分离。然后将蛋白质电转移到聚偏二氟乙烯(polyvinylidenedifluoride,PVDF)膜上,并将电转后的PVDF膜置于5%脱脂奶粉[溶于含0.1%Tween 20的三乙醇胺缓冲盐溶液(tris-buffered saline with Tween 20,TBST)]中室温封闭1 h。之后,将PVDF膜置入用TBST稀释适当浓度的一抗中4℃过夜孵育。第2天,经TBST洗涤后,将PVDF膜置入用TBST稀释适当浓度的二抗中室温孵育1 h。显影后的结果使用Image J软件进行定量分析。
1.5 统计分析
所有试验数据均进行至少3次独立重复试验。采用Graphpad prism 5软件的学生t检验对数据进行处理,并采用双尾t检验进行分析。试验数据以“平均值±标准差”表示,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 仔猪的早期断奶应激诱发肝内质网应激
内质网的形态结构与其功能高度相关。电镜图像(图1A)显示:在正常条件下,仔猪肝组织细胞内粗面内质网口径狭窄,平滑折叠的环绕于线粒体;而在断奶后24 h,内质网口径出现显著扩张,且内质网明显增多;随着断奶时间的延长,在断奶后48 h,内质网大量增生并且折叠结构混乱。为进一步分析早期断奶是否影响肝内质网应激反应,我们对内质网应激的标志性蛋白XBP1[21]在细胞核中的含量进行了检测。结果(图1B)显示:断奶后24 h,仔猪肝组织中细胞核内XBP1蛋白含量显著上调;而断奶后48 h,细胞核内XBP1的表达水平未见显著变化。这些结果表明,早期断奶能够诱导仔猪肝内质网应激的发生,但这种诱导作用存在一定的时限。
2.2 不同营养缺失处理对Hep G2细胞内质网应激的影响
由于仔猪的消化系统发育不完全,营养饥饿往往是早期断奶过程的主要刺激因素之一[22-23]。同时,营养不足也被认为是内质网应激发生的一个诱导因素,其中葡萄糖缺失已被证实能够诱导内质网应激发生,并且多个葡萄糖调节蛋白(glucose regulated protein,GRP)是参与UPR反应的关键蛋白,如GRP78[24]。体外肝细胞(HepG2)试验的结果(图2)表明:低葡萄糖和葡萄糖缺失处理均能显著上调细胞核内的ATF4和ATF6α的表达(P<0.05);同时,EBSS处理和亮氨酸的缺失也能够诱导细胞核内的ATF6α显著上调表达(P<0.05);此外,1 h氨基酸饥饿处理未能显著改变内质网应激相关蛋白的表达水平,这一结果与亮氨酸的缺失对ATF6α的上调表达相反,暗示单一亮氨酸的缺失对HepG2中内质网应激的发生更具有诱导效应。然而,在所有处理条件下的XBP1均呈现差异表达,这提示我们XBP1表达在内质网应激发生过程中具有滞后性。上述结果表明,营养物质缺失能够诱导肝细胞内质网应激的发生,而亮氨酸的缺失能够诱导HepG2中内质网应激的发生。
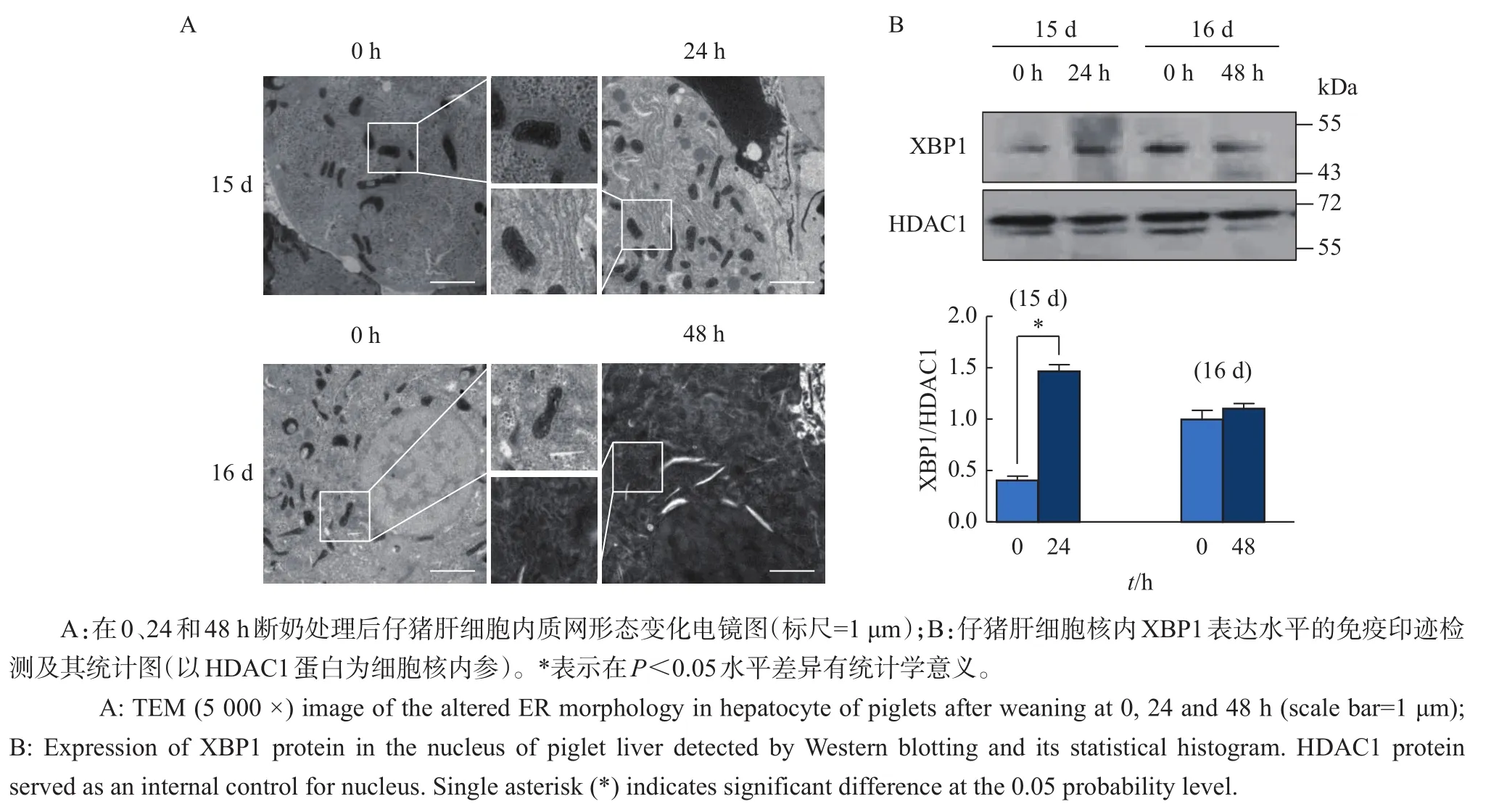
图1 早期断奶对仔猪肝组织内质网形态及XBP1蛋白表达的影响Fig.1 Effects of early weaning on morphology of endoplasmic reticulum(ER)and expression of XBP1 protein in the liver of piglets

图2 在不同营养物质缺失处理下Hep G2细胞内ATF6α、ATF4和XBP1在细胞质和细胞核内的丰度变化Fig.2 Abundance changes of ATF6α,ATF4 and XBP1 in the cytoplasm and nucleus of HepG2 cells under different nutrient deficiency levels
2.3 亮氨酸对Hep G2细胞中内质网应激的调节
为了探究亮氨酸对内质网应激的影响,将HepG2细胞培养于亮氨酸缺失的培养基中,结果如图3所示。与对照组相比,亮氨酸缺失0.5、1和2 h均能够显著上调细胞质中ATF6α的表达(P<0.05),而细胞核内的ATF4和ATF6α在亮氨酸缺失1 h处理条件下均呈现显著上调表达(P<0.05)。同时,亮氨酸的再补加试验显示,添加1和10 mmol/L亮氨酸均能显著上调细胞核内ATF4的表达(P<0.05)。上述结果表明,亮氨酸缺失能够诱导HepG2细胞中内质网应激,而1和10 mmol/L亮氨酸的加入加重了内质网的应激状态。
2.4 不同亮氨酸水平对早期断奶应激诱发的仔猪肝内质网应激的影响
如图4所示:在未断奶条件下,饲用高水平亮氨酸日粮并不影响仔猪肝中ATF4和ATF6α的表达;断奶处理24 h后,仔猪肝组织细胞核内ATF4和ATF6α均呈显著性上调表达(P<0.05)。这一结果表明亮氨酸能够增强早期断奶诱发的仔猪肝内质网应激。
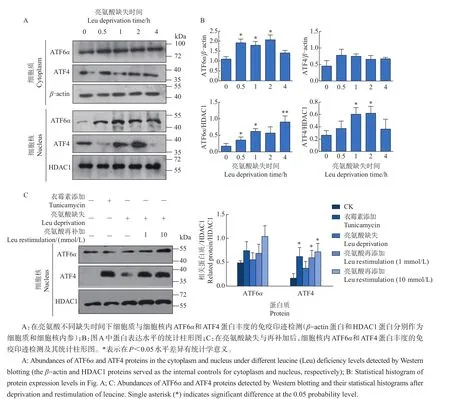
图3 亮氨酸缺失及再补加对Hep G2细胞中ATF6α和ATF4蛋白表达的影响Fig.3 Effectsof leucinedeprivation and restimulation on expression of ATF6αand ATF4 proteinsin HepG2 cells

图4 不同亮氨酸水平对断奶仔猪肝内质网应激相关蛋白表达的影响Fig.4 Effects of different leucine(Leu)levels on expression of ERstress-associated proteins in the liver of weaning piglets
3 讨论
仔猪的早期断奶应激是仔猪经受的最严重的应激事件之一,在早期断奶过程中仔猪的采食量及生长速率都呈现显著下调[22]。为了应对断奶过程中产生的各种刺激,仔猪往往通过调整其自身体内的能量供给状态以度过这一应激过程,这种调整通常包括增加血液供给、加强能量生成、改变免疫以及炎症反应等[25]。这样的过程也伴随着蛋白质合成速率的改变,进而影响了内质网的功能。当来自细胞内或细胞外的刺激诱导内质网应激发生时,细胞通过UPR反应减弱刺激从而维持细胞代谢的稳态[26]。本研究显示,仔猪在断奶24 h后,其肝组织内肝细胞中的内质网口径显著增加且形态出现紊乱,并且核内的XBP1表达呈现显著上调,表明早期断奶能够诱导肝组织内质网应激的发生。
仔猪在早期断奶过程的所有刺激中,营养水平是其中非常重要的一个因素。研究显示,早期断奶能够损害仔猪的肠道黏膜功能,影响营养物质的消化吸收[23]。而营养物质的缺失也同样是内质网应激发生的诱导因素之一[26]。在体外肝细胞中的模拟试验表明,葡萄糖以及亮氨酸的缺失能够显著上调细胞核内ATF4和剪切后ATF6α的表达。这一结果显示,葡萄糖、氨基酸(尤其是亮氨酸)等营养的饥饿处理能够诱导肝细胞中内质网应激的发生。
有报道指出,葡萄糖的缺失能够通过氨基己糖通路诱导内质网应激的发生,从而激活UPR通路及CHOP介导的细胞凋亡通路[27]。在小鼠肝中,亮氨酸能够抑制过度发生的内质网应激及自噬[28]。此外,精氨酸的缺失能够促进ATF4的翻译,增强UPR反应[29]。在本研究中,亮氨酸缺失能够显著上调肝细胞核内ATF4和ATF6α剪切体蛋白的表达,表明亮氨酸可以独立诱导肝细胞中内质网应激的发生。然而,当在亮氨酸缺失培养基中补加1 mmol/L或者10 mmol/L亮氨酸时,细胞核内ATF4的表达也呈现显著性上调。此外,不同亮氨酸含量的日粮对于正常21日龄仔猪肝内质网应激无显著影响;但是在仔猪断奶24 h后,用高水平亮氨酸日粮饲喂的仔猪肝组织中肝细胞核内定位的ATF4出现显著上调。这与HepG2细胞试验中亮氨酸过量再补加的结果相似,推测这一现象可能与氨基酸的代谢功能相关。
内质网应激发生后,内质网激酶PERK的激活能够增加eIF2α的磷酸化水平从而抑制蛋白质的合成[30-32]。然而,氨基酸作为一种营养信号,能够直接刺激蛋白质的合成,亮氨酸的作用尤其明显[33]。作为一种支链氨基酸,亮氨酸能够通过与其感受体结合,强烈地刺激体内雷帕霉素靶蛋白复合体1(mechanistictargetof rapamycincomplex1,mTORC1)信号通路的激活,进而促进蛋白质的合成[34-35]。同时,早期断奶能够诱导仔猪肝、脾和骨骼肌中自噬的发生[36]。自噬对幼年动物具有重要的维持生存作用,而亮氨酸是细胞自噬的抑制剂。研究证明,内质网应激发生后能够依赖于IRE1-JNK通路激活自噬,并利用其降解再循环的功能维持细胞的稳态[37]。而KOUROKU等[38]发现,异常表达的多聚谷氨酰胺72能诱导细胞内质网应激的发生,并伴随着细胞中PERK/eIF2α磷酸化介导的LC3-Ⅰ向LC3-Ⅱ转变。有观点认为,细胞自噬对蛋白质的降解作用有助于减缓内质网的蛋白质处理压力,帮助内质网恢复稳态。因此,亮氨酸的促蛋白质合成功能及其对自噬的抑制作用可能加剧了细胞内的内质网应激和UPR反应,使得核内的ATF4呈现上调表达。此外,在动物生长的早期阶段,氨基酸能够参与调节多个重要的代谢过程,包括生长、稳态、免疫、食物的摄取与利用及蛋白质的合成等[39-41]。而研究显示,在日粮中添加1%、2%和4%亮氨酸并不能显著提高早期断奶仔猪的日增质量和采食量,在日粮中6%的亮氨酸添加量甚至会显著抑制仔猪的生长[42]。这一现象出现的原因可能是日粮中高水平的亮氨酸损害了机体的氨基酸的平衡[41]。然而B’CHIR等[43]报道指出,随着亮氨酸水平的不断上升,全细胞水平的ATF4表达量不断下调。因此,亮氨酸对于仔猪肝内质网应激具有重要的调节功能,但其调节机制仍有待阐明。
4 结论
本研究表明,早期断奶能够诱导仔猪肝中内质网应激的发生,而亮氨酸对内质网应激具有重要的调控功能,无论是亮氨酸的缺失还是过量都会引起肝细胞内质网应激的发生。因此,筛选出适宜的亮氨酸浓度对于减缓仔猪断奶后的应激状态具有十分重要的意义。
参考文献(References):
[1] RON D,WALTER P.Signal integration in the endoplasmic reticulum unfolded protein response.Nature Reviews Molecular Cell Biology,2007,8(7):519-529.
[2]XU C Y,BAILLY-MAITRE B,REED J C.Endoplasmic reticulum stress:Cell life and death decisions.The Journal of Clinical Investigation,2005,115(10):2656-2664.
[3]SCHRÖDER M,KAUFMAN R J.ER stress and the unfolded protein response.Mutation Research,2005,569(1/2):29-63.
[4] WALTER P,RON D.The unfolded protein response:From stress pathway to homeostatic regulation.Science,2011,334(6059):1081-1086.
[5]VAN GALEN P,KRESO A,MBONG N,et al.The unfolded protein response governs integrity of the haematopoietic stem-cell pool during stress.Nature,2014,510(7504):268-272.
[6] WAN S,JIANG L.Endoplasmic reticulum(ER)stress and the unfolded protein response(UPR)in plants.Protoplasma,2016,253(3):753-764.
[7]VAN VLIET A R,GIORDANO F,GERLO S,et al.The ER stresssensor PERK coordinates ER-plasma membrane contact site formation through interaction with filamin-A and F-actin remodeling.Molecular Cell,2017,65(5):885-899.e6.
[8]HARDING H P,NOVOA I,ZHANG Y H,et al.Regulated translation initiation controls stress-induced gene expression in mammalian cells.Molecular Cell,2000,6(5):1099-1108.
[9]YOSHIDA H,MATSUI T,YAMAMOTO A,et al.XBP1 mRNA is induced by ATF6 and spliced by IRE1 in response to ER stress to produce a highly active transcription factor.Cell,2001,107(7):881-891.
[10]ZHANG K,KAUFMAN R J.From endoplasmic-reticulum stress to the inflammatory response.Nature,2008,454(7203):455-462.
[11]WIJTTEN PJA,VERSTIJNEN JJ,VAN KEMPEN T A T G,et al.Lactulose as a marker of intestinal barrier function in pigs after weaning.Journal of Animal Science,2011,89(5):1347-1357.
[12]MOESER A J,RYAN K A,NIGHOT P K,et al.Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs.American Journal of Physiology:Gastrointestinal and Liver Physiology,2007,293(2):G413-G421.
[13]MAO X B,QI S,YU B,et al.Dietary l-arginine supplementation enhances porcineβ-defensins gene expression in sometissues of weaned pigs.Livestock Science,2012,148(1/2):103-108.
[14]REZAEI R,KNABE D A,TEKWE C D,et al.Dietary supplementation with monosodium glutamate is safe and improves growth performance in postweaning pigs.Amino Acids,2012,44(3):911-923.
[15]CORTAMIRA N O,SEVE B,LEBRETON Y,et al.Effect of dietary tryptophan on muscle,liver and whole-body protein synthesis in weaned piglets:Relationship to plasma insulin.The British Journal of Nutrition,1991,66(3):423-435.
[16]ZHAN Z F,OU D Y,PIAO X S,et al.Dietary arginine supplementation affects microvascular development in the small intestineof early-weaned pigs.The Journal of Nutrition,2008,138(7):1304-1309.
[17]YAO K,GUAN S,LI T J,et al.Dietary L-arginine supplementation enhances intestinal development and expression of vascular endothelial growth factor in weanling piglets.The British Journal of Nutrition,2011,105(5):703-709.
[18]SU Y,LAM T K,HE W,et al.Hypothalamic leucine metabolism regulates liver glucose production.Diabetes,2012,61:85-93.
[19]YIN Y L,YAO K,LIU Z J,et al.Supplementing L-leucine to a low-protein diet increases tissue protein synthesis in weanling pigs.Amino Acids,2010,39:1477-1486.
[20]LIFN,YINY L,TAN B,et al.Leucine nutrition in animals and humans:mTOR signaling and beyond.Amino Acids,2011,41:1185-1193.
[21]SAMALIA,FITZGERALD U,DEEGAN S,et al.Methods for monitoring endoplasmic reticulum stress and the unfolded protein response.International Journal of Cell Biology,2010,2010:830307.
[22]CAMPBELL J M,CRENSHAW J D,POLO J.The biological stress of early weaned piglets.Journal of Animal Science and Biotechnology,2013,4(1):19.
[23]SMITH F,CLARK J E,OVERMAN B L,et al.Early weaning stress impairs development of mucosal barrier function in the porcine intestine.American Journal of Physiology:Gastrointestinal and Liver Physiology,2010,298(3):G352-G363.
[24]KAUFMAN R J,SCHEUNER D,SCHRÖDER M,et al.The unfolded protein response in nutrient sensing and differentiation.Nature Reviews Molecular Cell Biology,2002,3(6):411-421.
[25]CHARMANDARI E,TSIGOS C,CHROUSOS G.Endocrinology of the stress response.Annual Review of Physiology,2005,67:259-284.
[26]RUTKOWSKID T,KAUFMAN RJ.A trip to the ER:Coping with stress.Trendsin Cell Biology,2004,14(1):20-28.
[27]HUBER A L,LEBEAU J,GUILLAUMOT P,et al.p58IPK-mediated attenuation of theproapoptotic PERK-CHOPpathway allows malignant progression upon low glucose.Molecular Cell,2013,49(6):1049-1059.
[28]YOKOTA S,ANDO M,AOYAMA S,et al.Leucine restores murine hepatic triglyceride accumulation induced by a lowprotein diet by suppressing autophagy and excessive endoplasmic reticulum stress.Amino Acids,2015,48(4):1013-1021.
[29]DEY S,BAIRD T D,ZHOU D,et al.Both transcriptional regulation and translational control of ATF4 are central to the integrated stress response.The Journal of Biological Chemistry,2010,285(43):33165-33174.
[30]BI M,NACZKI C,KORITZINSKY M,et al.ER stressregulated translation increases tolerance to extreme hypoxia and promotes tumor growth.The EMBO Journal,2005,24(19):3470-3481.
[31]BLAIS J D,FILIPENKO V,BI M,et al.Activating transcription factor 4 is translationally regulated by hypoxic stress.Molecular and Cellular Biology,2004,24(17):7469-7482.
[32]KOUMENIS C,NACZKI C,KORITZINSKY M,et al.Regulation of protein synthesis by hypoxia via activation of the endoplasmic reticulum kinase PERK and phosphorylation of the translation initiation factor eIF2alpha.Molecular and Cellular Biology,2002,22(21):7405-7416.
[33]ANTHONY J C,ANTHONY T G,KIMBALL S R,et al.Orally administered leucine stimulates protein synthesis in skeletal muscle of postabsorptive rats in association with increased eIF4F formation.The Journal of Nutrition,2000,130(2):139-145.
[34]WOLFSON R L,CHANTRANUPONG L,SAXTON R A,et al.Sestrin2 is a leucine sensor for the mTORC1 pathway.Science,2015,351(6268):43-48.
[35]KIM JS,RO SH,KIM M,et al.Sestrin2 inhibits mTORC1 through modulation of GATOR complexes.Scientific Reports,2015,5:9502.
[36]ZHANG S J,LI X,LI L,et al.Autophagy up-regulation by early weaning in the liver,spleen and skeletal muscle of piglets.The British Journal of Nutrition,2011,106(2):213-217.
[37]OGATA M,HINO S,SAITO A,et al.Autophagy is activated for cell survival after endoplasmic reticulum stress.Molecular and Cellular Biology,2006,26:9220-9231.
[38]KOUROKUY,FUJITAE,TANIDAI,et al.ERstress(PERK/eIF2alpha phosphorylation)mediates the polyglutamineinduced LC3 conversion,an essential step for autophagy formation.Cell Death and Differentiation,2007,14(2):230-239.
[39]WU G Y,COLLINS J K,PERKINS-VEAZIE P,et al.Dietary supplementation with watermelon pomace juice enhances arginine availability and ameliorates the metabolic syndrome in Zucker diabetic fatty rats.The Journal of Nutrition,2007,137(12):2680-2685.
[40]SUENAGA R,TOMONAGA S,YAMANE H,et al.Intracerebroventricular injection of L-arginine induces sedative and hypnotic effects under an acute stress in neonatal chicks.Amino Acids,2007,35(1):139-146.
[41]WU GY.Amino acids:Metabolism,functions,and nutrition.Amino Acids,2009,37(1):1-17.
[42]EDMONDS M S,BAKER D H.Amino acid excesses for young pigs:Effects of excess methionine,tryptophan,threonine or leucine.Journal of Animal Science,1987,64(6):1664-1671.
[43]B’CHIR W,MAURIN A C,CARRARO V,et al.The eIF2 alpha/ATF4 pathway is essential for stress-induced autophagy gene expression.Nucleic Acids Research,2013,41(16):7683-7699.
