卵泡刺激素剂量依赖性表达基因的筛选
2018-05-11刘甜陈晓宇朱志伟于福先黄菁贾若欣石放雄潘建治
刘甜,陈晓宇,朱志伟,于福先,黄菁,贾若欣,石放雄*,潘建治,3*
(1.南京农业大学动物科技学院,南京210095;2.浙江省农业科学院畜牧兽医研究所,杭州310021;3.浙江省农业科学院病毒学与生物技术研究所,杭州310021)
卵泡刺激素(follicle-stimulating hormone,FSH)是一种异源二聚体垂体糖蛋白,由与其他糖蛋白激素共同的α亚基和特定的β亚基组成[1]。FSH与其受体FSHR(FSH receptor)结合并激活细胞中靶基因的表达,不仅对动物卵泡的生长发育起决定性作用,还调控着整个母体的生殖功能。在畜牧生产上,FSH制品被广泛用于母畜的同期发情、超数排卵、发情诱导及卵巢疾病治疗等方面,因此,对其浓度剂量的把握显得极其重要。目前,国内FSH及其类似物制品即使在价格上占优势,但也未能完全替代进口制品,其深层次原因在于对品质的信赖度。除了原料来源、提炼纯化工艺、批次间质量稳定性等问题之外,更主要的是对FSH制品的生物学效价尚缺乏精确的测定和标注。
FSH生物活性的检测方法主要可分为体内检测法和体外检测法。最经典的体内检测法是由STEELMAN等建立的以hCG增敏的雌幼大鼠卵巢增重法[2]。该方法虽然能够较为真实地反映FSH在生物体内的生物学效应,但如果供试动物的规范性存在问题,评价的结果就会失去精确性,而且需要大量的试验动物和较长的检测时间,成本高,不便于在生产实践中对原料、中间体等实施多次检测。此外,同一种FSH制品在不同动物物种上的效价存在差异,从啮齿类动物上获得的评价结果不一定适用于家畜。当前,我国在养猪生产中正在积极推广同期发情、定时输精和批次化繁殖管理技术,FSH的需求量将会大幅度增加,因此,寻求其在猪上评价生物学效价的准确方法变得尤为迫切。体外检测法包括放射免疫测定法、免疫测定、酶联免疫吸附分析等,这类方法实质是对FSH蛋白含量进行测定,虽然能够快速简便地获得测定数据,但如果FSH蛋白本身存在部分失活的情况,就不能精确地推断出FSH制品真实的生物学活性。因此,有必要开发一种快速、简便、精确、低成本的新检测方法,供激素生产企业和用户进行FSH生物学效价的鉴定。
本研究运用转录组测序技术和荧光定量聚合酶链式反应(polymerase chain reation,PCR)技术,分析在FSH刺激下猪卵泡颗粒细胞中基因表达的变化规律,挖掘受FSH调控、表达差异显著的基因,最后筛选出与FSH浓度梯度呈线性相关的基因,为后续建立高效检测FSH及其类似物制品生物活性的方法奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 卵巢颗粒细胞
本试验分离卵巢颗粒细胞所需的猪卵巢来自浙江省海盐县屠宰场,清洗卵巢周围残留物装入消毒后的保温瓶,带回实验室,用注射器采集卵巢上直径为3~6 mm卵泡的内容物,去除卵母细胞后,收集卵泡颗粒细胞进行增殖培养。
1.1.2 主要试剂
FSH购自浙江省宁波市三生药业有限公司;透明质酸酶(2 mg/mL)、细胞冻存液(DMSO)和胰岛素购自美国Sigma公司;胰蛋白酶、胎牛血清、1×104U/mL青霉素和1×104μg/mL链霉素溶液均购自美国HyClone公司;DMEM(Dulbecco’smodified eaglemedium)培养基、Trizol试剂购自美国Invitrogen公司;反转录试剂盒(QuantScript RTKit)购自天根生化科技(北京)有限公司;SYBRGreen Master购自瑞士Roche公司;DNA分子质量标志物(Trans2K)购自全式金生物技术(北京)有限公司。转录组测序委托杭州联川生物技术股份有限公司进行。
1.2 试验方法
1.2.1 卵巢颗粒细胞的培养与处理
分离的初代猪卵泡颗粒细胞在DMEM培养基、直径10 cm培养皿、37℃、5%CO2、饱和湿度条件下培养,长满后用胰酶消化传代1~2次供用。试验前将细胞传到6孔板上,待颗粒细胞长到80%以上时,将用培养基稀释成不同浓度的FSH添加到6孔板中,继续培养一定时间后,收集细胞进行总RNA提取。
1.2.2 总RNA提取和cDNA合成
按照Trizol法提取RNA试剂盒说明书进行细胞总RNA的提取,经分光光度计检测RNA的质量和浓度后,保存于-70℃冰箱中备用。根据反转录试剂盒(QuantScript RTKit)说明书配制含等量总RNA的反应体系,将合成的cDNA保存于-20℃冰箱中。
1.2.3 转录组测序
将浓度为40 mIU/mL的FSH处理组和未处理组的细胞裂解液保存于Trizol试剂中,送往杭州联川生物技术股份有限公司进行测序,测序步骤简述如下。从样品中提取总RNA,经质量检测合格后,使用连接有Oligo(dT)的磁珠富集真核生物mRNA。经抽提的mRNA被片段化试剂随机打断成短片段,以片段化的mRNA为模板,用六碱基随机引物合成一链cDNA,随后加入缓冲液、dNTPs、核糖核酸酶(RNase)和DNA聚合酶Ⅰ进行二链cDNA合成。用AMPure XP磁珠纯化双链产物,利用T4 DNA聚合酶和Klenow DNA聚合酶活性将DNA的黏性末端修复为平末端,3'末端加碱基A并加接头,用AMPure XP磁珠进行片段选择,最后进行PCR扩增获得测序文库,文库质检合格后采用Illumina Hiseq 4000进行测序,测序读长为双端2×150 bp。
1.2.4 荧光定量聚合酶链式反应
根据转录组测序结果,筛选FSH显著上调的基因,在NCBI数据库中查找到相应的基因序列,根据引物设计原则,使用NCBI BLAST和Primer Premier 5.0软件设计引物。所有引物均由杭州擎科梓熙生物技术有限公司合成,引物序列信息见表1。
荧光定量PCR采用SYBR GreenⅠ法进行。通过对各待测基因片段PCR反应条件的预试优化,确定最佳退火温度。反应程序为:95℃预变性1 min;95 ℃变性30 s,56~60 ℃退火30 s,72 ℃延伸20 s,扩增40个循环。以GAPDH为内参基因,每个样品设置3次重复,利用荧光定量PCR仪分析在扩增过程中荧光信号值的变化,并获取各样品、各基因的CT值,采用 2-ΔΔCT法计算推定各基因的相对表达水平。
1.2.5 数据统计分析
运用SPSS 21.0软件对数据进行分析,结果以“平均值±标准差”表示,并通过独立样本t检验进行显著性分析,P<0.05表示差异有统计学意义。

表1 半定量PCR引物Table1 Primersused in semi-quantitative PCR
2 结果与分析
2.1 在FSH刺激下差异表达基因分析
将经40 mIU/mL FSH处理与未经FSH处理的颗粒细胞中基因表达转录组测序结果进行比较,通过R语言的Ballgown包对String Tie组装和定量完毕的基因进行差异分析。将同时满足以下2个条件的基因认为是差异显著表达的基因:1)P<0.05;2)差异倍数≥2或者差异倍数≤0.5。根据这2个条件,我们发现共有47个表达差异显著的基因,其中37个为上调基因,10个为下调基因(图1)。在37个上调基因中,除8个新基因在NCBI上找不到基因序列外,其他上调基因如表2所示。
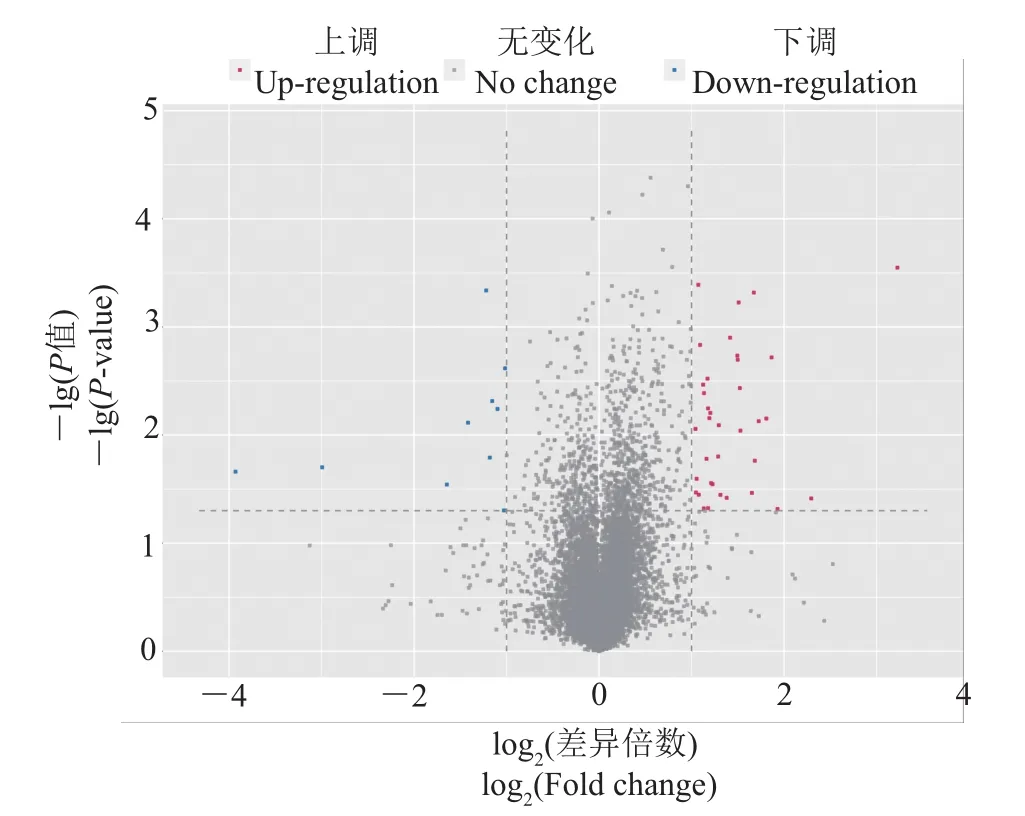
图1 基因分布火山图Fig.1 Volcano plotsof genedistribution
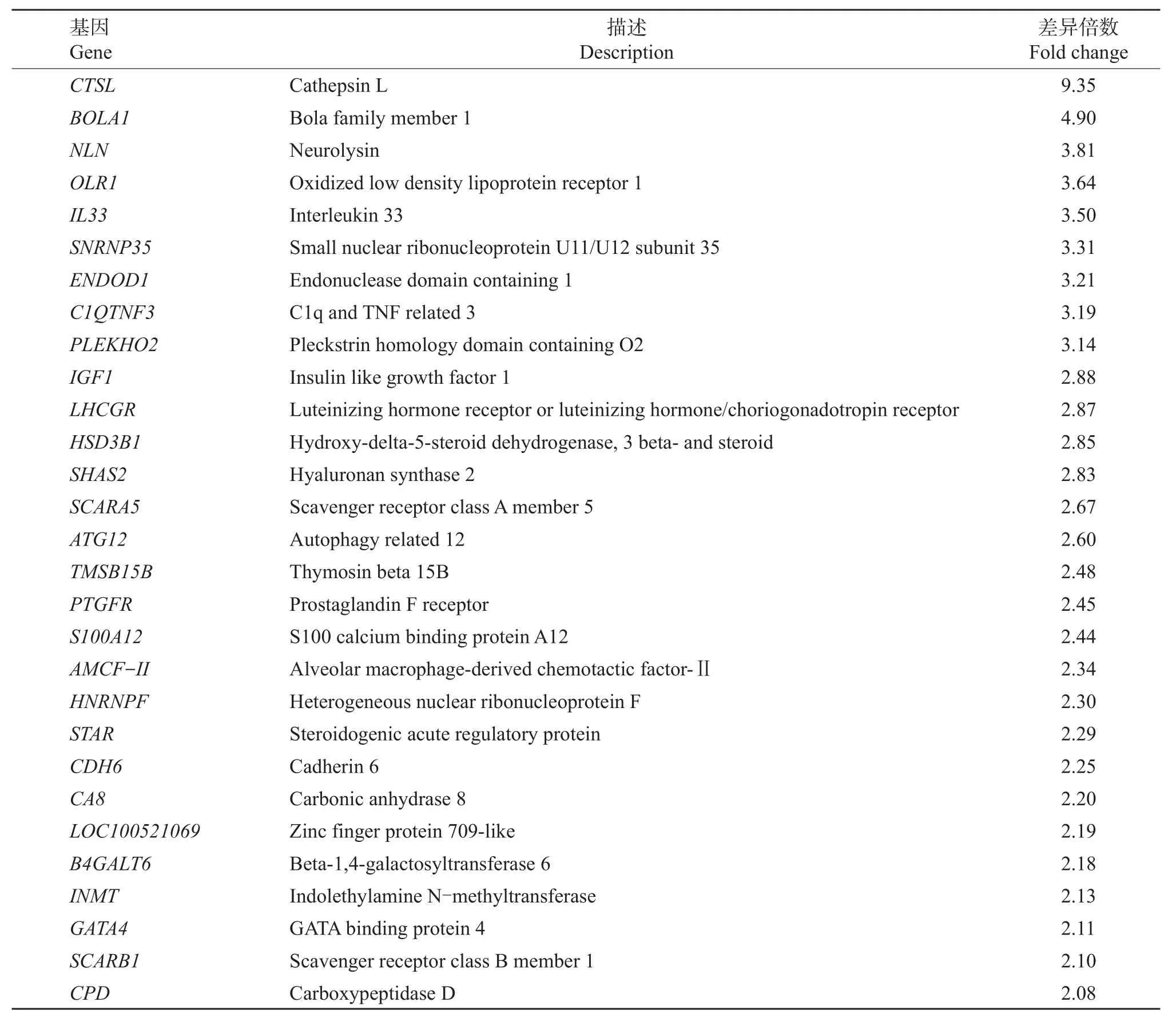
表2 在颗粒细胞中经FSH处理后上调的基因Table2 Up-regulated genesin FSH-treated granulosacells
2.2 差异基因GO富集分析
基因本体(gene ontology,GO)富集分析是一个国际化标准的基因功能分类系统,主要用于描述生物体内基因及其产物的特征。使用GO富集分析,可将基因分类到细胞因子、cAMP反应、类固醇生物合成过程等生物过程(biological process),类固醇δ-异构酶活性、甾体转运蛋白活性、载脂蛋白结合等分子功能(molecular function)和各种细胞组分(cellular component)。图2是GO功能分析所获得的散点图,图中列出了表达量差异显著基因参与的前20个基因功能,其中富集系数表示差异基因个数与总基因数的比值,富集系数越大,表示GO富集程度越高。从中可以看出,差异基因主要富集在参与生物过程的基因类群,尤其是类固醇转运和合成的生物过程。
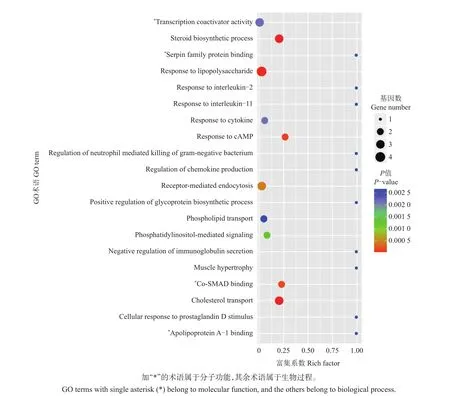
图2 20个最显著富集基因的GO散点图Fig.2 GOtermsof 20 most significantly enriched genes
2.3 差异基因KEGG富集性分析
京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)是系统分析基因功能、基因组信息的数据库,是进行生物体内代谢分析和代谢网络研究的强有力工具。图3是经过KEGG分析获得的富集性散点图,图中显示了差异基因富集的前20条生物学途径,其中富集系数表示该KEGG途径的差异基因数与总基因数的比值,富集系数越大,P值越接近于0,基因数量最多,表明差异基因在这条途径的富集程度越高。从中可以看出,KEGG富集程度最高的是参与卵巢类固醇合成,富集于其中的基因有IGF1、HSD3B1、STAR、SCARB1等。同时还可以看出,FSH可能通过部分信号通路调控颗粒细胞中的基因表达,例如FoxO信号通路、PPAR信号通路、RIG-Ⅰ样受体信号通路等,其中ATG12、IGF1富集于FoxO信号通路,OLR1富集于PPAR信号通路,ATG12富集于RIG-Ⅰ样受体信号通路。
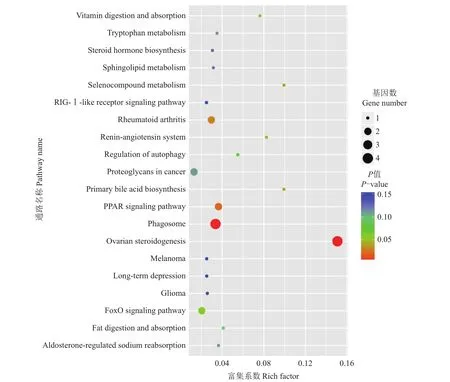
图3 差异表达基因KEGG富集性散点图Fig.3 KEGGenrichment scatter plotsof differentially expressed genes
2.4 荧光定量PCR验证分析
为了验证转录组测序结果的准确性,并寻找表达量与FSH浓度呈依赖性上升的基因,从测序结果中选择在FSH刺激下显著上调并能够在NCBI上找到基因序列的29个基因,以GAPDH为内参基因,利用荧光定量PCR对其表达水平进行验证。结果表明,29个基因的检测结果与转录组测序结果具有一致性,即FSH处理后的基因表达量显著上升(P<0.05),表明转录组测序检测到的基因表达丰度高度准确。图4列出了荧光定量PCR检测差异倍数大于2的17个基因。
2.5 FSH剂量依赖表达基因的筛选分析
为了找出表达量与FSH浓度梯度呈高度线性相关的基因,对17个荧光定量PCR检测表达量呈2倍以上差异的基因进行进一步筛选。首先,用等量增加的不同浓度 FSH(0、20、40、60、80、100 mIU/mL)处理颗粒细胞,经相同时间后,收集细胞进行RNA提取和荧光定量PCR检测。结果发现:在FSH的刺激下,虽然所有基因的表达均比空白对照有所上升,但变化趋势并不一致。部分基因例如STAR、AMCF-Ⅱ的表达量虽然随着FSH浓度的增加有升高的趋势,但缺乏线性相关关系;另一些基因例如ENDOD1、C1QTNF3的表达量在较低FSH浓度时有明显相关性,但100 mIU/mL处理组的表达量反而低于80 mIU/mL处理组,表明这些基因表达与FSH浓度梯度相关的范围较狭窄。最终,我们选择了表达量与FSH浓度有明显依存关系的LHCGR、S100A12、SCARA5和OLR1这4个候补基因,进行后续FSH浓度依赖表达试验。
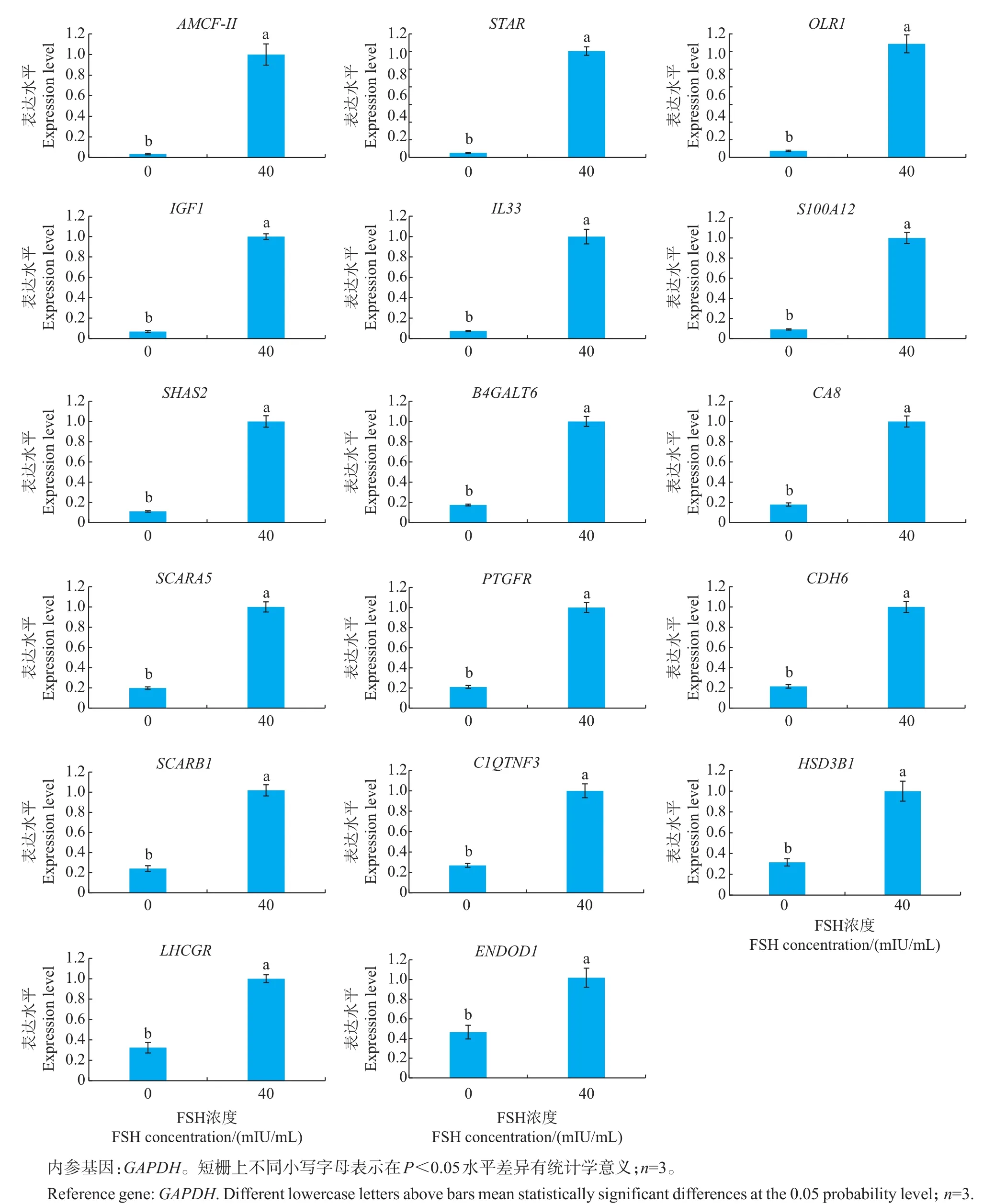
图4 荧光定量PCR检测基因表达结果Fig.4 Resultsof geneexpressionsdetected by real-timefluorescent quantitative PCR
用等倍增长的不同浓度FSH(0、1、3、9、27、81、243、729 mIU/mL)处理颗粒细胞,刺激18 h后收集样品,运用荧光定量PCR技术检测LHCGR、S100A12、SCARA5和OLR1基因表达的变化情况(图5)。从中可以发现:在FSH的刺激下,S100A12、SCARA5和OLR1基因虽然总体上呈上升趋势,但在低浓度时反应不明显,在较高浓度时随FSH浓度变化的线性关系不强;而LHCGR基因在0~243 mIU/mL FSH浓度范围内的表达量与FSH浓度存在极强的线性相关性,只有当FSH浓度达到729 mIU/mL时,才出现了小幅度的逆转。
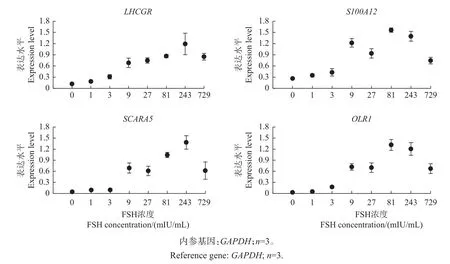
图5 不同浓度FSH处理颗粒细胞后的基因表达情况Fig.5 Expression of genes in granulosa cells cultured with FSH of various concentrations
2.6 LHCGR基因表达量与FSH浓度的相关性分析
在0、1、3、9、27、81、243 mIU/mL FSH的浓度梯度下,3次重复测定了LHCGR基因的表达量,均获得与图5一致的结果,表明在0~243 mIU/mL FSH浓度范围内,LHCGR基因表达量高度依赖于FSH浓度。代表性试验结果如图6所示。将FSH浓度作为自变量,LHCGR基因表达量作为因变量,进行回归分析,获得了y=0.189 4x-0.120 7的回归方程,两者决定系数R2达到0.982,接近于1,且各浓度之间差异显著。这说明LHCGR的表达量与FSH浓度呈极强的线性相关关系。
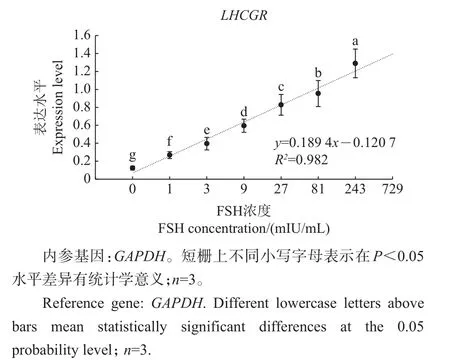
图6 LHCGR基因表达量与FSH浓度的线性关系Fig.6 Linear relationship between the expression of LHCGR gene and FSH concentration
3 讨论
转录组测序是利用高通量技术对RNA分子进行大规模的研究,主要是检查细胞转录的丰度和构成[3-4]。转录组测序可以通过捕获定量表达模式来检测基因活性和调节的变化,并且能够非常详细地描述基础表型,还可以提供关于结构、修饰[5]和转录物的变化细节[6-7],通过检测得到的大规模数据方便理解细胞中基因表达的变化情况[8]。在本研究中,我们运用转录组测序技术获得了大量受FSH调控的基因,结果显示:在卵泡颗粒细胞中受FSH调控的基因共有15 776个,其中上调的有9 111个;分析差异表达基因结果,最终在颗粒细胞中受FSH显著上调的基因仅有37个。通过GO功能富集分析,这些基因主要参与了细胞过程和分子功能相关生物活动,包括类固醇生物合成相关过程、对cAMP反应、对脂多糖反应、糖蛋白生物合成过程等。结合KEGG富集性分析,这些显著上调基因参与富集性较高的信号通路主要有FoxO信号通路、PPAR信号通路和RIG-Ⅰ样受体信号通路。这些结果可为进一步进行FSH调控卵泡颗粒细胞的分子生物学研究提供参考依据。
有研究发现,FSH受体活化后通过上调500个左右目标基因的表达来促进卵泡成熟[9],其中促黄体素/促性腺激素受体(LHCGR)被认为是FSH诱导下重要的靶基因之一[10],同时,LHCGR也是生殖功能调控G蛋白偶联受体,与类固醇激素代谢和卵巢卵泡发育密切相关。有研究显示,质量浓度仅为30 ng/mL的FSH就能够显著提高LHCGR的表达量,同时随着处理时间的延长表达量增加,在72 h达到平台期[11-12]。本试验结果显示,在猪卵泡颗粒细胞中LHCGR的表达量在FSH处理前后差异显著,而且,随着FSH浓度的上升而逐步增加,与上述文献报道的结果具有一致性。本试验还明确了在FSH刺激后18 h,LHCGR表达量与FSH浓度呈线性相关的范围为0~243 mIU/mL,这为后续建立可靠的FSH制品效价检测新方法奠定了基础。
当然,要建立标准化的FSH制品效价检测技术体系,还需要进一步的研究探索。其一,本试验采用6孔板做FSH浓度梯度试验,经RNA提取与反转录后进行荧光定量PCR测定,需要耗时1周左右,同时一次性检测的样本数量少,需要进一步简化、优化,特别是要建立将细胞FSH刺激、细胞裂解、RNA提取、cDNA合成和定量PCR检测在96孔板内完成的高通量、快速的检测操作模式;其二,利用FSH标准品,通过与现行国家标准检测法(大鼠卵巢增重法)的同步检测比较,以明确这2种方法检测结果的异同和优劣点;其三,孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)也是糖蛋白类激素的一种,其β亚基的肽序列具有独特的结构,兼有LH和FSH这2种激素的功能,能够与FSH和LH的受体结合发挥其生理作用,且PMSG因其半衰期长、只需一次性注射和价格便宜等优势,较FSH在畜牧生产上应用更为广泛[13-14],因此,有必要确认FSH的效价检测方法是否同样适用于PMSG;其四,通过比较猪卵泡颗粒细胞分离的猪卵泡发育阶段和传代培养代次的差异,亟待筛选出具有更好检测灵敏度和稳定性的检测用细胞。此外,从屠宰场获取猪卵巢分离颗粒细胞进行体外原代培养,容易受到细胞来源的限制,如果能够获得一种激素反应性稳定的永生化猪卵泡颗粒细胞系用于检测,将更为便利和规范。目前,永生化卵泡颗粒细胞系有多种,包括来源于鼠[15]、牛[16]、猪[17-21]和人[22-23]等的颗粒细胞系,属于永生化猪颗粒细胞系的有PGV、PGC-2、JC-410和ACG-16等。其中:PGV细胞系由病毒感染小卵泡中的颗粒细胞而来,对FSH刺激有反应,但没有类固醇生成活性[17];PGC-2细胞系和JC-410细胞系都是在继代培养过程中自发获得永生性[18-20],但这2种细胞系不含有FSH受体,失去了对促性腺激素的反应性;AVG-16细胞系由中等猪卵泡颗粒细胞建立,也对FSH刺激没有反应[21]。这说明卵泡颗粒细胞系在永生化过程中会发生促性腺激素受体丧失的情况。因此,将克隆的猪FSHR导入至永生化猪细胞,获取猪FSHR稳定表达的转化细胞株,使之成为检测FSH和PMSG在猪上的生物学效价的细胞工具,可能是一条可行的途径。
参考文献(References):
[1] PAPKOFF H,EKBLAD M.Ovine follicle stimulating hormone:Preparation and characterization of its subunits.Biochemical and Biophysical Research Communications,1970,40(3):614-621.
[2] STEELMAN S L,POHLE F M.Assay of the follicle stimulating hormone based on the augmentation with human chorionic gonadotropin.Endocrinology,1953,53(6):604-616.
[3]VELCULESCU V E,ZHANG L,ZHOU W,et al.Characterization of the yeast transcriptome.Cell,1997,88(2):243-251.
[4]CAMINCI P,KASUKAWA T,KATAYAMA S,et al.The transcriptional landscape of the mammalian genome.Science,2005,309(5740):1559-1563.
[5] FRYE M,JAFFREY SR,PAN T,et al.RNA modifications:What have we learned and where are we headed?Nature Reviews Genetics,2016,17(6):365-372.
[6]JOHNSON JM,CASTLE J,GARRETT-ENGELE P,et al.Genome-wide survey of human alternative pre-mRNA splicing with exon junctionmicroarrays.Science,2003,302(5653):2141-2144.
[7]TRAPNELL C,WILLIAMSBA,PERTEA G,et al.Transcript assembly and quantification by RNA-Seq revealsunannotated transcripts and isoform switching during cell differentiation.Nature Biotechnology,2010,28(5):511-515.
[8]HUGHES T R,MARTON M J,JONES A R,et al.Functional discovery via a compendium of expression profiles.Cell,2000,102(1):109-126.
[9] HSUEH A J,RAUCH R.Ovarian Kaleidoscope database:Ten years and beyond.Biology of Reproduction,2012,86(6):192.
[10]DIERICH A,SAIRAM M R,MONACO L,et al.Impairing follicle-stimulating hormone(FSH)signaling in vivo:Targeted disruption of the FSH receptor leadsto aberrant gametogenesis and hormonal imbalance.Proceedings of the National Academy of Sciences of the USA,1998,95(23):13612-13617.
[11]NAKAOK,KISHIH,IMAIF,et al.TNF-αsuppressed FSH-induced LH receptor expression through transcriptional regulation in rat granulosa cells.Endocrinology,2015,156(9):3192-3202.
[12]IKEDA S,NAKAMURA K,KOGURE K,et al.Effect of estrogen on the expression of luteinizing hormone-human chorionic gonadotropin receptor messenger ribonucleic acid in cultured rat granulosa cells.Endocrinology,2008,149(4):1524-1533.
[13]POPOVA E,KRIVOKHARCHENKOA,GANTEN D,et al.Comparison between PMSG-and FSH-induced superovulation for the generation of transgenic rats.Molecular Reproduction and Development,2002,63(2):177-182.
[14]PINTADO B,GUTIÉRREZ-ADÁN A,LIANO B P.Superovulatory response of Murciana goats to treatments based on PMSG/anti-PMSGor combined FSH/PMSG administration.Theriogenology,1998,50(3):357-364.
[15]STEIN L S,STOICA G,TILLEY R,et al.Rat ovarian granulosa cell culture:A model system for the study of cellcell communication during multistep transformation.Cancer Research,1991,51(2):696-706.
[16]BERNATHVA,MUROAF,VITULLOAD,et al.Cyclic AMP inhibits fibronectin gene expression in a newly developed granulosa cell line by a mechanism that suppresses cAMP-responsive element-dependent transcriptional activation.Journal of Biological Chemistry,1990,265(30):18219-18226.
[17]LIN M T.Establishment of an immortalized porcine granulosa cell line(PGV)and the study on the potential mechanisms of PGV cell proliferation.The Keio Journal of Medicine,2005,54(1):29-38.
[18]KWAN I,FAROOKHIR,MURPHY B D,et al.Steroidogenic properties of a spontaneously established porcine granulosacell line(PGC-2).Molecular Reproduction and Development,1996,45(3):299-307.
[19]CHEDRESE P J,RODWAY M R,SWAN C L,et al.Establishment of a stable steroidogenic porcine granulosa cell line.Journal of Molecular Endocrinology,1998,20(2):287-292.
[20]RODWAY M R,SWAN C L,GILLIO-MEINA C,et al.Regulation of steroidogenesis in jc-410,a stable cell line of porcine granulosa origin. Molecular and Cellular Endocrinology,1999,148(1/2):87-94.
[21]SADOWSKA A,NYNCA A,KORZENIEWSKA M,et al.Characterization of porcine granulosa cell line AVG-16.Folia Biologica(Praha),2015,61:184-194.
[22]IWASEA,KIYONOT,TAKIKAWA S,et al.Establishment of a human nonluteinized granulosa cell line that transitions from the gonadotropin-independent to the gonadotropin-dependent status.Endocrinology,2012,153(6):2851-2860.
[23]OKTEM O,AKIN N,BILDIK G,et al.FSH stimulation promotes progesterone synthesis and output from human granulosa cells without luteinization.Human Reproduction,2017,32(3):643-652.
