超高效液相色谱-串联质谱法同时测定化妆品中13种性激素含量
2018-05-10陈丹丹
茹 歌,王 柯,陈丹丹,郑 荣
(上海市食品药品检验所,上海 201203)
近年来,人们在化妆品上的消费逐步提高,化妆品的质量及安全问题成为大众关注的焦点。性激素是由动物性腺、胎盘以及肾上腺皮质网状带等组织合成的具有促进性器官成熟等作用的一类甾体激素,主要包括雌激素、雄激素和孕激素。在化妆品生产过程中,常有不法厂商将性激素添加到各类化妆品中。使用添加了性激素的化妆品,短时间内可以产生消除皱纹、增加皮肤弹性等作用,但长时间使用会导致皮肤萎缩,诱发乳腺癌、卵巢癌等疾病[1-2]。我国《化妆品安全技术规范》(2015版)和欧盟化妆品法规(Council Directive76/768/EEC)均明确规定雌激素、雄激素、孕激素为化妆品禁用组分。因此,开发适用于化妆品中性激素的测定方法具有重要意义。
目前,化妆品中性激素的检测方法主要包括薄层色谱法(TLC)、紫外分光光度法、高效液相色谱法(HPLC)、气相色谱-质谱联用法(GC-MS)、高效液相色谱-质谱联用法(LC-MS)、超高效液相色谱-线性离子阱/静电场轨道阱结合高分辨质谱法[3-14]。其中以HPLC法的应用最为广泛,我国《化妆品安全技术规范》2015年版收载了雌三醇等7种组分的液相色谱测定方法[15]。但光谱法、色谱法存在选择性差、灵敏度低等问题,无法解决化妆品中复杂基质干扰的问题,对于阳性样品常需进一步确证。而现有的超高效液相色谱-串联质谱法涵盖性激素种类较少,且未涉及孕三烯酮、炔诺孕酮、己酸羟孕酮等化合物,不能解决油类样品在甲醇、乙腈等溶剂中分散不均匀等问题,且前处理方法不具备专属性,适用范围有限,不能满足监管需求。因此,开发专属性的前处理方法,提高灵敏度,排除复杂基质干扰问题,从而准确定量不同化妆品中的性激素显得迫在眉睫。
本文选择较具代表性的睾酮、孕酮、甲基睾丸酮、孕三烯酮、醋酸甲地孕酮、醋酸甲羟孕酮、炔诺孕酮、醋酸氯地孕酮、己酸羟孕酮、雌三醇、雌二醇、雌酮和己烯雌酚13种性激素作为研究对象,根据化妆品不同基质的溶解性特征,选取液态水基类、液态油基类、膏霜乳液类(含面膜)化妆品为考察基质,建立专属性提取方法,采用超声萃取法对化妆品样品进行前处理,UPLC-MS/MS测定,提高了化妆品中性激素测定的准确性,建立了化妆品中上述13种性激素的简便、快速、灵敏的高通量检测方法,填补了化妆品中性激素测定的空白,提高了化妆品安全监管的实力,也为国家进一步补充相关检验方法提供了依据。
1 实验部分
1.1 仪器与试剂
Acqulity型超高效液相色谱仪(美国Waters公司);API 4500型串联四极杆质谱仪(美国AB公司);超声波清洗机(美国Branson公司);5810R型台式离心机(德国Eppendorf公司);MS 3旋涡混合器(德国IKA公司)。睾酮(Testosterone,纯度100.0%)、孕酮(Progesterone,纯度99.9%)、甲基睾丸酮(Methyltestosterone,纯度100.0%)、雌三醇(Estriol,纯度100.0%)、雌二醇(Estradiol,纯度100.0%)、雌酮(Estrone,纯度100.0%)、己烯雌酚(Diethylstilbestrol,纯度100.0%)均购于EDQM;孕三烯酮(Trenbolone,纯度99.7%)、醋酸甲地孕酮(Megestrol acetate,纯度100.0%)、醋酸甲羟孕酮(Medroxyprogesterone 17-acetate,纯度99.6%)、炔诺孕酮(Norgestrel,纯度99.4%)、醋酸氯地孕酮(Chlormadinone acetate,纯度100.0%)、己酸羟孕酮(Hydroxyprogesterone caproate,纯度100.0%)均购于中检院;乙腈(色谱纯,德国默克公司);正己烷(色谱纯,美国霍尼韦尔公司);其他试剂均为分析纯;实验用水由Milli-Q Advantage A-10型超纯水机(美国密理博公司)制备。
1.2 实验条件
1.2.1色谱条件色谱柱:十八烷基硅烷键合硅胶色谱柱(Poroshell 120 EC-C18,4.6 mm×100 mm,2.7 μm);柱温:25 ℃;流速:0.3 mL/min;进样体积:5 μL;流动相:纯水(A)和乙腈(B),梯度洗脱程序:0~25 min,78%~20%A;25~25.5 min,20%~5%A;25.5~27 min,5%A;27~27.5 min,5%~78%A;27.5~29 min,78%A。
1.2.2质谱条件电喷雾离子源(ESI+和ESI-);正离子喷雾电压5.0 kV,负离子喷雾电压4.5 kV;雾化气:N2;干燥气:N2;离子源温度:500 ℃;正、负模式以动态多反应监测(DMRM)扫描方式测定,目标化合物保留时间±60 s为采集窗口,详细的质谱参数列于表1。

表1 13种目标分析物的监测离子对及相关电压参数Table 1 The SIM(selected ion monitor) and voltage parameters of 13 target analytes

(续表1)
*quantitative ion
1.3 样品前处理
1.3.1液态水基类、膏霜乳液类(含面膜) 分别称取试样0.2 g(精确至0.1 mg)于10 mL容量瓶中,加入2 mL乙腈,在涡旋混匀器上充分涡旋振荡,使试样与提取溶剂充分混匀后,加入50%乙腈至近刻度,超声提取20 min,静置至室温,用50%乙腈定容至刻度,摇匀,以12 000 r/min离心10 min。取上清液适量,经0.22 μm滤膜过滤,滤液供UPLC-MS-MS测定。
1.3.2液态油基类称取试样0.2 g(精确至0.1 mg)于10 mL离心管中,加入2 mL正己烷,在涡旋混匀器上分散,加入50%乙腈3 mL,振荡提取2 min,以12 000 r/min离心5 min,吸取下层提取液至10 mL容量瓶中,上层正己烷溶液再加入50%乙腈3 mL,重复上述提取步骤1次,合并两次提取液,用50%乙腈定容至刻度,即得待测试液。
1.4 基质标准曲线系列溶液的配制
称取标准物质一定量于棕色容量瓶中,用50%乙腈溶解定容,配制成各性激素化合物质量浓度为1 mg/L的混合标准溶液。取各类型基质空白样品6份于10 mL容量瓶中(0.2 g/份),按上述样品前处理步骤处理,得到空白基质溶液。准确吸取适量体积混合标准溶液(1 mg/L),用空白基质溶液稀释并定容,配制成质量浓度分别为1、2、4、10、20、40、60 μg/L的系列基质标准曲线溶液。
2 结果与讨论
2.1 提取方式的选择
考察了超声提取、振荡提取、涡旋提取3种常见提取方式对4种基质化妆品样品中性激素的提取效率。均称取0.2 g(精确至0.1 mg)膏霜乳液类空白样品于10 mL容量瓶中,分别加入一定量的13种性激素混合标准溶液,加入2 mL乙腈,分别超声提取20 min、振荡提取20 min或涡旋提取5 min,静置至室温后,定容至刻度,离心后取上清液,经UPLC-MS/MS分析,测定加标回收率。研究表明,超声提取方式优于其余两种提取方式,且超声提取具有操作方便、高效等优势。考虑到膏霜乳液类和面膜类化妆品配方中常有大分子化合物等粘稠类物质,基质较为复杂,测定常受到基质干扰。为保证理想回收率,选择先涡旋分散样品,再超声提取。而不同超声时间的考察结果表明超声20 min和超声25 min无明显差异,均显著优于超声5 min和超声15 min,故选择超声20 min为提取条件。
2.2 提取溶剂的选择
根据目标化合物的极性,本实验考察了甲醇、乙腈和50%乙腈3种提取溶剂的提取效果。结果表明,液态水基类、膏霜乳液类(含面膜)化妆品均能够很好地分散于3种溶剂中,乙腈及50%乙腈对13种性激素类化合物的提取回收率均优于甲醇,但由于乙腈中溶解的成分更为复杂,对目标化合物的测定有干扰,故最终选择50%乙腈为提取溶剂,可在保证回收率的同时,排除杂质的干扰。但由于乙腈极性较强,不能使液态油基类样品均匀分散,提取回收率较低(见图1),故针对液态油基类样品,改用正己烷为溶剂分散样品,再用50%乙腈提取。

图1 液态油基类化妆品用50%乙腈直接提取与正己烷分散样品后再用50%乙腈提取的效果比较Fig.1 Extraction efficiencies of oil sample with 50% acetonitrile compared with 50% acetonitrile after dispersing in hexane
2.3 色谱条件的选择
研究发现C18色谱柱对13种化合物的保留和分离情况优于C8色谱柱。乙腈较于甲醇对目标化合物具有更好的分离效果,且提取溶剂和流动相种类一致能有效减小溶剂效应,故选择乙腈作为流动相的有机相。比较了0.1%甲酸水溶液、5 mmol/L乙酸铵水溶液、纯水作为水相的响应,发现前两者均能够分别提高正、负离子模式采集时的响应,但又分别抑制负、正离子模式采集时的响应。综合考虑13种化合物性质,最终选择以纯水作为水相。
2.4 质谱条件的优化
分别在正、负离子扫描模式下,对目标化合物母离子进行全扫描,得到各目标化合物的母离子后,选择子离子分子量范围,利用二级质谱扫描确定其子离子,并优化确定其碎裂电压及碰撞能量。同时,进一步优化离子源温度、雾化气及干燥气的最佳质谱参数。经验证,在“1.2.2”分析条件下,各目标化合物均具有较高灵敏度,且在该条件下稳定,其MRM图见图2。
2.5 线性范围与检出限
由于化妆品样品复杂,有较显著基质效应,基质标准曲线较溶液标准曲线能排除基质效应干扰(图3),可更准确定量,故配制性激素系列基质标准溶液,采用外标法定量。13种性激素在0.89~64.80 μg/L范围内线性良好(表2~3),以3倍信噪比(S/N=3)计算仪器检出限为0.001~0.026 μg/g满足检测需求,与《化妆品安全技术规范》2015年版测定方法比较,其灵敏度显著提高(表4)。

图2 13种性激素的MRM图Fig.2 MRM chromatogram of 13 sex hormonesthe number denoted was the same as that in Table 1

图3 基质标准曲线和溶液标准曲线分别测定膏霜乳液类样品的加标回收率Fig.3 Comparison between matrix standard calibration curve and standard calibration curve the number denoted was the same as that in Table 1

表2 液态水基样品和液态油基样品中性激素的线性范围及相关系数Table 2 Linear ranges and correlation coefficients of toner sample and oil sample

(续表2)

表3 膏霜乳液样品和面膜中性激素的线性范围及相关系数Table 3 Linear ranges and correlation coefficients of cream sample and mask sample
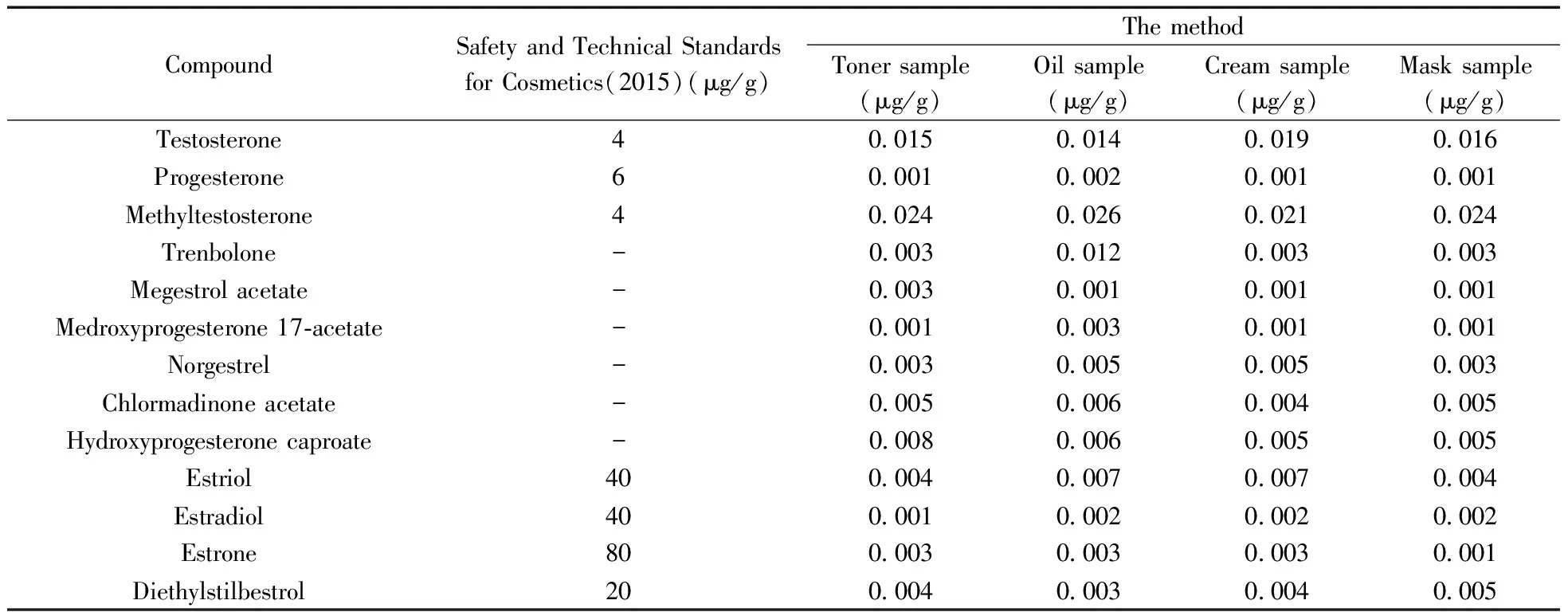
表4 本方法与《化妆品安全技术规范》2015年版性激素测定方法LODs的比较Table 4 Comparison of LODs with the method and《Safety and Technical Standards for Cosmetics》(2015)
2.6 加标回收率与精密度
取各基质空白样品0.2 g(精确至0.1 mg)于10 mL容量瓶中,加入混合对照品储备液,制成高(1.0 μg/g)、低(0.1 μg/g)2个浓度水平,每个浓度水平平行制备6份,进行加标回收率实验,测得峰面积分别代入相应的基质标准曲线计算浓度,除以理论加入量,即得方法回收率。测定结果表明,加标回收率为80.8%~116.8%,精密度为0.7%~14.4%(见表5),该方法测定结果准确,能够用于各类基质化妆品中性激素的测定。

表5 不同基质化妆品加入目标化合物的回收率Table 5 Spiked recoveries and relative standard deviations(RSD,n=6) of hormones of different kinds of cosmetics
2.7 实际样品的测定
由于化妆品基质复杂,利用《化妆品安全技术规范》2015年版中性激素的测定方法测定化妆品样品时,样品在标准品保留时间处常有杂质峰干扰。而应用本方法对市售化妆品进行测定,能够准确进行定性、定量分析,证明该方法能有效筛查化妆品中的性激素。分别测定液态水基类、液态油基类、膏霜乳液类(含面膜)化妆品各5批,在1批膏霜乳液类样品中检出己烯雌酚,含量为0.2 mg/kg(见图4),远低于《化妆品安全技术规范》2015版收载的雌三醇等7种组分的液相色谱法中己烯雌酚的检出限(20 mg/kg)。

3 结 论
本文建立了UPLC-MS/MS同时测定13种性激素类化合物的方法。针对不同基质的化妆品样品,建立了专属性的前处理方法。该方法操作简便,灵敏度高,定量准确,适用于多种基质类型化妆品中性激素的快速筛查,扩大了检验范围,为有效监管化妆品中非法添加禁用物质提供了技术支撑。
参考文献:
[1] Wen Y,Wang Y,Zhou B S,Xu Y,Feng Y Q.Chin.J.Anal.Chem.,2007,35(5):681-684.
[2] Gao X D,Huang X,Hao B C,Chen S E,Liang J P.HeilongjiangAnimalSci.Veter.Med.(高旭东,黄鑫,郝宝成,陈士恩,梁剑平.黑龙江畜牧兽医),2015,(11):274-277.
[3] Wang J,Lin S B.J.Med.Res.(王君,林少彬.医学研究杂志),2007,36(3):89-91.
[4] Zhao S,Wu D N,Wang P.Chin.J.Chromatogr.(赵珊,吴大南,王鹏.色谱),2004,22(3):267-269.
[5] Pang D B,Xu L,Ji S F,Liu Q Q.FlavourFragranceCosmetics(庞道标,徐莉,纪少凡,刘庆祺.香精香料化妆品),2017,6(3):29-32.
[6] Huang B F,Ye L,Han J L,Feng L,Tan Y,Wang X F.Chin.J.HealthLab.Technol.(黄百芬,叶蕾,韩见龙,冯靓,谭莹,王小芳.中国卫生检验杂志),2011,21(5):1048-1053.
[7] Yue L,Li X J.ChinaSurfactantDetergent&Cosmetics(岳磊,李晓静.日用化学工业),2017,47(8):476-480.
[8] Wu W Q,Shen C Y,Yang Y L,Zhang Y.J.Environ.Occup.Med.(吴维群,沈朝烨,杨玉林,张韵.环境与职业医学),2004,21(4):307-309.
[9] Wang X F,Zeng W F,Wang J,Ren R.Chin.J.Chromatogr.(王小芳,曾文芳,王菁,任韧.色谱),2009,27(3):328-332.
[10] Zhang X L,Ding J,Wang J L.StraitPharm.J.(张晓璐,丁建,汪嘉丽.海峡药学),2015,27(10):36-39.
[11] Wang Y F,Liu Z B,Xiong Z Q,Luo Y,Yuan A H,Liu B.Chin.J.Rat.DrugUse(汪元符,刘志斌,熊震球,骆瑜,袁爱华,刘玢.中国合理用药探索),2017,14(3):33-41.
[12] Lin Z H,Zhao Y,Xing Y N,Chen Q,Feng A H,Ye L Q,Chen Z Y.Chin.J.Anal.Lab.(林志惠,赵彦,幸苑娜,陈茜,冯岸红,叶淋泉,陈泽勇.分析试验室),2017,36(4):441-447.
[13] Li X Q,Wang L L.Chin.J.PublicHealth(李显庆,王玲玲.中国公共卫生),2014,30(3):359-360.
[14] Xiang W.Mod.Chem.Ind.(项玮.现代化工),2017,37(9):206-210.
[15] Safety and Technical Standards for Cosmetics(2015).Beijing:China Food and Drug Administration(化妆品安全技术规范(2015年版).北京:国家食品药品监督管理总局),2015.
