多壁碳纳米管分散固相萃取结合在线GPC/GC-MS/MS技术同时检测茶叶中40种有机磷农药
2018-05-10朱炳祺金绍强田春霞徐潇颖罗金文
朱炳祺,金绍强,田春霞,胡 帆,徐潇颖,罗金文
(浙江省食品药品检验研究院,浙江 杭州 310000)
中国作为茶叶种植历史最悠久、种植面积最大的国家,产量和出口量均居世界前列,而茶叶的生产消费在我国经济、文化、生活等领域有着重要的地位[1]。针对茶叶的食用安全问题,以欧盟和日本为代表的茶叶进口国家和地区相继出台了严格的法令以规定茶叶中农药的最大残留限量(MRL)[2]。由欧盟发布的一份关于茶叶的调查报告显示,2013年有24.3%来自中国被抽检的茶叶产品中的农药残留量超标,其中包括三唑磷、毒死蜱等有机磷农药[3]。近年来,我国不断更新相关检测以及限量标准,对茶叶产品中的农药残留量限定也越来越严格。
有机磷类农药作为杀虫剂,广泛应用在各类农产品的种植过程中,是农产品质量安全控制的重要检测指标[4-5]。目前,我国在茶叶种植过程中已登记的有机磷农药包括敌敌畏、敌百虫、杀螟硫磷、马拉硫磷、辛硫磷、乐果。而在日常检验中发现三唑磷、毒死蜱、马拉硫磷、杀螟硫磷、水胺硫磷等多种农药在茶叶样品中有检出[6-8],因此建立茶叶中有机磷农药多残留检测的有效方法,对日常监测工作具有实际意义。茶叶样品基质复杂,分析时若前处理净化效果不佳容易对仪器和色谱柱造成污染,影响目标化合物的定性定量分析[2]。因此,亟需建立有效的样品前处理技术以减少基质干扰。现行的国家标准[9-11]均采用固相萃取(SPE)法进行净化,SPE柱净化效果虽好,但价格较昂贵,操作繁琐。近年来,分散固相萃取(DSPE)技术发展迅速,其改进而成的QuEChERS方法已成为AOAC 2007.01 和EN 15662官方方法[12-13],但该方法所使用的N-丙基乙二胺(PSA)吸附剂对复杂基质的净化效果并不理想。多壁碳纳米管(MWCNTs)是碳六元环构成的类石墨平面卷曲而成的纳米级中空管,具有极大的比表面积,因此吸附容量更大,吸附性能更佳[14-15]。MWCNTs优异的吸附性能使其可应用在前处理过程中,并通过吸附基质干扰物而达到净化样品的目的。目前,仅有少量学者对此进行了研究[16-17]。
凝胶渗透色谱(GPC)净化技术根据分子量的大小对样品中目标物和基质干扰物进行分离,有较好的净化效果[18-19]。相对于传统离线GPC净化存在的操作繁琐、溶剂消耗量大等问题,在线GPC技术极大减少了溶剂消耗,将其与气相色谱-质谱(GC-MS)串联实现了对样品GPC净化和GC-MS分析全过程的自动化,具有重要的应用价值[20]。在针对茶叶中有机磷农药的检测方面,GPC 与 GC-MS联用已有报道,但GPC与气相色谱串联三重四极杆质谱(GC-MS/MS)在线串接使用的文献报道极少[20-21]。GC-MS/MS较GC-MS具有更好的抗干扰能力和更高的灵敏度。此外,采用MWCNTs为吸附剂的DSPE方法操作简便,净化效果优异。结合以上优势,本研究发展在线凝胶色谱-气相色谱三重四极杆串联质谱(GPC/GC-MS/MS)技术并利用MWCNTs开发高效DSPE前处理方法,建立了一种同时测定茶叶中40种有机磷农药的经济、高效、灵敏的新方法。
1 实验部分
1.1 仪器与试剂
TQ 8040在线GPC/GC-MS/MS系统(日本Shimadzu公司);台式离心机(美国Thermo Fisher公司);电子天平(瑞士Mettler-Toledo公司)。
茶叶样品为市售预包装茶叶(包括绿茶、红茶、乌龙茶);乙腈(色谱纯,德国Merck公司);甲苯、环己烷、丙酮(色谱纯,美国Tedia公司);无水硫酸镁(分析纯,国药集团化学试剂有限公司);MWCNTs(直径8~15 nm,长度50 μm,纯度95%,比表面积大于140 m2/g,中科院成都有机化学有限公司),TPT固相萃取净化柱(1 000 mg/6 mL,天津Agela公司);农药对照品:灭线磷、治螟磷、甲拌磷、乐果、特丁硫磷、胺丙畏、地虫硫磷、二嗪磷、乙拌磷、除线磷、甲基毒死蜱、甲基对硫磷、皮蝇磷、对氧磷、甲基嘧啶磷、杀螟硫磷、马拉硫磷、毒死蜱、倍硫磷、对硫磷、水胺硫磷、毒壤磷、溴硫磷、嘧啶磷、异丙胺磷、喹硫磷、杀扑磷、乙基溴硫磷、杀虫畏、灭菌磷、丙溴磷、乙硫磷、三唑磷、伐灭磷、亚胺硫磷、苯硫磷、伏杀硫磷、定菌磷、乙基谷硫磷、蝇毒磷(质量浓度均为1 000 mg/L,农业部环境保护科研监测所)。
1.2 实验方法
1.2.1标准溶液的配制分别移取上述农药标准品各100 μL于10 mL容量瓶中,用丙酮定容至刻度得质量浓度为10 mg/L的混合标准储备液。精密移取混合标准储备液于容量瓶中,用丙酮稀释,配制成质量浓度为1 mg/L的混合标准使用液。取混合标准使用液,以经前处理的空白样品溶液为溶剂,配制成0.5、1、2、5、10、20、50、100 μg/L系列基质匹配混合标准工作液。
1.2.2样品的前处理样品提取:取粉碎均匀的茶叶样品4 g于50 mL离心管中,精确加入10.0 mL乙腈,旋涡混合1 min,超声提取20 min后以5 000 r/min离心5 min,取上清液待净化。
样品净化:移取上清液1.0 mL,加入1.0 mL甲苯,转入含有分散固相萃取吸附剂的15 mL离心管中(含MWCNTs 30 mg,无水硫酸镁150 mg),旋涡混匀2 min,于4 000 r/min离心10 min。经0.22 μm滤膜过滤后,待测定。
1.2.3在线GPC/GC-MS/MS条件GPC条件:凝胶渗透色谱柱:Shodex EV-200(150 mm×2 mm);柱温:40 ℃;进样量:10 μL;检测波长:210 nm;泵流速:0.1 mL/min;流动相:丙酮-环己烷溶液(体积比3∶7)。
GC-MS/MS条件:预柱:RXi-5Sil MS(5 m×0.25 mm×0.25 μm);色谱柱:RXi-5Sil MS(25 m×0.25 mm×0.25 μm);进样方式:程序升温汽化(PTV)进样,不分流进样;载气:氦气(纯度≥99.999%);柱流量:1.75 mL/min;进样口升温程序:120 ℃保持5 min,以100 ℃/min升至250 ℃,保持33.7 min;柱温箱升温程序:82 ℃保持5 min ,以8 ℃/min升至280 ℃,保持7.75 min;离子源:EI,250 ℃。
2 结果与讨论
2.1 在线GPC/GC-MS/MS分析方法的建立
如图1所示,GPC/GC-MS/MS由GPC和GC-MS/MS两部分串联组成[22]。首先,目标物和样品基质在GPC色谱柱中得到分离,目标物馏分被收集于定量环中。随后将该馏分注入气相色谱柱中,目标物在预柱中得到富集,待溶剂流出后,柱温箱开始进行程序升温,目标物随温度增加而气化进入分析柱中进行分离,在MS/MS检测器中进行分析。根据40种有机磷农药分子大小,利用分子较小的灭螨猛和分子较大的氟胺氰菊酯两个标记物在凝胶色谱柱中的保留时间,确定目标馏分收集时间段3.83~5.83 min。该时间段内馏分通过PTV进样,进入气相色谱,依次进行全扫描和产物离子扫描,进而确定母离子和子离子,并对各目标化合物的多反应监测(MRM)参数进行优化[23],具体参数见表1。如图2所示,40种化合物得到有效分离和识别。
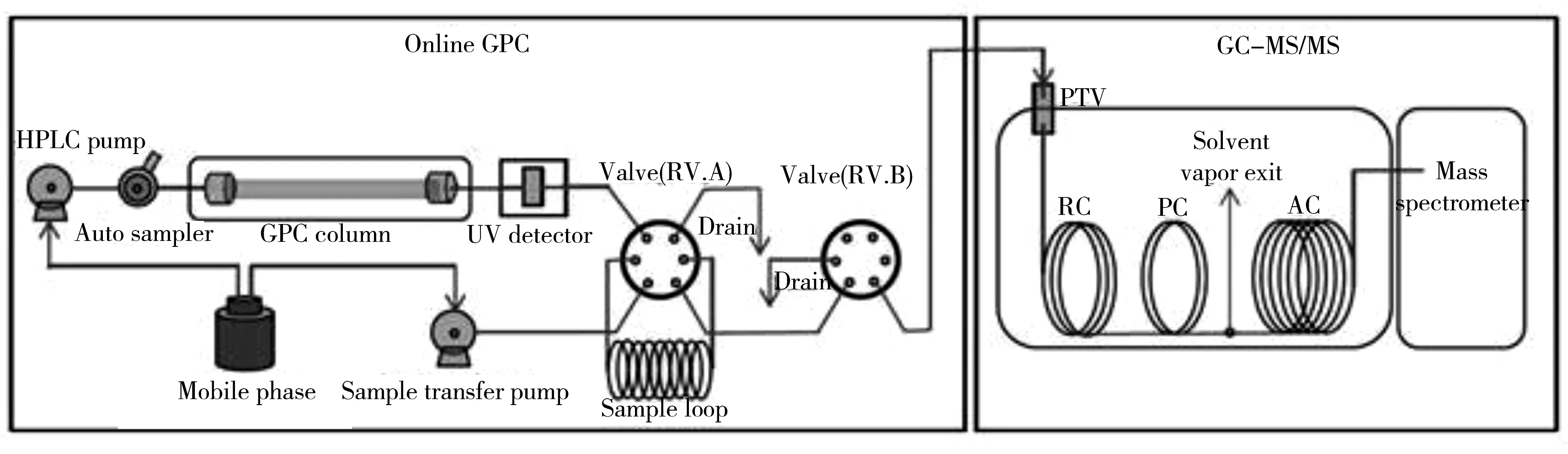
图1 在线 GPC/GC-MS/MS示意图Fig.1 Schematic flow diagram of online GPC/GC-MS/MS system
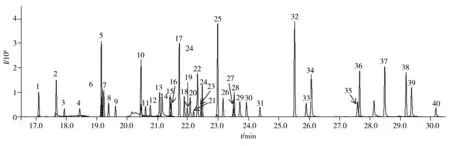
图2 40种有机磷农药基质匹配标准溶液的MRM总离子流色谱图Fig.2 MRM total ion chromatogram of 40 organphosphorus pesticides matrix-matched standard solution the number denoted was the same as that in Table 1
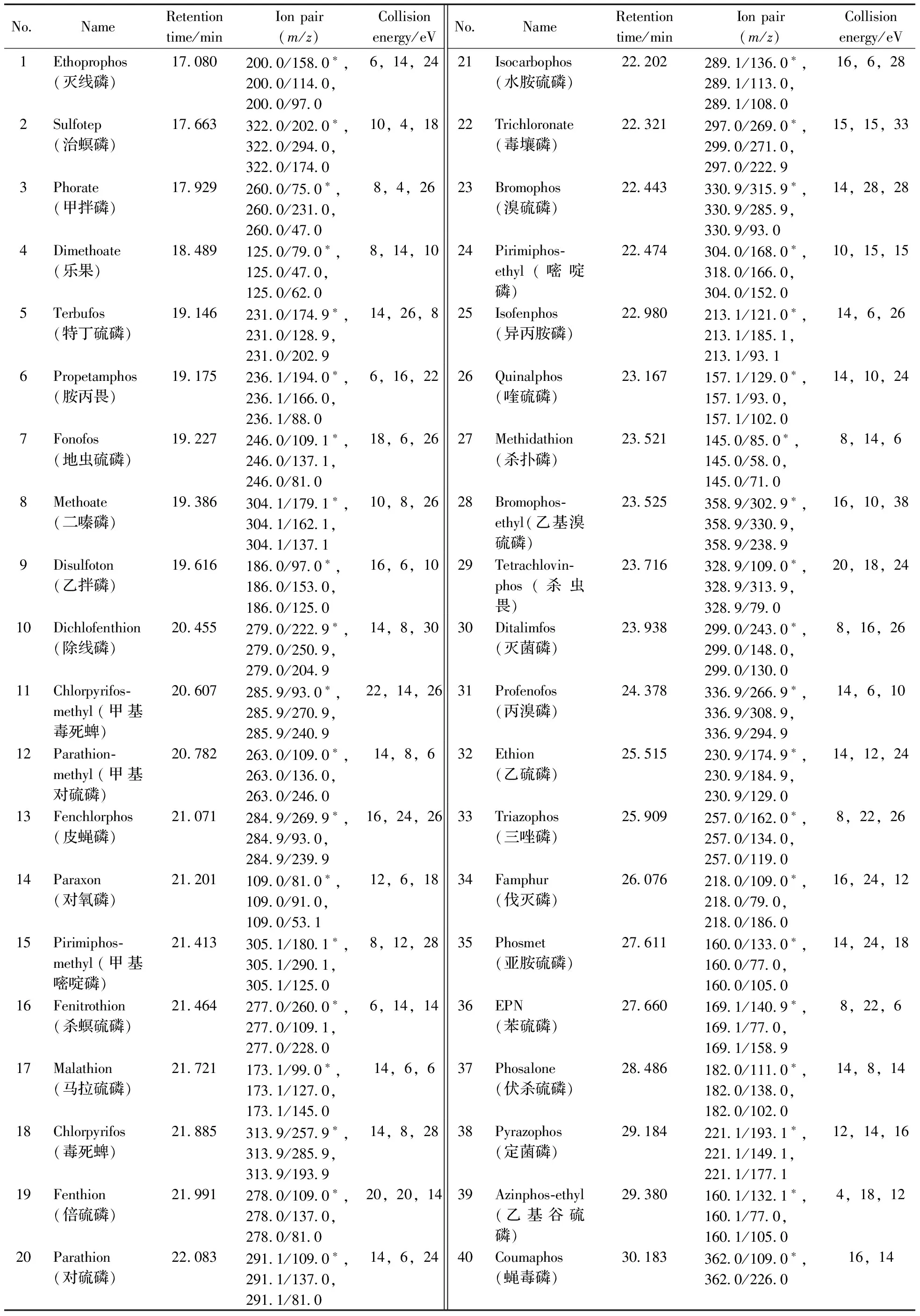
表1 40种有机磷农药的保留时间、监测离子对和碰撞能量Table 1 Retention times,monitoring ions and collision energies of 40 organophosphorus pesticides
*quantitative ion pairs
2.2 样品前处理方法的优化
大部分有机磷农药极性较强,选用乙腈作提取溶剂时,不仅可以减少基质干扰物的溶出,而且能够保证较好的提取效率[21,24-25]。本研究中茶叶经乙腈提取后离心,上清液中加MWCNTs净化。MWCNTs比表面积大,对色素以及含平面结构的化合物有良好的吸附作用。实验发现,随着MWCNTs添加量的增大,对基质中色素的净化效果显著,但部分目标化合物也随之被吸附,导致回收率偏低;通过在洗脱液中加入甲苯,可以降低MWCNTs对目标农药的吸附,确保检测的准确性[20]。实验考察了MWCNTs对目标物的吸附及添加甲苯对回收率的影响。在阴性绿茶样品中添加有机磷0.25 mg/kg,对1 mL乙腈提取液+1 mL甲苯与1 mL乙腈提取液+1 mL乙腈进行比较,分别考察了不同MWCNTs添加量(5、10、20、30、50 mg)时目标化合物的回收率。结果显示,在添加乙腈条件下,有30种有机磷均随着MWCNTs添加量的增加回收率显著下降,而它们的结构中均含苯环或杂环;MWCNTs添加量为50 mg时,毒死蜱和杀螟硫磷等30种农药的回收率均低于70%,其中有13种有机磷农药的回收率不足20%。添加甲苯后,目标物回收率均得到提高。在30 mg MWCNTs添加量并添加甲苯的条件下,所有目标物回收率均大于80%,因此选择该条件为实验条件。
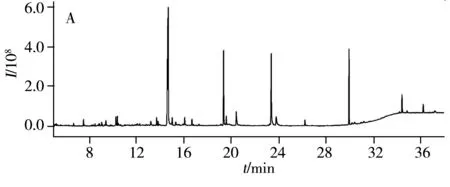
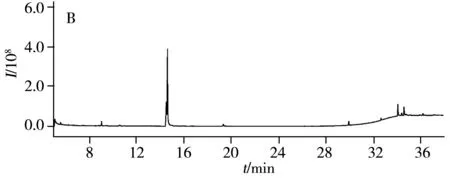
图3 阴性绿茶样品的全扫描总离子流图Fig.3 Scan chromatograms of blank teaA:pretreated by TPT SPE column;B:pretreated by MWCNTs
2.3 两种前处理方法的比较
研究中比较了SPE柱和DSPE两种净化方法。使用阴性绿茶样品,DSPE净化方法中加入30 mg MWCNTs为吸附剂,依据本文“1.2.2”步骤进行操作;SPE依据GB/T 23204-2008进行操作,即4 g样品经8 mL乙腈重复提取2次,将提取液转移至20 mL容量瓶中定容至刻度,取2.0 mL提取液经TPT固相萃取柱净化,以乙腈-甲苯(3∶1)为洗脱液收集流出液约30 mL,将流出液浓缩至近干后,用正己烷定容至2.0 mL。结果表明,SPE对色素的净化效果明显,但GC-MS全扫描获得的样品总离子流图显示,经MWCNTs为吸附剂的DSPE方法净化后基质干扰峰更少,如图3所示。
在0.1 mg/kg加标浓度下,利用MWCNTs净化后,测得40种有机磷农药的回收率为87.7%~104%,相对标准偏差(RSDs)为0.7%~5.6%;TPT柱净化方法的回收率除灭菌磷外均在82.4%~107.2%之间,RSDs为0.7%~11.0%,其中灭菌磷回收率仅为54%(RSD为16.3%),原因是其被SPE柱吸附而未能得到有效洗脱。与SPE净化方法相比,MWCNTs净化可保证对灭菌磷的准确分析,此外DSPE净化步骤在成本和操作上均具有优势。
2.4 方法学考察
依据“1.2.1”,采用空白基质进行标准曲线配制,以目标物的峰面积(Y)为纵坐标,质量浓度(X,μg/L)为横坐标,进行线性回归,绘制标准曲线,线性范围如表2所示。40种有机磷农药在对应的质量浓度范围内均呈良好的线性关系,r2均不小于0.99。以色谱峰信噪比(S/N)≥3计算方法检出限(LOD),S/N≥10确定方法定量下限(LOQ)。对阴性绿茶样品进行20、50、150 μg/kg 3个浓度水平的加标回收率实验,结果见表2。

表2 40种有机磷农药在茶叶中的加标回收率、相对标准偏差(n=6)、线性范围、检出限与定量下限Table 2 Spiked recoveries,relative standard deviations(RSDs),linear ranges,limit of detection(LOD) and limits of quantitation(LOQ) for 40 organophosphorus pesticides spiked in tea(n=6)

(续表2)
实验结果显示,40种有机磷农药的回收率为84.2%~109.9%,RSD为1.1%~8.9%,方法的准确度及精密度满足实际检测的要求。检出限低至0.5~4.6 μg/kg,优于同类文献中1.5~20 μg/kg[17,26]的结果(如甲拌磷、杀螟硫磷的检出限均低于相关文献中结果值的4倍以上)。这是由于,一方面,在线GPC/GC-MS/MS可将进样量增至10 μL,较传统进样方式提高了样品量;另一方面,MRM模式较常用的选择离子扫描模式降低了背景干扰,提高了检测灵敏度。
2.5 实际样品的检测
采用本方法对50批茶叶样品进行测定,其中有1批样品检出马拉硫磷,2批样品检出毒死蜱,1批样品检出杀螟硫磷,其余样品均未检出。使用GB/T 23204-2008方法对4批阳性样品进行验证,检测结果如表3所示,表明本方法对实际样品的测定结果与现行标准相近。
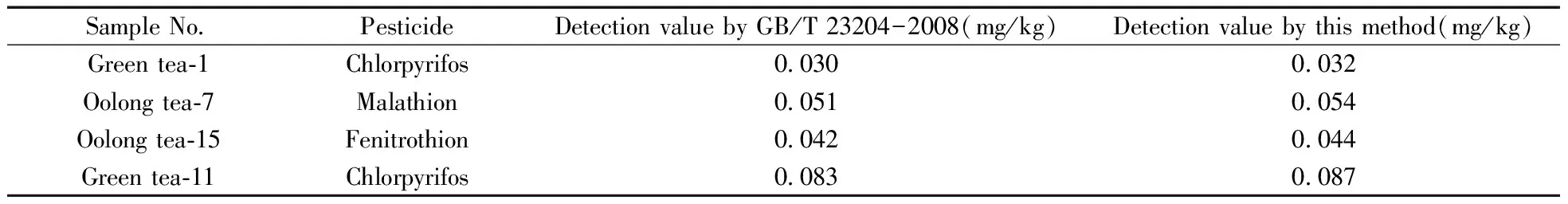
表3 实际样品的检测结果Table 3 Detection results of the practical samples
3 结 论
本研究利用MWCNTs的DSPE净化方法结合在线GPC/GC-MS/MS技术,建立了茶叶中40种有机磷农药残留量的检测方法。研究结果显示,在MWCNTs净化过程中添加甲苯可提高相应农药的回收率。通过比较SPE和DSPE两种净化方法,发现MWCNTs的净化效果优于使用TPT柱的SPE净化方法。本方法前处理步骤简单、操作便捷、灵敏度高,能够满足茶叶中痕量农药残留的检测要求,从而为复杂基质中多农药残留的绿色检测提供了新方向。
参考文献:
[1] Zhang H L,Shu Y Q.HubeiAgric.Sci.(张荷丽,舒友琴.湖北农业科学),2010,49(2):476-478.
[2] Zhang Y Y,Zhang Z,Chen Z Z,Wang B,Li B.J.FoodSaf.Qual.(张媛媛,张卓,陈忠正,王兵,李斌.食品安全质量检测学报),2014,5(9):2711-2716.
[3] Authority E F S.EFSAJ.,2015,13(3):4038.
[4] Sharma D,Nagpal A,Pakade Y B,Katnoria J K.Talanta,2010,82(4):1077-1089.
[5] Huang Z,Li Y,Chen B,Yao S.J.Chromatogr.B,2007,53(1/2):154-162.
[6] Su J F,Zhong M S,Chen J,Guo X,Chen J X,Liang Z,Liu J J.J.Instrum.Anal.(苏建峰,钟茂生,陈晶,郭昕,陈劲星,梁震,刘建军.分析测试学报),2015,34(6):625-638.
[7] Rong J F,Wei H,Li Y J,Huang H S,Xu M Z.Chin.J.Chromatogr.(荣杰峰,韦航,李亦军,黄伙水,许美珠.色谱),2016,34(2):194-201.
[8] Chen S H,Zhang Q,Shi X M,Yang Y T.J.FoodSci.Technol.(陈士恒,章晴,史晓梅,杨永坛.食品科学技术学报),2014,32(5):63-68.
[9] GB/T 23204-2008.Determination of 519 Pesticides and Related Chemicals Residues in Tea-GC-MS Method.National Standards of the People’s Republic of China(茶叶中519种农药及相关化学品残留的测定 气相色谱-串联质谱.中华人民共和国国家标准).
[10] GB/T 23205-2008.Determination of 448 Pesticides and Related Chemicals Residues in Tea-LC-MS-MS Method.National Standards of the People’s Republic of China(茶叶中448种农药及相关化学品残留的测定 液相色谱-串联质谱.中华人民共和国国家标准).
[11] SN/T 1950-2007.Determination of Organphosphorus Pesticides Multiresidues in Tea for Import and Export—Gas Chromatography.Standards of Entry and Exit Inspection and Quarantine Industry of the People’s Republic of China(进出口茶叶中多种有机磷农药残留量的检测方法—气相色谱法.中华人民共和国出入境检验检疫行业标准).
[12] Anastassiades M,Lehotay S J,Stajnbaher D,Schenck F J.J.AOACInt.,2003,86(2):412-431.
[13] Lehotay S J,Mastovská K,Lightfield A R.J.AOACInt.,2005,88(2):615-629.
[14] Socas-Rodríguez B,Herrera-Herrera A V,Asensio-Ramos M,Hernándezborges J.J.Chromatogr.A,2014,1357(40):110-146.
[15] Liang X,Liu S,Wang S,Guo Y,Jiang S.J.Chromatogr.A,2014,1357:53-67.
[16] Su R,Xu X,Wang X,Li D,Li X,Zhang H,Yu A.J.Chromatogr.B,2011,879(30):3423-3428.
[17] Hou X,Lei S,Qiu S,Guo L,Yi S,Liu W.FoodChem.,2014,153:121-129.
[18] Hu B Z,Song W H,Xie L P,Shao T F.Chin.J.Chromatogr.(胡贝贞,宋伟华,谢丽萍,邵铁峰.色谱),2008,26(1):22-28.
[19] Zhang X B,Shangguan L M.J.TeaBus.(张雪波,上官良敏.茶业通报),2009,31(2):81-83.
[20] Lu D S,Xiong L B,Wen Y M,Qiu X L,Wang G Q.J.Chin.MassSpectrom.Soc.(卢大胜,熊丽蓓,温忆敏,邱歆磊,汪国权.质谱学报),2011,32(4):229-235.
[21] Li J M,Zhong D B,Wang Y Q,Feng L,Zhu H K.Chin.J.Chromatogr.(李军明,钟读波,王亚琴,冯雷,祝红昆.色谱),2010,28(9):840-848.
[22] Liu L B,Hashi Y,Qin Y P,Zhou H X,Lin J M.J.Chromatogr.B,2007,45(1):61-68.
[23] Zhang J H,Wu H Y,Fang X Y,Zhang R Q.CerealsOils(张静恒,吴虹玥,方晓燕,张蓉琴.粮食与油脂),2015,(5):60-62.
[24] Li C Y,Kong X H,He Q,Du B Z,Wang N.FoodNutr.Chin.(李春艳,孔祥虹,何强,杜宝中,王娜.中国食物与营养),2010,(2):57-60.
[25] Yu L,Song W,Zhao M Y,Zhou F F,Hu Y Y,Zheng P.Chin.J.Chromatogr.(余璐,宋伟,吕亚宁,赵暮雨,周芳芳,胡艳云,郑平.色谱),2015,33(6):597-612.
[26] Su J F,Zhong M S,Chen J,Guo X,Chen J X,Liang Z,Liu J J.J.Instrum.Anal.(苏建峰,钟茂生,陈晶,郭昕,陈劲星,梁震,刘建军.分析测试学报),2015,34(6):625-638.
