LBH589/来那度胺调控多发性骨髓瘤细胞中IRF4并促进凋亡反应的研究
2018-05-10唐思诗成冰清余琨琳王季石
唐思诗,马 丹,成冰清,余琨琳,王季石△,彭 焱
(1.贵州医科大学,贵阳 550004;2.贵州医科大学附属医院血液科,贵阳 550004;3.南华大学附属怀化医院血液科 418000;4.湖南省人民医院肿瘤科,长沙 410000)
多发性骨髓瘤(MM)是一种侵袭性强并且不可治愈的血液系统恶性肿瘤[1]。目前为止,来那度胺、硼替佐米等仍然是MM的首选药物,然而,部分MM患者在治疗后仍然复发,对骨髓瘤细胞致病机制的深入研究显示,干扰素调节因子4(IRF4)是骨髓瘤生长中不可缺少的转录因子,在骨髓瘤细胞中表达失调,而且会在相应的肿瘤细胞染色体上发生变异、扩增和突变[2]。表明IRF4可以作为寻找治疗MM的新的治疗靶点,而降低MM的耐药复发性已经成为MM的重要问题。
LBH589是一种FDA批准为治疗MM的化疗药物,已经用于临床治疗MM患者,它是一种广谱的去乙酰化酶抑制剂[3],作用机制很多,目前尚不完全明确。而来那度胺是一种免疫调节剂,已经用于MM的治疗[4],但MM患者仍然会产生耐药或者复发。目前组蛋白乙酰化酶抑制剂(HDACi)与其他化疗药物联合治疗是诱导肿瘤细胞凋亡的主要方法,并且可以有效减少肿瘤细胞的耐药以及复发[5]。本研究主要分析LBH589单药或者联合来那度胺在MM中的作用机制以及相关靶点,为临床治疗MM患者提供新的治疗方法。
1 材料与方法
1.1材料 人MM细胞株RPMI8226以及人MM耐来那度胺细胞株RPMI8226-R由贵州医科大学附属医院造血干细胞移植中心实验室冻存。LBH589(帕比斯他)购自美国Selleck公司,TRIzol、逆转录试剂盒均为美国Invitrogen公司产品,CCK8、二甲基亚砜(DMSO)为赛兰博科技有限公司产品,RPMI-1640培养基、胎牛血清购自杭州四季青公司,AnnexinV-FITC/PI试剂盒(凯基生物)、HO-1一抗及二抗购自碧云天生物技术研究所,Bax一抗购自上海晶天生物技术有限公司,PCR引物由上海捷瑞生物工程有限公司合成。
1.2方法
1.2.1细胞培养 RPMI8226和RPMI8226-R使用含10%胎牛血清,100 U/mL青霉素及100 mg/L链霉素的RPMI-1640培养基37 ℃、5% CO2、100%饱和湿度CO2培养箱培养,细胞接种密度(4~5)×105个/mL,使用处于对数生长期的细胞进行实验。
1.2.2细胞增殖抑制检测 台盼蓝检测细胞活力,LBH589单独或者联合来那度胺处理RPMI8226细胞24 h,根据制造商的指导,将5×103个细胞在培养基中或不用处理的96孔板中孵育,然后向每个孔中加入20 μL的CCK8溶液。在37 ℃下孵育40 min后,使用分光光度计测量450 nm处的吸光度,作出细胞增殖抑制率的曲线。
1.2.3细胞凋亡率检测 取对数生长期的RPMI8226细胞,调整细胞密度2×105个/mL,接种于6孔板,每孔1 mL,同时设置空白对照组、LBH589组,用预冷的PBS洗涤细胞2次,加入195 μL AnnexinV-FITC结合液轻轻重悬细胞,加入5 μL膜联蛋白V-FITC,轻轻混匀。室温避光孵育10 min,1 000 r/min离心5 min,弃上清液,加入190 μL AnnexinV-FITC结合液轻轻重悬细胞。加入10 μL碘化丙啶染色液,轻轻混匀,冰浴避光放置,随即进行流式细胞仪检测,每组平行实验3次。
1.2.4Western blot检测 收集各组细胞,提取细胞总蛋白。每份样本取 40 μg总蛋白,经10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至醋酸纤维素膜上,经封闭液封闭过夜后加鼠抗人β-actin一抗(1∶500),兔抗人HO-1一抗(1∶1 000),兔抗人IRF4一抗(1∶500),兔抗人 c-Myc一抗(1∶500),兔抗人Bcl-2一抗(1∶1 000),兔抗人Bcl-xl一抗(1∶1 000),兔抗人Bax一抗(1∶1 000),兔抗人c-PARP一抗(1∶1 000),兔抗人Bad一抗(1∶1 000)室温摇膜90 min后TBST洗膜,分别加入兔IgG二抗(1∶1 000)室温孵育45 min,TBST洗膜后用ECL试剂染色后曝光,每个实验至少重复3次。
1.2.5Real-time PCR检测 使用Trizol试剂(Invitrogen,美国)从细胞株中提取总RNA。使用SYBR Green PCR Master Mix(北京天根生物)和PRISM 7500实时PCR系统(ABI,美国)进行qPCR。分析相对于β-actin基因转录物水平的基因表达水平。cDNA样品与引物和SYBR Master Mix混合,总体积为20 μL。方案中使用的热循环条件在94 ℃下1 min;随后在94 ℃下持续10 s,在60 ℃下持续15 s进行40个循环。

2 结 果
2.1LBH589与来那度胺单独或者联合作用于RPMI8226细胞后的增殖抑制率 LBH589与来那度胺分别作用于RPMI8226的增殖抑制率呈剂量依赖关系,LBH589在浓度为0.08 μmol/L时,来那度胺浓度为20 μmol/L时,作用浓度分别达到峰值。LBH589联合来那度胺比单用LBH589或者来那度胺效果明显,差异有统计学意义(P<0.05),见图1。
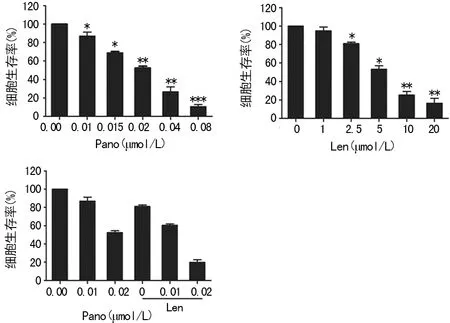
*:P<0.05,**:P<0.01,与空白对照组比较
图1 LBH589与来那度胺对RPMI8826增殖抑制率的影响
2.2LBH589和来那度胺单独或者协同诱导细胞凋亡 LBH589单独或者协同诱导RPMI8226细胞凋亡呈剂量依赖关系,RPMI8226细胞凋亡率随着LBH589浓度的增加而增加。LBH589 0.01、0.02 μmol/L时诱导RPMI8226细胞凋亡率分别为(11.6±7.42)%、(27.66±7.1)%,单独使用来那度胺2.5 μmol/L时凋亡率为(12.8±6.94)%,联合用药后,各株细胞凋亡率大幅度增长,在LBH589 0.01 μmol/L以及0.02 μmol/L,来那度胺为2.5 μmol/L

图2 LBH589与来那度胺对RPMI8826细胞凋亡的影响
时凋亡率分别为(36.4±11.1)%、(68.37±14.4)%,说明LBH589和来那度胺联合应用时,显著协同诱导凋亡作用,组间差异有统计学意义(P<0.05),见图2。

图3 LBH589与来那度胺对RPMI8826细胞凋亡相关蛋白的影响
2.3LBH589单独以及联合来那度胺作用于RPMI8226细胞后对凋亡相关Bcl-2、Bcl-xl、bad、Bax、c-PARP蛋白表达水平的影响 凋亡相关蛋白水平在LBH589与来那度胺合用时表达最低,与空白对照组(未处理组)比较,在用LBH589或者来那度胺后,细胞抗凋亡蛋白均有所下降,凋亡蛋白有所增加,见图3。

A:Western blot检测不同细胞株中IRF4蛋白的表达,以及LBH589处理后IRF4、c-MYC等蛋白的表达,以β-actin为内参;B:Realtime PCR检测不同浓度LBH589处理后IRF、c-MYC在mRNA水平上的表达。C:不同浓度LBH589单独或者联合来那度胺处理RPMI8226细胞24 h后IRF4、c-MYC等蛋白的表达,以β-actin为内参,*:P<0.05,**:P<0.01,与空白对照组比较
图4 LBH589作用于RPMI8226细胞后IRF4、c-MYC表达下降

A:使用Realtime PCR检测RPMI8226细胞与RPMI8226-R细胞HO-1与IRF4等mRNA的表达,以β-actin为内参,CCK8检测细胞的增殖抑制率;B:Western blot检测调控HO-1后IRF4、c-MYC蛋白水平的表达,以β-actin为内参;*:P<0.05,**:P<0.01,与对照组比较;C:CCK8检测LBH589单独或者联合来那度胺24 h后细胞的增殖抑制率
图5 HO-1及IRF4对LBH589作用于RPMI8226-R细胞的影响
2.4LBH589诱导RPMI8226细胞中IRF4、c-MYC转录因子的下降 Western blot检测不同来源的血液恶性肿瘤中IRF4的蛋白水平,发现IRF4在骨髓瘤细胞株中表达最高。检测相关转录基因IRF4、c-MYC等转录因子蛋白表达随LBH589浓度增高而明显减低,以β-actin为内参,与空白对照组比较,IRF4各蛋白表达随LBH589浓度增加而降低明显,见图4A。其作用浓度同Realtime PCR浓度一致,见图4B。联合使用药物后,IRF4与c-MYC表达更加低,差异有统计学意义(P<0.05),见图4C。
2.5检测RPMI8226、RPMI8226-R中HO-1、IRF4的表达,此时LBH589产生的增殖抑制率作用比IRF4表达低的明显减少(图5A)。使用Hemin 提高HO-1的表达,ZNPP降低HO-1的表达,使用Realtime PCR检测IRF4的表达,发现IRF4表达与HO-1下降的程度一致(图5B),使用LBH589单独或者联合来那度胺处理RPMI8226以及RPMI8226-R后检测发现RPMI8226-R的增殖抑制率率低于RPMI8226,差异有统计学意义(P<0.05),见图5C。
3 讨 论
本研究分别观察了广谱组蛋白去乙酰化酶抑制剂LBH589和来那度胺单独或者协同作用于骨髓瘤细胞系RPMI8226导致的增殖抑制以及凋亡的作用,结果显示LBH589与来那度胺协同抑制肿瘤细胞的增殖以及诱导凋亡的作用,但相应机制并不清楚。LBH589作为一种广谱的去乙酰化酶抑制剂,是FDA批准为治疗MM的化疗药物[3]。而来那度胺是一种免疫调节剂,已经用于MM的治疗[4],但MM患者仍然会产生耐药或者复发。目前HDACi与其他化疗药物联合治疗是诱导肿瘤细胞凋亡的主要治疗方法,并且可以有效减少肿瘤细胞的耐药以及复发[5]。为此本课题组选择使用LBH589与来那度胺联合治疗MM,并且探讨其相应的机制,结果发现,Bcl-2随着药物的作用表达逐渐下降,且Bax出现出上升趋势,在不同的效应细胞中,Bcl-2、Bax等蛋白因子在HDACi和免疫调节剂诱导肿瘤细胞凋亡中的分子机制还有待进一步的研究。
本实验中已经探查出IRF4在骨髓瘤细胞中高表达,与之前的研究一致[6],本研究也证实了IRF4在骨髓瘤中表达水平也高于其他的血液恶性肿瘤细胞,为进一步评价LBH589与来那度胺联合治疗MM的相应的机制,本研究选择了人多发性骨髓瘤细胞株RPMI8226细胞,证实随着LBH589与来那度胺单独或者联合作用时IRF4表达下降,c-MYC的表达不太明显,提示IRF4涉及LBH589和来那度胺诱导骨髓瘤凋亡的分子机制。
IRF4又称为多发性骨髓瘤癌基因1,仅表达于淋巴系统,并且参与了淋巴系统的发育[7],IRF4又是B细胞发育和功能的关键转录调节因子[8]。IRF4基因在淋巴系、造血系统等肿瘤中常常发生变异,其表达水平可作为临床相关肿瘤治疗的预后标志[5,9],此外,IRF4调控区有着c-MYC结合位点,c-MYC属于MYC家族,是一类表达较弱,但相对稳定,影响范围非常广泛的转录因子,c-MYC调控区也存在着IRF4的结合位点[10],为了更进一步地证实IRF4参与了LBH589以及来那度胺介导的凋亡作用,本课题组加用了RPMI226-R细胞株,因为RPMI8226细胞株中IRF4表达较RPMI8226-R高,由此来进一步证实IRF4参与了LBH589以及来那度胺介导的细胞增殖作用,接下来,本课题组通过CCK8实验证实了高表达的IRF4的RPMI8226-R的确影响了LBH589单独以及联合来那度胺导致的细胞增殖作用。更近一步得出LBH589单独或者联合来那度胺作用引起的细胞凋亡与IRF4降低有关,IRF4是潜在骨髓瘤药物的治疗靶点。已有研究证实激活蛋白-1(AP-1)寡聚复合体增强HO-1启动子活性[11]。BODDICKER等[12]也已经证明AP-1是IRF4的启动子,本课题组已经证实HO-1在MM以及其他血液恶性肿瘤中高表达,并且与凋亡、耐药相关[13-14]。因此笔者考虑IRF4的高表达引起的凋亡减少是否也与HO-1存在相关性,HO-1与IRF4的相关性值得进一步研究。本研究表明Hemin提高HO-1表达以及ZNPP降低HO-1的表达均可以影响MM中IRF4、c-MYC的表达水平,证实二者存在相关性。HO-1、IRF4、c-MYC三者相互之间复杂的调控环路以及在肿瘤细胞中表达的失调,考虑HO-1/IRF4/c-MYC轴可用于治疗MM的靶点,有潜力应用于今后MM的治疗,其具体分子机制有待于进一步深入研究。
综上所述,LBH589可抑制RPMI8226细胞的增殖且诱导凋亡,联合来那度胺后这种作用更明显。使用LBH589与来那度胺治疗后明显降低了IRF4以及轻微下调其下游c-MYC,使得抗凋亡蛋白Bcl-2下降以及促凋亡蛋白Bax表达增加而促进MM细胞的凋亡,HO-1是MM的一个治疗靶点,当增强或者沉默HO-1时,IRF4与c-MYC明显与HO-1的表达一致,这些数据均可表明IRF4有潜力成为去乙酰化酶抑制剂的治疗靶点,而HO-1/IRF4/c-MYC轴也有潜力用于治疗MM。
[1]MAHINDRA A,HIDESHIMA T,ANDERSON K C.Multiple myeloma:biology of the disease[J].Blood Rev,2010,24(S1):5-11.
[2]IIDA S,RAO P H,BUTLER M,et al.Deregulation of MUM1/IRF4 by chromosomal translocation in multiple myeloma[J].Nature Genetics,1997,17(2):226.
[3]FENICHEL M P.FDA Approves new agent for multiple myeloma[J].J Natl Cancer Inst,2015,107(6):165.
[4]RICHARSON P G,BLOOD E,MISTIADES C S,et al.A randomized phase 2 study of lenalidomide therapy for patients with relapsed or relapsed and refractory multiple myeloma[J].Blood,2006,108(10):3458-3464.
[5]HIDESHIMA T,COTTINI F,OHGUCH H,et al.Rational combination treatment with histone deacetylase inhibitors and immunomodulatory drugs in multiple myeloma[J].Blood Cancer J,2015,5(5):e312.
[6]RYU D,KIM H J,JOUNG J G,et al.Comprehensive genomic profiling of IgM multiple myeloma identifies IRF4 as a prognostic marker[J].Oncotarget,2016,7(30):47127-47133.
[7]OZATO K,TAILOR P,KUBOTA T.The interferon regulatory factor family in host defense:mechanism of action[J].J Biologic Chem,2007,282(28):20065-20069.
[8]ABRUZZESE M P,BILOTTA M T,FIONDA C,et al.Inhibition of bromodomain and extra-terminal (BET)proteins increases NKG2D ligand MICA expression and sensitivity to NK cell-mediated cytotoxicity in multiple myeloma cells:role of cMYC-IRF4-miR-125b interplay[J].J Hematol Oncol,2016,9(1):134.
[9]HEINTEL D,ZOJER N,SCHREDER M,et al.Expression of MUM1/IRF4 mRNA as a prognostic marker in patients with multiple myeloma[J].Leukemia,2008,22(2):441-445.
[10]DIB A,GABREA A,GLEBOV O K,et al.Characterization of MYC translocations in multiple myeloma cell lines[J].J Nati Cancer Inst Monogr,2008(39):25-31.
[11]YELIGAR S M,MACHIDA K,KALRA V K.Ethanol-induced HO-1 and NQO1 are differentially regulated by HIF-1 and Nrf2 to attenuate inflammatory cytokine expression[J].J Biol Chem,2010,285(46):35359-35373.
[12]BODDICKER R L,KIP N S,XING X,et al.The oncogenic transcription factor IRF4 is regulated by a novel CD30/NF-κB positive feedback loop in peripheral T-cell lymphoma[J].Blood,2015,125(20):3118-3127.
[13]WU W,DAN M,PING W,et al.Potential crosstalk of the interleukin-6 heme oxygenase-1 dependent mechanism involved in resistance to lenalidomide in multiple myeloma cells[J].Febs J,2016,283(5):834-849.
[14]柴其翔,韦四喜,王娅婷,等.调控血红素加氧酶-1诱导K562A02细胞增殖、凋亡及耐药机制研究[J].重庆医学,2016,45(6):727-730.
