外周静脉压在容量异常患者救治中的临床研究*
2018-05-10杨万杰冯庆国张茹梅
魏 凯,杨万杰,冯庆国,王 伟,张茹梅,李 昶
(天津市第五中心医院重症医学科 300450)
临床危重患者常处于不同的容量状态,如何准确判断是决定治疗成功与否的重要因素。中心静脉压(CVP)是临床上抢救危重症患者可选择的监测手段之一,它能够较为准确的反映机体容量及心功能变化,在诸如休克、心力衰竭等需要精确容量管理患者的救治中具有重要的指导意义[1]。然而实施过程中需要行深静脉置管,技术要求较高操作相对繁琐且存在包括血管损伤、心律失常、血气胸、导管相关感染等风险[2-3]。目前临床大多数由麻醉师或经过专门培训的医师进行,大大限制了该技术的临床应用,在临床急救过程中并不能作为常规监测手段予以普及。作为CVP的上游压力外周静脉压(PVP),由于解剖上的延续性及操作上的微创性同时兼具维护简单及费用低廉等特点,逐渐成为人们研究的热点。既往的研究对PVP能否替代CVP存在不同甚至相反的观点。本研究试图在各种不同临床条件下全面观察二者的关系,为PVP在临床危重患者应用的实际意义提供佐证。
1 资料与方法
1.1一般资料 选择2014年6月至2016年6月本科收治的患者35例,其中低血容量休克患者13例纳入休克组(休克及分期标准参考文献[4])。心功能不全伴高容量负荷(临床表现符合心功能不全特征、心脏超声提示射血分数降低、心腔扩大、下腔静脉管径增粗、胸片示肺淤血)患者12例纳入心衰组,其他原因入科但无显著容量异常患者10例纳入正常组。本研究获得本院医学伦理委员会批准且家属知情同意。由于中途拒绝及疾病因素原因2例患者被迫中止,故实际纳入研究患者33例,正常组12例,休克组11例,心衰组10例。其中男19例,女14例,年龄26~71岁,平均(48.12±22.31)岁。3组患者在性别、年龄、身高、体质量等方面资料比较差异无统计学意义(P>0.05)。
排除标准:心脏瓣膜性疾病、因透析存在人工动静脉瘘、存在中心静脉解剖异常、置管部位感染、静脉曲张、静脉炎或静脉血栓形成。
1.2方法
1.2.1CVP的监测 所有患者均取仰卧位,三腔中心静脉导管(7F,Sungwon,韩国)置入右锁骨下静脉,内置深度15~17 cm,缝线固定于皮肤,选择中心静脉导管的主腔与测压管及压力传感器连接,测压管路内充满肝素生理盐水,压力传感器再与监护仪模块相连接,在监护仪上定义为CVP1(CVP)并实时显示波形及压力数值。调零点设置为右心房水平,即腋中线与第四肋间相交处,于该处做一标记,如遇患者体位调整,调零点始终对应该点。
1.2.2PVP的监测 同侧肢体外展45~60°,经肘正中静脉置入18G外周静脉导管(30 mm,B-D,美国),选择外周静脉时尽可能选用粗且直的血管。连接方法及调零点的设置与CVP监测方法相同,且压力传感器与相同监护仪模块相连接,在监护仪上设定为CVP2(PVP),同样实时显示波形及压力数值。
1.2.3压力监测数据采集 所有患者均自主呼吸并在呼气末进行数据采集,每隔1小时记录1次,每例患者总共采集10组配对数据。为了尽可能减少外来因素对PVP测量的影响,对于低体温患者通过升温毯达到正常体温后才进行数据采集,遇外部环境低温时液体进行适当加热,所有患者均使用右侧肢体进行压力测量,左侧肢体进行输液,如休克患者需快速输液时通过侧孔进行且确保测压时输液速度小于200 mL/h以避免对压力测量带来误差[5]。输液时避免对测压侧外周静脉输入收缩及舒张血管药物。读取压力值时确定患者肢体不受外来压力压迫,无寒战及抽搐等情况发生。为了尽可能减少个人主观因素对研究带来误差,所有数据均有相同的两人读取后共同确定。

2 结 果
2.1CVP与PVP的相关性 相关性分析显示,综合3组数据分析PVP与CVP存在显著正相关(r=0.974,P<0.01),见图1。对各组数据分别进行分析显示休克组相关性(r=0.791)低于心衰组(r=0.944)。

图1 总体数据中CVP与PVP的相关性
2.2不同容量状态下CVP与PVP比较 对于不同容量状态下测量的PVP值而言,休克组低于正常组(P<0.05),心衰组高于正常组(P<0.01);3组中 PVP均高于配对的CVP,其中休克组差异显著(P<0.05);对于压力偏移度(Bias),休克组较心衰组或正常组偏移显著(P<0.05),心衰组与正常组相比较其偏移度更低,但二者差异无统计学意义(P>0.05),见表1。
2.3PVP与CVP同一性比较 综合3组所有数据Bland-Altman分析显示其同一性限定范围(limit of agreement,LOA)幅度大且不在LOA范围内数据比例高。对3组数据独立分析显示心衰组中大部分数据在LOA范围内且波动幅度临床可接受,而正常组中数据有相当比例处于LOA范围外,休克组中除相当多数据在LOA范围外,LOA幅度波动大临床不可接受,见图2。
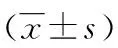
表1 不同容量状态下两种压力比较
※:P<0.05,▲:P<0.01,◆:P<0.05,与正常组比较;*:P<0.05,与心衰组比较
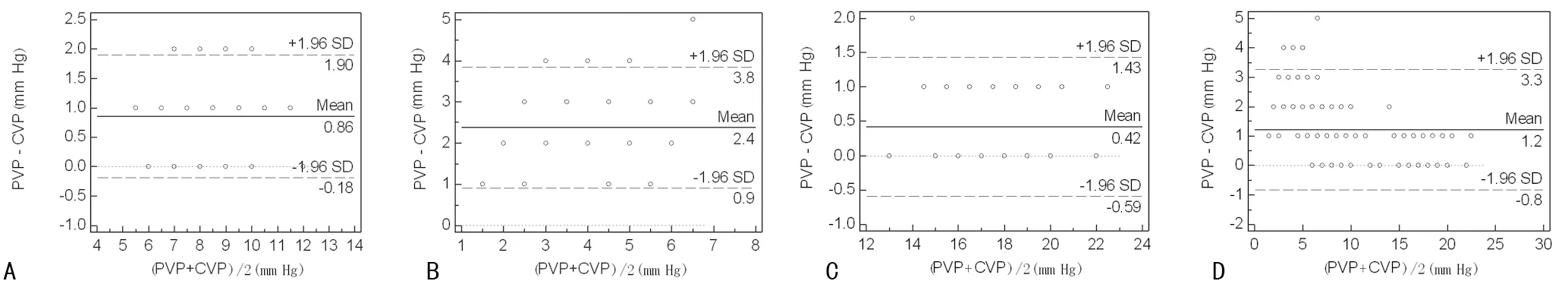
A:正常组;B:休克组;C:心衰组;D:总数据
图2两种压力测量数据的Bland-Altman分析
3 讨 论
CVP由于能够较为准确地判断机体容量,常用于危重症患者的临床监测,然而由于可能面临的各种风险让该项技术的应用受到限制。现今人们开始从更加微创、安全的角度寻求替代方法,其中经上肢PVP监测是目前研究的热点。既往为数不多的研究中人们发现PVP与CVP存在关联。结直肠癌患者手术过程中二者存高度一致性,偏移仅为0.9 mm Hg[6]。MASUTANI等[7]观察到围术期患者两种压力高度相关,烧伤患者中观察到低的偏移值[8],重症机械通气患者中同样发现相关性显著[9]。相似的研究结果并不仅仅局限于成人患者,AMOOZGAR等[10]在对先天性心脏病患儿的研究中发现二者高度一致。一段时间内PVP等同并替代CVP的呼声很高。然而另一些学者得出相反的结论,脊柱手术患者中二者差值可以到达7 mm Hg[11]。在一些危重患者当中PVP甚至可以高于CVP 10.6 mm Hg[12]。PISSOT等[13]综合既往研究分析后得出结论PVP与CVP的相关性差,LEIPOLDT等[14]在各种年龄段儿童并扩大病种的情况下分析表明两种压力同一性范围甚至达到了8.8 mm Hg,远远超过临床接纳程度。因此学者们又认为PVP并不能替代CVP进行精确评估。仔细梳理文献笔者发现上述研究纳入观察对象时各专科高选择性突出且大多数并没有涉及研究时机体的容量状态,而压力与容量本身就关系密切,故全面审视二者关系有必要在更大范围且更严格的条件下进行深入探索。
本研究通过对各种容量状态下进行的两种压力关系的全面综合分析表明,总体而言 PVP与CVP存在显著相关性,即便是在休克状态压差较大情况下相关性仍较高。那么高相关性是否可以认为具备高同一性呢?分析显示,就PVP值而言低容量及高容量状态下分别低于和高于正常容量,其趋势特点与CVP所代表的容量特征相似。但对于所有的配对压力PVP始终高于CVP,这与大多数现有研究类似。笔者认为在连续性血流状态下PVP作为上游压力在促使静脉回流过程中高于CVP并不足为奇,然而这种压力偏移在本研究中表现为在不同情况下并不恒定。3组中心衰状态下偏移度最小与既往研究类似[15],而休克状态下二者偏移度最大。究其原因笔者认为可能处于心衰高容量状态下患者的静脉充盈度更佳,由于受静脉瓣及血管瘪陷等因素干扰小,由外周到中心的压力传递性更加顺畅导致压力下降的幅度减少故偏移度下降。研究中观察到二者非常接近。相反,低容量休克状态下有效循环血量显著减少,交感-肾上腺轴兴奋后释放大量儿茶酚胺导致包括小动脉、小静脉在内的外周及内脏血管强烈收缩,循环血容量重新分布以达到维持心、脑等重要脏器有效灌注的目的[16]。上述变化可导致外周血管阻力显著升高,PVP升高明显故偏移增大,研究中观察到大的压力跨度。在综合3组数据进一步行Bland-Altman分析,并结合临床同时参考相关文献标准[17],其偏移的幅度超过了目前临床可接受的程度,相当比例的数据不在LOA范围内,也就是说放在所有容量状态这个大环境下进行考量的话,笔者认为PVP与CVP的同一性差,以PVP替代CVP使用可靠性不高。然而在接下来对各组细分下进行的分析中显示,在心衰高容量状态这个小环境下绝大多数数据却在一致性范围内且波动幅度临床可接受,二者的同一性较好,提示在心衰高容量条件下应用PVP替代CVP进行监测的可靠性较高。
综上所述,本研究表明尽管PVP与CVP存在很好的相关性,但并不能简单地认为所有情况下PVP可等同于CVP,仅在高血容量状态下二者的可替代性较好。在临床救治心力衰竭并高血容量状态患者过程中,PVP监测对治疗具有重要的指导意义。
当然本研究尚存在不足之处,尽管使用的是配对研究但都是处于静态的压力观察中,缺乏二者对液体负荷试验或利尿后动态变化趋势特点,其他外周置管部位在不同容量状态下的压力特点并未涉及,对于低容量组中严重休克患者没有纳入研究,且样本量小有待于今后扩大研究范围及增大样本量深入研究。
[1]SCHUMMER W.Central venous pressure.validity,informative value and correct measurement[J].Anaesthesist,2009,58(5):499-505.
[2]TSOTSOLIS N,TSIRGOGIANNI K,KIOUMIS I,et al.Pneumothorax as a complication of central venous catheter insertion[J].Ann Transl Med,2015,3(3):40.
[3]GARCIA G C,CASTILLO A,HINNOIO M B,et al.Multicenter descriptive study of complications associated to central venous catheters in hematology patients[J].Enferm Clin,2015,7(15):21-22.
[4]姚咏明.急危重症病理生理学[M].北京:科学出版社,2013:511-536.
[5]HO A M,DION P W,KARMAKAR M K,et al.Accuracy of central venous pressure monitoring during simultaneous continuous infusion through the same catheter[J].Anaesthesia,2005,60(10):1027-1030.
[6]KIM S H,PARK S Y,CUI J,et al.Peripheral venous pressure as an alternative to central venous pressure in patients undergoing laparoscopic colorectal surgery[J].Br J Anaesth,2011,106(3):305-311.
[7]MASUTANI S,KURISHIMA C,YANA A,et al.Assessment of central venous physiology of Fontan circulation using peripheral venous pressure[J].J Thorac Cardiovasc Surg,2016,19(16):31800-31801.
[8]SHERIF L,JOSHI V S,OLLAPALLY A,et al.Peripheral venous pressure as a reliable predictor for monitoring central venous pressure in patients with burns[J].Indian J Crit Care Med,2015,19(4):199-202.
[9]KUMAR D,AHMED S M,All S,et al.Correlation between central venous pressure and peripheral venous pressure with passive led raise in patients on mechanical ventilation[J].Indian J Crit Care Med,2015,19(11):648-654.
[10]AMOOZGAR H,AJAMI G H,BORZUOEE M,et al.Peripheral venous pressure as a predictor of central venous pressure in continuous monitoring in children[J].Iran Red Crescent Med J,2011,13(5):342-345.
[11]BOMBARDIERI A M,BECKMAN J,SHAW P,et al.Comparative utility of centrally versus peripherally transduced venous pressure monitoring in the perioperative period in spine surgery patients[J].J Clin Anesth,2012,24(7):542-548.
[12]CHARALAMBOUS C,BARKER T A,ZIPITIS C S,et al.Comparision of peripheral and central venous pressure in critically Ⅲ patients[J].Anaesth Intensive Care,2003,31(1):34-39.
[13]PISSOT M,SALVADORI A,KEARNS K,et al.Central venous pressure and peripheral venous pressure,however correlated are still both in the gray-area[J].Indian J Crit Care Med,2016,20(1):58-59.
[14]LEIPOLDT C C,MCKAY W P,CLUNIE M A.Peripheral venous pressure predicts central venous pressure poorly in pediatric patients[J].Can J Anaesth,2006,53(12):1207-1212.
[15]CAVE G,HARVEY M.The difference between peripheral venous pressure and central venous pressure (CVP) decreases with increasing CVP[J].Eur J Anaesthesiol,2008,25(12):1037-1040.
[16]THOMOVSKY E,JOHNSON P A.Shock pathophysiology[J].Compend Contin Educ Vet,2013,35(8):E2.
[17]MYLES P S,CUI J.Using the Bland-Altman method to measure agreement with repeated measure[J].Br J Anaesth,2007,99(3):309-311.
