抗人FXYD6特异性多肽单克隆功能性抗体制备及生物学作用鉴定
2018-05-10陈雄飞袁俊建张执全郭忠健刘汝海李凤山
陈雄飞,袁俊建,张执全,郭忠健,郭 尧,刘汝海,李凤山
(河北省沧州市中心医院:1.普外一科;2.病理科;3.中心实验室 061001)
包含转运调节因子(FXYD)结构域的FXYD6蛋白作为FXYD家族蛋白成员之一,为Ⅰ型跨膜蛋白,通过调节钠、钾泵的活性发挥部分生物学功能[1],其在神经元中高表达,利于突触体信号转导[2],在维持神经元正常形态和功能方面发挥了重要作用[3],且FXYD6与精神分裂症相关[4]。同时,FXYD6作为一种肿瘤相关蛋白,在胆管癌[5-6]、肝癌[7]、鼻咽癌[8]等恶性肿瘤中高表达,可促进人骨肉瘤细胞增殖与侵袭[9]。为研究FXYD6蛋白的组织学分布和生物学作用,并为相关肿瘤的靶向治疗奠定实验基础,本课题组现制备抗人FXYD6特异性多肽单克隆功能性抗体库,并对其胞外区单克隆抗体生物学作用进行鉴定。
1 材料与方法
1.1材料 人FXYD6胞内区-G4S-FXYD6胞外区-G4S-GST-His6TAG基因序列的原核表达质粒、BSA-FXYD6胞外区偶联蛋白(中国华大蛋白基因有限公司合成);大肠杆菌BL21(中国北京康润诚业生物技术公司);Ni Sepharose 6 Fast Flow纯化柱(中国GE Healthcare生物科学公司);SPF级BALB/c小鼠(中国科学院遗传所动物实验中心);SP2/0小鼠骨髓瘤细胞(中国华大基因蛋白生物有限公司);pcDNA3.1-FXYD6质粒(前期制备);293T细胞株、HepG2细胞株(ATCC中科院生物物理所冻存);胎牛血清,1640培养基,次黄嘌呤、甲氨喋呤、胸腺嘧啶核苷(HAT)培养基、次黄嘌呤、胸腺嘧啶核苷(HT)培养基、聚乙二醇(美国Sigma公司);抗体亚类试剂盒(美国Southern Biotech公司);鼠抗Myc单克隆抗体、辣根过氧化物酶标记的羊抗鼠免疫球蛋白G(IgG)抗体、鼠单克隆抗体IgG(中国北京中杉金桥生物技术有限公司);二氨基联苯胺(DAB)试剂盒(中国武汉博士德生物工程有限公司);Western blot高灵敏度化学发光检测试剂盒(中国北京康为世纪生物有限公司);异硫氰酸荧光素(FITC)标记山羊抗小鼠IgG(H+L,中国上海碧云天生物技术有限公司);健康人脑颞叶组织、肝癌组织、正常肝组织(沧州市中心医院病理科留存的石蜡标本)。
1.2方法
1.2.1抗原蛋白的表达 将人FXYD6胞内区-G4S-FXYD6胞外区-G4 S-GST-His6TAG 基因序列的原核表达质粒转入表达载体BL21(DE3),BL21菌生长至对数期后,0.5 mmo/L异丙基-β-8-D硫代半乳糖(IPTG)诱导,为诱导组,同时设未加ITPG的非诱导组,37 ℃培养4 h,离心收菌,制备蛋白样品,12%的十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,考马斯亮蓝染色,脱色后观察表达蛋白条带。
1.2.2抗原蛋白纯化 离心收集IPTG诱导后的BL21菌,25 mmol/L Tris 150 mmol/L、NaCl的裂解液重悬,冰上超声破碎,离心,分离制备上清液和沉淀,蛋白制品 SDS-PAGE,考马斯亮染色,脱色后发现目的蛋白主要集中在上清液中。上清液流经Ni-NTA金属螯合柱行层析纯化,30 mmol/L咪唑磷酸盐缓冲液(PBS)洗脱杂蛋白,200 mmol/L咪唑PBS洗脱目的蛋白,将目的蛋白超滤换至PBS并浓缩。
1.2.3动物免疫 参照脾内注射方法[10],选择6~8周龄的SPF级BALB/c雌性小鼠,脾脏内注射50 μg抗原蛋白,免疫7 d后,小鼠内眦取血,间接酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测小鼠血清抗体效价,初次免疫2周后用抗原蛋白每只30 μg腹腔注射冲击免疫达到效价要求的小鼠。
1.2.4杂交瘤细胞融合、筛选、鉴定 取加强免疫3 d后的BALB/c小鼠的脾细胞与SP2/0小鼠骨髓瘤(1∶5),应用聚乙二醇(PEG)细胞融合法进行融合,HAT培养基筛选融合细胞,有限稀释法筛选阳性克隆,即用FXYD6重组蛋白及标签蛋白通过间接ELISA法筛选针对重组FXYD6抗原有免疫反应的杂交瘤细胞株,同时去除对标签蛋白有免疫反应的杂交瘤细胞株,即得到针对分泌FXYD6胞内区或胞外区单抗的杂交瘤细胞株。抗体亚类测定试剂盒检测杂交瘤分泌抗体亚型,应用BSA-FXYD6胞外区多肽通过间接ELISA方法在分泌FXYD6胞内区或胞外区特异性强的单克隆抗杂交瘤中筛选针对其分泌胞外区单抗的细胞株,阳性反应的即为分泌胞外区单抗的杂交瘤细胞株,阴性反应的即为分泌胞内区单抗的杂交瘤细胞株。间接ELISA法测定FXYD6单抗的特异性与效价,用于特异性鉴定的非相关抗原包括FXYD1、FXYD2、FXYD3、FXYD4、FXYD5、FXYD7。选取分泌特异性强及效价高的针对胞外区多肽的单克隆杂交瘤行后续实验。
人脑颞叶组织、肝癌、正常肝组织经甲醛固定、石蜡包埋、4 μm连续切片,常规脱蜡、水化、抗原修复后,在0.3%过氧化氢溶液中避光30 min,5%马血清封闭1 h后,滴加已筛选出针对胞外区或胞内区的杂交瘤分泌的上清液(1∶3稀释),4 ℃过夜,1∶200的生物素标记马抗小鼠IgG 37 ℃孵育1 h,1∶200的辣根过氧化物标记链卵白素37 ℃孵育40 min,DAB显色,苏木精复染,逐级脱水,中性树脂封片,显微镜下观察单抗与组织中FXYD6结合情况。
1.2.5阳性杂交瘤染色体数目分析 取对数生长期杂交瘤细胞,终浓度0.25 μmol/L秋水仙素处理2 h,离心收集细胞,37 ℃低渗KCl溶液处理15 min,加入甲醇、冰醋酸固定液(3∶1)固定4 min,离心,弃去上清液。在细胞沉淀中加入固定液,室温静置30 min后离心,弃去上清液。重复该步骤。滴加细胞悬液到4 ℃载玻片上,室温自然干燥后用10%的Giemsa溶液染色30 min,洗去染液,二甲苯通透、中性树脂封片,镜下观察选择分散良好和完整的中期分裂象并照相,统计染色体平均数目(计数大于或等于50个细胞染色体/样品)。
1.2.6FXYD6胞外区单克隆抗体制备 BALB/c小鼠腹腔注射500 μL石蜡油,1周后腹腔注射1 mL PBS洗涤并定量5×105~9×105/mL分泌胞外区单抗的杂交瘤细胞。1周后取腹水,离心,应用蛋白G亲合层析法纯化抗体,间接ELISA法测抗体效价。
1.2.7FXYD6胞外区单克隆抗体功能性检测 取对数生长期的293T细胞,以1×105/mL接种24 h后,瞬时转染质粒pcDNA3.1-FXYD 6∶2 μg质粒pcDNA3.1-FXYD6稀释于500 μL Opti-MEM中,另一培养皿加500 μL培养基作对照(未转染组),混匀后加入2 μL Lipofectamine 2000转染试剂,轻柔混匀,室温放置15 min,6 h后更换成DMEM培养基,再培养30 h,制备蛋白样品,用Myc单抗和胞外区单抗Western blot检测真核质粒瞬转后的293T细胞FXYD6的表达。收集已转染后的293T细胞,0.3%BSA洗涤细胞后加入以PBS稀释的胞外区单克隆抗体(1∶200 PBS稀释),以小鼠IgG作为空白对照,4 ℃孵育45 min,0.3%BSA 洗涤,加入FITC标记山羊抗小鼠IgG(H+L),4 ℃避光孵育30 min,0.3%BSA 洗涤,细胞重悬于PBS,行流式细胞仪检测。
取对数生长期高表达FXYD6蛋白的HepG2细胞[8],以4×103/mL,100 μL接种于96孔板完全培养基中,每孔加入不同浓度的FXYD6胞外区单克隆抗体(终浓度分别为5、10、20 μg/mL),每组设3个复孔,同时设小鼠单抗IgG同型对照组,继续培养24 h后每孔加入20 μL MTT(5 mg/mL),培养5 h,弃上清液,每孔200 μL PBS洗涤,加入100 μL DMSO溶解蓝紫色结晶颗粒后测定A490。实验重复3次。
2 结 果
2.1抗原蛋白诱导表达 经SDS-PAGE、脱色后,诱导组较非诱导组出现明显的梭形条带,表达出目的蛋白相对分子质量与预期相符,见图1。

1、2、3、5:诱导组;4:非诱导组;M:蛋白marker
2.2抗原蛋白的纯化 全菌经超声破碎后,SDS-PAGE检测目的蛋白主要集中在上清液中(图2)。因重组蛋白含有His标签,选用镍柱纯化目的蛋白,在实验过程中发现目的蛋白与镍柱结合较弱,较低浓度咪唑就可以将目的蛋白洗脱,确定以30 mmol/L咪唑洗脱杂蛋白,高浓度咪唑洗脱目的蛋白,超滤换PBS后,目的蛋白经SDS-PAGE检测纯度达90%左右,见图3。

1:上清液;2:沉淀;M:蛋白marker

1:上清液;2:穿透液;3:穿透液;4:200 mmol/L咪唑洗脱液;5:纯化的目的蛋白;M:蛋白marker
2.3杂交瘤细胞株的建立及单克隆抗体鉴定 经过1年的反复冻存和复苏培养,成功筛选出3株稳定分泌效价高、特异性强的FXYD6单克隆抗体的杂交瘤,这3株阳性杂交瘤行Giemsa染色,镜下观察均有106条染色体,为脾淋巴细胞和小鼠骨髓瘤细胞染色体数量之和。2株杂交瘤细胞分泌针对胞内区的单克隆抗体,抗体亚型分别为IgG2a、IgG2b,轻链均为k链;1株杂交瘤细胞分泌针对胞外区的单克隆抗体,抗体亚型为IgG1,轻链为λ链。制备的3株杂交瘤的上清液均可以识别脑组织中的神经元细胞,神经元弥漫着色,细胞核未见着色,而胶质细胞未见明显着色(图4A),肝癌组织较正常肝组织高表达FXYD6蛋白,见图4B、C。

A.FXYD6蛋白在神经元细胞中表达(×400); B.FXYD6蛋白在肝癌细胞中高表达(×400);C.FXYD6蛋白在正常肝细胞中不表达(×100)
2.4FXYD6胞外区单抗功能性检测 流式细胞实验发现FXYD6胞外区单克隆抗体可以特异性识别真核表达载体pcDNA3.1-FXYD6瞬转293T细胞表达的天然构象人FXYD6蛋白(图5),真核表达质粒瞬转293T细胞后表达的人FXYD6蛋白位于14×103~20×103。FXYD6胞外区单克隆抗体可以抑制肝癌HepG2细胞增殖,中浓度(10 μg/mL)单抗较低浓度(5 μg/mL)单抗对肿瘤细胞增殖有明显的抑制作用,比较差异有统计学意义(P<0.05),有一定的浓度依赖性,然而高浓度(20 μg/mL)单抗较中浓度(10 μg/mL)单抗抑制细胞增殖不明显(图6)。新制备的FXYD6胞外区单抗为功能阻断性抗体。

A:FCM检测;B:Western blot检测。1:未转染组;2、3:转染组;2:Myc单抗;3:FXYD6胞外区单抗
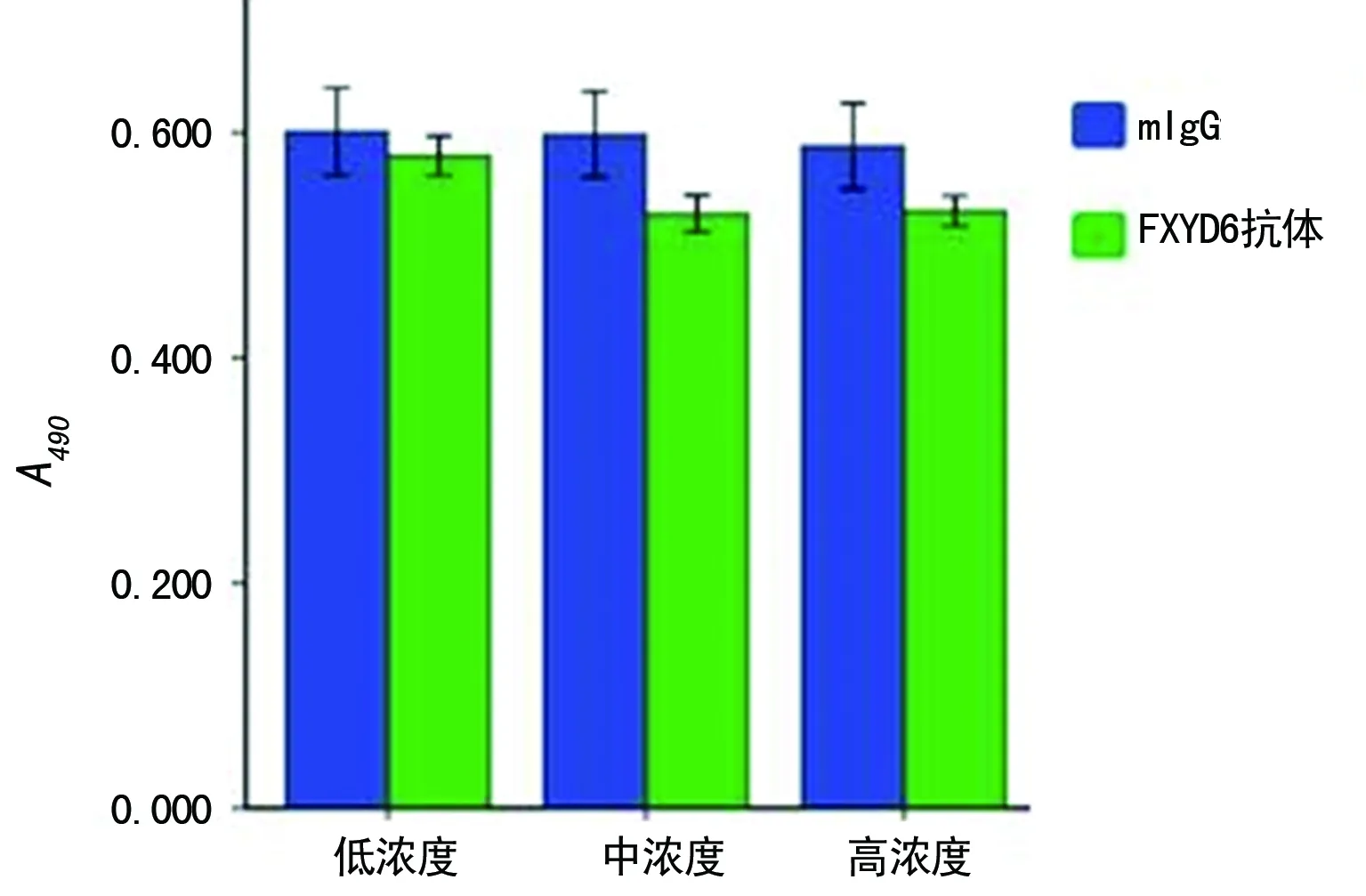
图6 FXYD6胞外区单克隆抗体抑制HepG2细胞增殖
3 讨 论
FXYD家族蛋白是跨膜蛋白,因其胞外近跨膜区含较固定的PFXYD氨基酸序列而得名[11]。通过调节不同钠钾泵同工酶发挥部分功能,而FXYD2本身就是Na,K-ATPase γ亚基[12]。部分成员还是肿瘤相关蛋白,与某些肿瘤的发生、发展相关。FXYD3在多种肿瘤中高表达,与直肠癌放疗抵抗、局部复发相关,是直肠癌患者预后较差的指标[13]。FXYD5是表达于多种癌细胞和少量正常细胞表面的糖化膜蛋白,通过下调E-钙黏素促进肿瘤细胞侵袭、转移,其高表达与不良预后密切相关[14]。FXYD6蛋白没有糖基化及磷酸化[11]。本研究通过原核表达制备有效的抗原片段来制备识别天然构象抗原的单克隆抗体,在对抗原设计时去除蛋白功能区中的跨膜序列;胞内区、胞外区氨基酸序例串联与GST融合表达,不仅有助于抗原蛋白的正确折叠,将FXYD6胞外区和胞内区序列完全暴露于融合蛋白表面,提高抗原的免疫原性,同时也提高目的蛋白可融性,便于后续蛋白纯化。
大肠杆菌BL21表达出的目的蛋白稳定性高,不易被降解。本实验中构建的人FXYD6胞内区-G4S-FXYD6胞外区-G4S-GST-His6TAG基因序列表达载体转入宿主菌BL21,诱导获得FXYD6重组蛋白可溶性的高效表达。因重组蛋白有His标签,本研究选用镍柱纯化蛋白,重组蛋白与镍柱结合力较弱,选用30 mmol/L咪唑洗脱杂蛋白,高浓度咪唑洗脱目的蛋白,浓缩、超滤换PBS液后,获得高纯度的FXYD6重组蛋白。
LIU等[15]制备的单抗不能识别天然构象的抗原蛋白,为非功能性胞外区单抗。基于此,本研究用纯化的重组FXYD6抗原免疫小鼠,制备针对胞外区或胞内区的单克隆抗体,同时以期获得识别天然构象功能性胞外区单克隆抗体。本实验采用小鼠直接脾内注射免疫的方法,此法周期短,抗原直接接触免疫细胞,有免疫原性和反应性强的特点[11]。加强免疫后,将小鼠骨髓瘤细胞和脾淋巴细胞融合,筛选出融合的杂交瘤细胞株后再用标签蛋白筛选去除对标签蛋白或串联多肽序列有阳性反应的杂交瘤,即得到分泌针对FXYD6胞内区或胞外区单抗的杂交瘤,BSA-FXYD6胞外区多肽筛选出分泌胞外区单抗杂交瘤细胞株。在对FXYD6胞外区单抗特异性鉴定中发现:制备的单抗与其他FXYD蛋白无明显交叉反应;可以特异性识别脑组织中的FXYD6蛋白。本研究还发现FXYD6蛋白在肝癌组织中高表达;FXYD6胞外区单克隆抗体可以特异性识别天然构象的FXYD6蛋白。
近期研究发现FXYD6蛋白与多种肿瘤相关,FXYD6过表达可促进肝癌细胞和骨肉瘤细胞侵袭与转移[8,10]。在对FXYD6胞外区单抗功能进行研究的实验中,本研究发现其可抑制高表达FXYD6蛋白的肝癌HepG2细胞增殖,其抑制作用与制备的胞外区单抗有一定的浓度依赖性,胞外区单抗属于阻断性抗体,然而高浓度单抗较中浓度单抗抑制细胞增殖作用无明显差异。
总之,本研究成功制备了分泌针对FXYD6胞内区或胞外区的单抗杂交瘤细胞株,并制备了FXYD6胞外区功能阻断性单抗,这为研究FXYD6蛋白的组织分布、具体作用机制和一些肿瘤的靶向治疗奠定了良好基础。
[1]MIYASHITA T,AKIYAMA K,INAMOTO R,et al.Presence of FXYD6 in the endolymphatic sac epithelia[J].Neurosci Lett,2012,513(1):47-50.
[2]BIESEMANN C,GRNBORG M,LUQUET E,et al.Proteomic screening of glutamatergic mouse brain synaptosomes isolated by fluorescence activated sorting[J].EMBO J,2014,33(2):157-170.
[3]SHIINA N,YAMAGUCHI K,TOKUNAGA M.RNG105 deficiency impairs the dendritic localization of mRNAs for Na+/K+ATPase subunit isoforms and leads to the degeneration of neuronal networks[J].J Neurosci,2010,30(38):12816-12830.
[4]ZHONG N,ZHANG R,QIU C,et al.A novel replicated association between FXYD6 gene and schizophrenia[J].Biochem Biophys Res Commun,2011,405(1):118-121.
[5]CHEN X F,SUN M Z,HU Y Z,et al.FXYD6 is a new biomarker of cholangiocarcinoma[J].Oncol Lett,2014,7(2):393-398.
[6]陈雄飞,周宁新,张红红.FXYD6在肝门胆管癌中的表达及临床意义[J].中国普外基础与临床杂志,2016,23(11):1344-1347.
[7]GAO Q,CHEN X F,DUAN H X,et al.FXYD6:a novel therapeutic target toward hepatocellular carcinoma[J].Protein Cell,2014,5(7):532-543.
[8]李征,何剪太.FXYD6蛋白在鼻咽癌组织中的表达[J].中国耳鼻咽喉颅底外科杂志,2011,17(4):252-254,258.
[9]LI Z M,ZHANG H Y,WANG Y X,et al.MicroRNA-137 is downregulated in human osteosarcoma and regulates cell proliferation and migration through targeting FXYD6[J].J Drug Target,2016,24(2):102-110.
[10]任瑞敏,王云龙,张怡青,等.利用改良后的脾内免疫和半固体培养基法制备单克隆抗体[J].生物技术通报,2013(8):166-169.
[11]GEERING K.FXYD proteins:new regulators of Na-K-ATPase[J].Am J Physiol Renal Physiol,2006,290(2):F241-250.
[12]GAUT J P,CRIMMINS D L,LOCKWOOD C M,et al.Expression of the Na+/K+-transporting ATPase gamma subunit FXYD2 in renal tumors[J].Mod Pathol,2013,26(5):716-724.
[13]LOFTAS P,ARBMAN G,SUN X F,et al.FXYD-3 expression in relation to local recurrence of rectal cancer[J].Radiat Oncol J,2016,34(1):52-58.
[14]BIASIOTTA A,D′ARCANGELO D,PASSARELLI F,et al.Ion channels expression and function are strongly modified in solid tumors and vascular malformations[J].J Transl Med,2016,14(1):285.
[15]LIU J,ZHOU N X,ZHANG X D.A monoclonal antibody against human FXYD6[J].Hybridoma (Larchmt),2011,30(5):487-490.
