TACE联合三氧化二砷治疗原发性肝癌45例疗效观察
2018-05-10敬方园李玉伟
敬方园,舒 健,李玉伟
(西南医科大学附属医院:1.放射科;2.介入科,四川泸州 646000)
原发性肝癌是我国常见消化系统肿瘤之一,起病隐匿,早期症状无特异性,大部分患者发现时已是中晚期,仅15%~20%有手术切除的机会[1]。目前经动脉化疗栓塞术(TACE)是不适合手术的中晚期原发性肝癌的首选[2]。当前,临床使用的TACE灌注药物尚无统一标准。三氧化二砷(As2O3)可抑制肿瘤新生血管形成、肿瘤侵袭及转移,对肝实质的损失小,不良反应轻[3]。本研究比较TACE时联合灌注As2O3与单用TACE之间疗效的差异,现将研究结果报道如下。
1 资料与方法
1.1一般资料 收集2014年12月至2016年6月于本院介入科就诊后诊断为中晚期原发性肝癌(根据中晚期肝癌分期的标准[4])的患者90例(随访时间至2017年3月)。其中,男72例,女18例,年龄48~83岁,平均61.9岁。根据TACE灌注化疗药物的不同分为两组,研究组使用奥沙利铂、氟尿嘧啶及As2O3,对照组使用奥沙利铂、氟尿嘧啶、吡柔比星。研究组45例,男37例,女8例,平均年龄61.2岁;中期38例,晚期7例;伴有肝硬化30例,乙型病毒性肝炎25例,肝功能异常15例,腹水6例,肺转移5例,骨转移3例,门静脉癌栓3例,腔静脉癌栓1例。对照组45例,男35例,女10例,平均年龄62.6岁;中期34例,晚期11例;伴有肝硬化32例,乙型病毒性肝炎39例,肝功能异常13例,腹水10例,肺转移8例,骨转移5例,门静脉癌栓5例,腔静脉癌栓3例。术前凝血功能正常,血小板大于或等于80×109/L,白细胞计数大于或等于4×109/L,总胆红素小于1.5×正常上限值,谷丙转氨酶小于2.0×正常上限值。本研究已取得医院伦理委员会同意。两组患者的基本资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
纳入标准:(1)经影像学、实验室检查或病理、细胞学检查,临床诊断为原发性肝癌;(2)符合BCLC中晚期分期标准[4];(3)无法外科手术切除;(4)肝功能Child-Pugh A级或B级;(5)介入手术前1个月内未进行任何抗肿瘤治疗;(6)Karnofsky≥60分,预计生存期大于或等于3个月;(7)对本研究知情,自愿参加并签署同意书;(8)随访资料完整。排除标准:(1)合并与原发性肝癌无关,可能影响病情的其他疾病;(2)患有不能配合临床治疗的精神疾病;(3)对砷剂过敏。
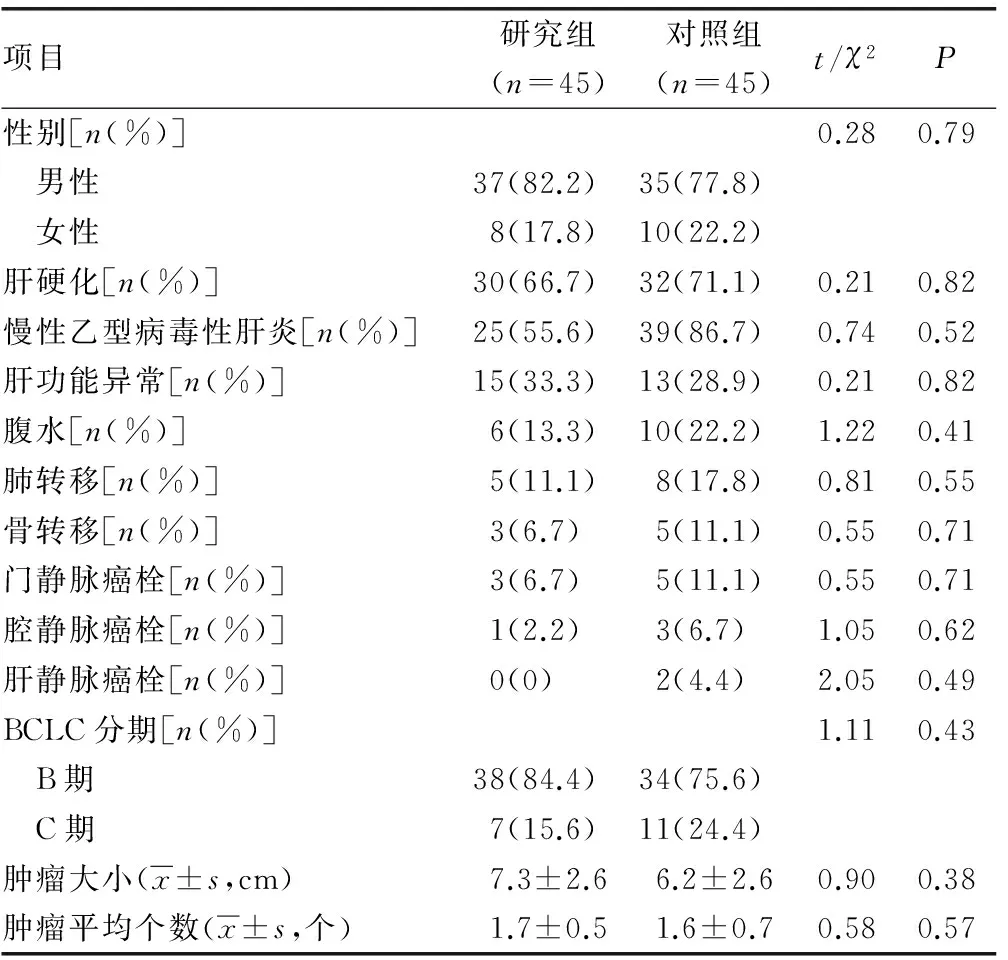
表1 研究组与对照组基本资料比较
1.2方法
1.2.1设备与仪器 X射线数字减影血管造影机(TOSHIBA/RTP14301J-GIE)、高压注射器(TOSHIBA/MARK-V型)、64层螺旋CT(GELight speed 64层螺旋CT)、穿刺针机血管鞘组、5 F RH、猪尾巴导管、3 F微导管、0.035英寸型超滑导丝(日本TERUMO公司)。

图1 原发性肝癌采用TACE联合As2O3治疗前后的增强CT影像
1.2.2治疗方法 通过Seldinger法置导管于肝固有动脉,造影后明确是否存在肝动静脉瘘、血管变异,再置入微导管超选至肿瘤供血动脉,缓慢灌注化疗药物。两组均使用奥沙利铂[100 mg,赛诺菲安万特(杭州)制药有限公司]+氟尿嘧啶(1 g,天津金耀安极端有限公司),研究组使用As2O3碘油乳剂(As2O310 mg/m2,北京双鹭药业股份有限公司);对照组使用吡柔比星碘油乳剂(吡柔比星20 mg,深圳万乐药业有限公司),碘油5~15 mL(法国GUERBET公司),灌注时间至少20 min,待栓塞结束后再次造影明确肿瘤栓塞效果,视情况追加明胶海绵及PVA颗粒。研究组、对照组使用明胶海绵及PVA颗粒分别为23、25例,两组之间比较差异无统计学意义(t=0.18,P=0.83)。术后6~8周复查腹部增强CT、血常规、生化、甲胎蛋白。若发现肿瘤残余活性灶,则再行TACE,直至未发现肿瘤残余活性灶,之后每6~8周来院定期复查。若未发现肿瘤残余活性灶,则不行TACE,直至发现肿瘤复发、转移。所有患者至少行2次TACE。
1.2.3疗效评价标准 疗效评价按照mRECIST标准[5]。完全缓解(CR):所有目标病灶动脉期增强显影均消失;部分缓解(PR):目标病灶(动脉期增强显影)的直径总和缩小大于或等于30%;病灶稳定(SD):缩小未达PR或增加未到PD;病灶进展(PD):目标病灶的直径总和增加大于或等于20%或出现新病灶;客观有效率(RR)=CR+PR的发生率;疾病控制率(DCR)=CR+PR+SD的发生率。2次TACE术后进行疗效评价。

2 结 果
2.1近期疗效 研究组45例,其中CR 5例,PR 21例,SD 13例,PD 6例,RR为57.7%,DCR为86.6%;对照组45例,其中CR 3例,PR 20例,SD 14 例,PD 8例,RR为51.1%,DCR为82.2%,两组RR和DCR比较差异无统计学意义(P>0.05)。研究组的增强CT图像见图1。
2.2肿瘤PFS 研究组与对照组的肿瘤PFS见图2,两组中位肿瘤无进展生存期(mPFS)分别为10个月和7个月,比较差异有统计学意义(P<0.01)。

图2 两组的肿瘤PFS比较
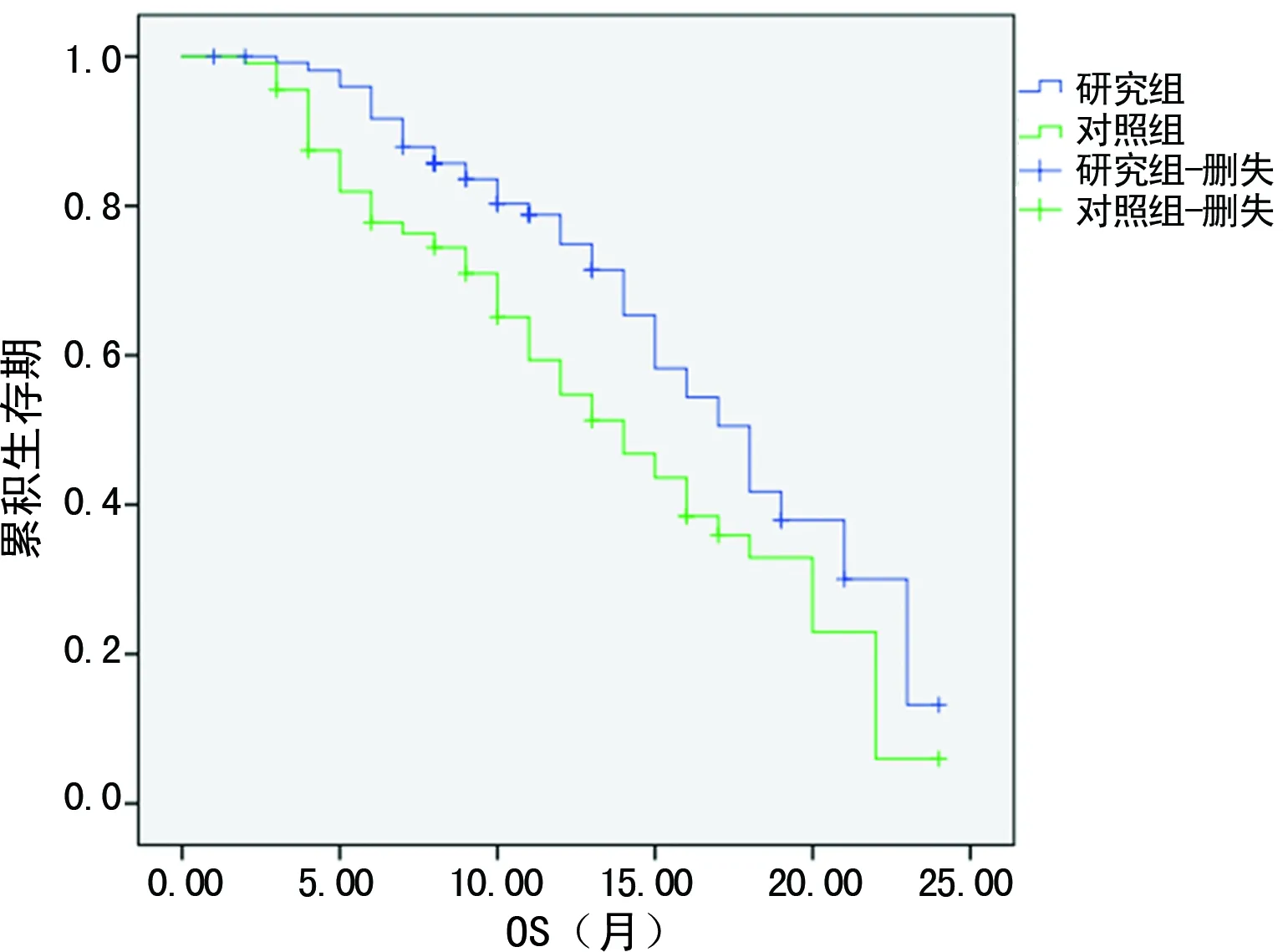
图3 两组的OS比较
2.3OS 研究组与对照组的OS见图3,两组中位总生存期(mOS)分别为18.0个月和14.0个月,比较差异有统计学意义(P<0.01)。
3 讨 论
原发性肝癌发病率位于恶性肿瘤的第5位,病死率位于癌性死亡的第3位[6],近年来发病率有增高趋势[5]。单纯TACE疗效欠佳,因此栓塞时加入抗肿瘤药物,使其缓慢释放,诱导肿瘤细胞分化的同时促进其凋亡,还降低了此类药物全身使用的不良反应[7]。抗肿瘤药物的选择很大程度上会影响生存的结果[8]。铂类化疗药物联合TACE治疗原发性肝癌的疗效较好,已广泛运用于临床[9]。As2O3是砒霜的重要成分,早期用于治疗急性早幼粒白血病,效果显著。近年来国内外对As2O3用于肝癌的抗肿瘤治疗进行了许多研究,明确了As2O3有诱导肿瘤细胞凋亡,抑制肿瘤细胞生长的作用,而且对正常肝细胞及肝功能影响小[10]。
目前国内外关于TACE联合As2O3治疗原发性肝癌的报道尚少。FORNER等[6]对As2O3联合TACE治疗原发性肝癌进行了Meta分析,他们认为此种治疗方案是有效、安全的。孟艳莉等[11]对60例结节型或弥漫性原发性肝癌进行研究,治疗组在首次TACE后3 d给予As2O3静脉滴注,连用2周,间歇3周后再行下一周期治疗,对照组单纯行TACE,两组客观有效率分别为36.7%、23.3%,无明显差别,前者的mPFS(8个月)明显长于后者(4个月),远期疗效较明确。WANG等[12]通过分析周期性静脉使用As2O3对TACE术后原发性肝癌患者的疗效是否有差异,提出TACE联合周期性静脉输注As2O3(10 mg/d,21 d,间隔2周,共4个周期)治疗原发性肝癌疗效可观,能降低肝外转移发生率,延长患者生存时间。由此可见静脉使用As2O3疗效可观。但是全身静脉使用As2O3治疗周期和住院时间长,住院费用昂贵,而我国大部分患者经济条件不乐观,因此周期性静脉使用As2O3的临床可行性仍有待商榷。
本研究旨在探讨动脉灌注As2O3治疗原发性肝癌的疗效及临床可行性。研究结果显示,研究组与对照组的RR和DCR无明显差异,近期疗效相近,与张新保等[13]的研究结果稍有出入,这可能与本研究病例数较少有关,尚需要进一步大样本的研究来证实。于翔等[14]通过分析104例中晚期原发性肝癌患者,发现观察组(奥沙利铂、氟脲苷、As2O3)的中位生存时间高于对照组(奥沙利铂、氟脲苷、吡柔比星),分别为12.78、7.97个月,指出含有As2O3的TACE方案疗效更佳,可延长患者生存时间。胡琴等[15]收集53例中晚期原发性肝癌病例,通过研究比较后得出试验组(含As2O3)mOS 14个月,对照组(不含As2O3)11个月,因此TACE联合灌注As2O3可延长原发性肝癌患者的生存时间,与本研究中研究组的肿瘤mPFS、mOS长于对照组结果相符。这可能有以下3个方面的原因:(1)As2O3可通过多种途径影响肝癌细胞的侵袭与转移,从而抑制肝癌的复发与扩散,使病灶局限化[16];(2)As2O3可阻断肝癌肿瘤干细胞自我更新的进程,并提高肿瘤干细胞对其他化疗药物的敏感性,增强TACE的疗效[17];(3)As2O3可以通过减少调节T细胞对肿瘤的渗透,从而缩小肿瘤的体积和质量[18]。在2017年,LV等[19]对As2O3联合TACE治疗原发性肝癌进行了Meta分析后再次说明As2O3联合TACE比不含As2O3的TACE疗效更佳。综上所述,本研究认为TACE联合灌注As2O3较不灌注As2O3更能有效抑制肿瘤进展,延长患者的生存时间,并且也有研究指出动脉灌注As2O3不良反应小,疗效好,治疗周期及住院时间较短,经济负担较小,临床应用前景可观[20-21]。
本研究仍存在不足之处,病例数较少,随访时间较短,相关研究结果仍需大样本、长期的随访进一步佐证。
需要重视的是As2O3具有剂量依赖性毒性[22],其用量是影响疗效与毒副反应的关键,如何在提高疗效的同时降低毒副作用是临床应用的重点,值得进一步研究。
[1]LAU W Y,LAI E C.Hepatocellular carcinoma:current management and recent advances[J].Hepatobiliary Pancreat Dis Int,2008,7(3):237-257.
[2]MURATA S,MINE T,SUGIHARA F,et al.Interventional treatment for unresectable hepatocellular carcinoma[J].World J Gastroenterol,2014,20(37):13453-13465.
[3]孟艳莉,胡鸿涛,黎海亮,等.三氧化二砷联合动脉化疗栓塞治疗原发性肝癌肺转移的临床疗效观察[J].中华内科杂志,2012,51(12),971-974.
[4]BRUIX J,SHERMAN M.Management of hepatocellular carcinoma[J].Hepatology,2005,42(10):1208-1236.
[5]PARK J O,LEE S I,SONG S Y,et al.Measuring response in solid tumors:comparison of RECIST and WHO response criteria [J].Jpn J Clin Oncol,2003(33):533-537.
[6]FORNER A,LLOVERT JM,BRUIX J.Hepatocellular carcinoma[J].Lancet,2012(379):1245-1255.
[7]JOHNSTON F M,MAVROS M N,HERMAN J M,et al.Local therapies for hepatic metastases[J].J Natl Compr Canc Netw,2013,11(2):153-160.
[8]SHI M,LU L G,FANG W Q,et al.Roles played by chemolipiodolization and embolization in chemoembolization for hepatocellular carcinoma:single-blind,randomized trial[J].J Natl Cancer Inst,2013,105(1):59-68.
[9]WANG Y,SHEN Y.Unresectable hepatocellular carcinoma treated with transarterial chemoembolization:clinical data from a single teaching hospital[J].Int J Clin Exp Med,2013,6(5):367-371.
[10]LUO Q,LI Y,DENG J,et al.PRP-1 inhibitor sensitizes arsenic trioxide in hepatocellular carcinoma cells via abrogation of G2/M checkpoint and suppression of DNA damage repair[J].Chem Biol Interact,2015,226(25):12-22.
[11]孟艳莉,黎海亮,郭晨阳,等.三氧化二砷联合经肝动脉化疗栓塞治疗多结节型或弥漫型原发性肝癌的临床研究[J].介入放射学杂志,2015,24(8):680-683.
[12]WANG H,LIU Y,WANG X,et al.Randomized clinical control study of locoregional therapy combined with arsenic trioxide for the treatment of hepatocellular carcinoma[J].Cancer,2015,121(17):2917-2925.
[13]张新保,谢建功,谭章梅,等.含三氧化二砷介入方案治疗原发性肝癌的临床研究[J].影像诊断与介入放射学,2011,20(1):58-60.
[14]于翔,李刚,顾露,等.三氧化二砷经导管肝动脉化疗栓塞介入治疗中晚期肝癌临床疗效及安全性观察[J].实用医院临床杂志,2017,14(2):49-51.
[15]胡琴,韦永明,管睿,等.TACE联合三氧化二砷治疗原发性肝癌的临床研究[J].现代肿瘤医学,2014,22(11):2679-2681.
[16]WANG G Z,ZHANG W,FANG Z T,et al.Arsenic trioxide:marked suppression of tumor metastasis potential by inhibiting the transcription factor twist in vivo and in vitro[J].J Cancer Res Clin Oncol,2014,40(7):1125-1136.
[17]ZHANG K Z,ZHANG Q B,SUN H C,et al.Arsenic trioxide induces differentiation of CD133+hepatocellular carcinoma cells and prolongs posthepatectomy survival by targeting GLI1 expression in a mouse Model[J].J Hematol Oncol,2014,30(7):28.
[18]WANG L,WANG R,FAN L,et al.Arsenic trioxide is an immune adjuvant in liver cancer treatment[J].Mol Immunol,2017,1(81):118-126.
[19]LV X H,WANG C H,XIE Y.Arsenic trioxide combined with transarterial chemoembolization for primary liver cancer:a meta-analysis[J].J Gastroenterol Hepatol,2017,3(15):13789
[20]ZHOU J.Arsenic trioxide:an ancient drug revived[J].Chin Med J(Engl),2012,125(19):3556-3560.
[21]彭贵主,叶啟发,王垒.三氧化二砷治疗肝癌的出路——联合用药[J].肝胆胰外科杂志,2017,28(6):441-447.
[22]JIAO Y H,ZHANG Q,PAN L L,et al.Rat liver mitochondrial dysfunction induced by an organic arsenical compound 4-(2-nitrobenzaliminyl) phenyl arsenoxide[J].J Membr Biol,2015,248(6):1071-1078.
