胶原水凝胶与基质胶作为骨组织工程支架材料表面涂层修饰效果的比较研究▲
2018-05-10朱永佳缪志康韦庆军
朱永佳 靳 攀 何 熠 缪志康 韦庆军*
(1 广西医科大学第一附属医院;2 广西生物医药协同创新中心,南宁市 530021)
骨缺损是骨科手术的挑战。骨替代物,支架的作用是创造细胞微环境进而模拟体内情况,并影响着增殖、分化和凋亡等细胞过程的必要条件。天然骨组织包括羟基磷灰石(HA)和胶原蛋白。目前胶原材料已引起人们的广泛关注且用于骨组织工程。I型胶原蛋白具有良好的生物相容性,可作为大分子药物缓慢释放的载体[1-2],其制作方法包括矿化[3]、热触发组装[4]、真空渗透[5]、冻干及超临界点干燥[6]。基质胶,是一种基底膜提取物,被广泛应用于肿瘤转移的研究中[7],其表面涂层可用于提高支架的成骨活性等生物学功能[8-9],但目前针对这两种材料的比较研究尚未有报道。
本研究通过碱性磷酸酶检测、组织学染色以及RT-PCR检测成骨特异性基因的表达水平比较胶原水凝胶及基质胶的效果,以此来寻找更合适的骨组织工程支架涂层修饰材料。现报告如下。
1 材料与方法
1.1 原代成骨细胞的分离提取 3~7 d日龄SD乳鼠购自广西医科大学实验动物中心,且后续操作均获得广西医科大学伦理委员会批准。用颈椎脱臼法处死SD乳鼠,无菌环境下用灭菌纱布取出顶骨,浸于灭菌磷酸盐缓冲液(PBS)中,然后用0.25%胰蛋白酶-乙二胺四乙酸(EDTA)(北京索莱宝生物技术有限公司)在37℃消化30 min除去结缔组织及骨膜。将顶骨剪成1 mm3的碎片后,用Ⅰ型胶原酶(Gibco,Thermo Fisher Scientific,Inc.,Waltham,MA,USA)37℃下孵育4 h。800 g离心5 min后,将细胞重悬于含有10%(v/v)胎牛血清(FBS,Gibco)和1%青霉素/链霉素溶液(青霉素100 U/mL,链霉素100 U/mL)的培养基中,置于37℃ 5% CO2培养箱中培养,选择第3代细胞用于后续实验。
1.2 水凝胶制备和细胞接种 胶原水凝胶储备液呈酸性,不利于细胞生长。为了获得适宜细胞生长的水溶液,将氢氧化钠溶液逐滴滴入酸性的胶原水凝胶储备液中至pH 7.0。基质胶(Becton Dickinson,USA)在4℃环境下融化至液态。在24孔板中加入20 μL凝胶及在6孔板中加入100 μL凝胶,均匀覆盖于底部,待固化后,在24孔板及6孔板分别接种2×104细胞及5×104细胞培养。
1.3 细胞活性检测 细胞活性通过荧光素二乙酯(FDA,Genway Biotech Inc,USA)/碘化丙啶(PI,Sigma,USA)染色检测。用PBS洗涤3次后,将细胞与2 μM FDA和2 mg/L PI室温避光环境中分别温育5 min,后通过激光扫描共聚焦显微镜(LSCM, Nikon A1, Japan)拍摄图像。
1.4 细胞形态分析 培养2、4、6 d后,经多聚甲醛固定30 min,并依次用苏木精-伊红(HE,南京建成生物技术有限公司)进行细胞染色。最后用中性树胶密封,用倒置相差显微镜观察并拍照。
1.5 ALP染色和ALP活性测定 按说明书分别用ALP染色试剂盒和ALP检测试剂盒(均购自南京建成生物工程研究所)进行2、4、6 d碱性磷酸酶(ALP)染色和ALP细胞活性测定,观察染色情况并用倒置相差显微镜拍摄图像。同时,用不含蛋白酶抑制剂(1 mM)的细胞裂解液(RAPI)提取每个样品的总蛋白,在12 000 rpm离心15 min后,收集培养基的上清液用于检测。加入试剂标准液、显色剂水浴和着色后,用酶标仪在520 nm处检测吸光度值,随后将值换算成金氏单位,实验重复3次。
1.6 茜素红染色 培养2、4、6 d后,用PBS洗涤细胞,用4%多聚甲醛(PFA)固定30 min,并在37℃用1 mL 0.1%茜素红S(Sigma,USA,pH8.3)持续染色30 min。随后,用流水轻轻去除过量染料,用倒置相差显微镜进行图像拍摄。
1.7 免疫组化检测 将细胞用4%多聚甲醛固定30 min,加入3% H2O230 min以消除内源性过氧化物酶,与山羊血清在37℃温育30 min以阻断非特异性结合。用Ⅰ型胶原(1 ∶100,Boster,武汉)抗体在4℃孵育过夜后,加入Cy3-抗-兔IgG二抗(1 ∶100,Boster,武汉)。用DAB孵育并用苏木精复染后,将细胞风干,中性树脂密封,并用倒置相差显微镜拍照。
1.8 RNA的提取和qRT-PCR检测 用qRT-PCR检测骨形态发生蛋白2(Bmp2)、runt相关转录因子2(Runx2)、碱性磷酸酶(Alp)、骨钙素(Ocn)、骨桥蛋白(Opn)和1型胶原蛋白(Col1a1)的表达。使用RNA提取试剂盒(Megentec,广州)提取总RNA。从1 μg RNA开始,使用Fast Start Universal SYBR Green Master Mix(Invitrogen,CA,USA)扩增的逆转录试剂盒(Fermentas Company,USA)合成20 μg cDNA。本实验中使用的引物见表1。通过使用比较2-ΔΔCt方法将基因表达标准化为Gapdh。每个样品重复3次以减少标准差。

表1 PCR引物序列表
1.9 统计学分析 所有数据均使用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较使用单因素方差分析(ANOVA)和最小显著差异(LSD)进行分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞活性检测 通过FDA/PI染色测定细胞活性。如图1所示,活细胞染成绿色,死细胞染成红色。与对照组相比,胶原组和基质胶组中发现更多活的成骨细胞,其中胶原组活细胞数量明显高于基质胶组,说明胶原对成骨细胞活性具有积极作用。
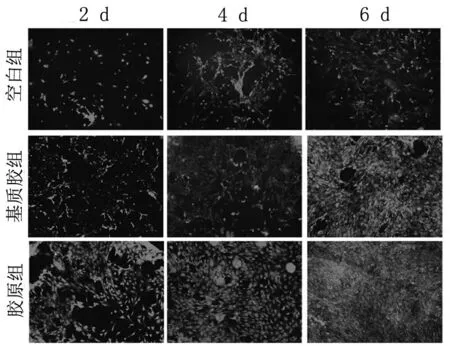
图1 空白组、基质胶组及胶原组的FDA/PI染色(活细胞显示绿色,死细胞显示红色,200×)
2.2 细胞形态分析 HE染色观察三组成骨细胞的形态(图2)。细胞质染成红色,细胞核染成蓝色。随时间增加,各组成骨细胞数目增多,其中胶原组细胞形态与数目均优于其他组。
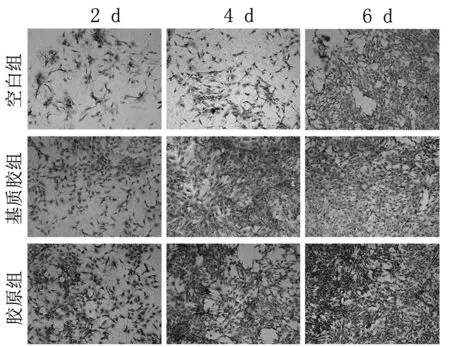
图2 空白组、基质胶组及胶原组的HE染色(200×)
2.3 ALP染色和ALP活性测定 作为骨形成的标志物,ALP与成骨分化有关。所有组中ALP染色程度均随时间增加(见图3),其中胶原组ALP染色程度明显高于其他两组。ALP活性从第2天至第6天持续增加,在胶原组中更为明显(见图4)。ALP定性及定量结果分析均表明胶原水凝胶更适合成骨细胞的生长。
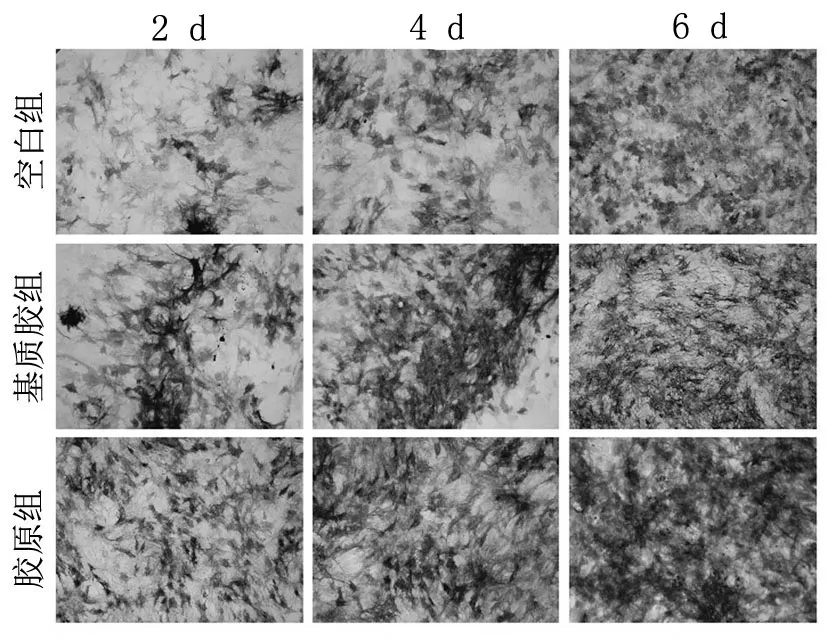
图3 空白组、基质胶组及胶原组的碱性磷酸酶染色(200×)
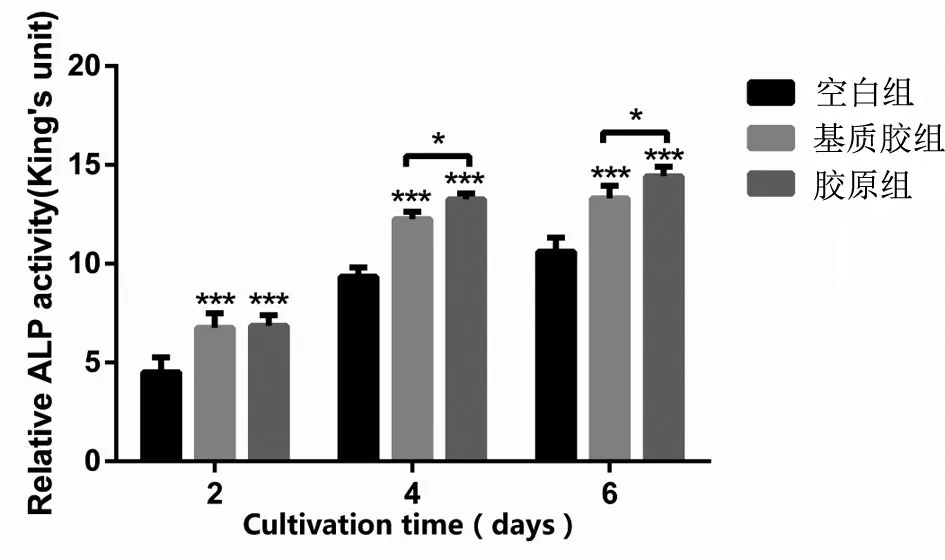
图4 空白组、基质胶组及胶原组成骨细胞内碱性磷酸酶活性检测(*代表P<0.05,**代表P<0.01,***代表P<0.001)
2.4 茜素红染色 使用茜素红染色来评估成骨细胞的矿化结节,基质胶组和胶原组在第2天及第4天没有发现明显差异。然而,在第6天,与对照组和基质胶组相比,胶原组明显增强了矿化作用,其产生了更多的矿化结节(见图5)。
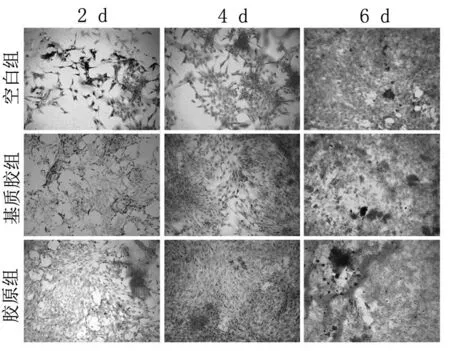
图5 空白组、基质胶组及胶原组的茜素红染色(200×)
2.5 免疫组化检查 Ⅰ型胶原蛋白被认为是骨形成中特异性的蛋白,本研究用免疫组织化学方法评估Ⅰ型胶原蛋白。结果显示,胶原组比其他组呈现更明显的阳性结果;同时,基质胶组中的阳性表达高于对照组(见图6)。
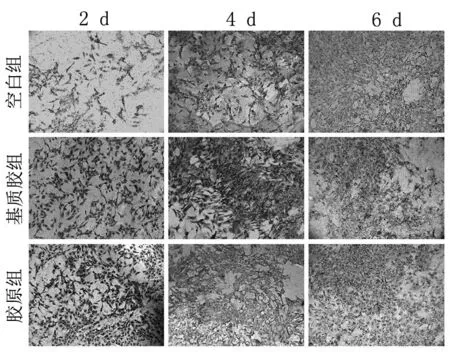
图6 空白组、基质胶组及胶原组的Ⅰ型胶原免疫组化染色(200×)
2.6 基因表达分析 成骨特异性基因Alp、Ocn和Col1a1在胶原蛋白组中明显上调(见图7),表明胶原有利于成骨;胶原组中随时间增加Col1a1的mRNA水平表明胶原可以通过外源性添加触发内源基因编码程序。
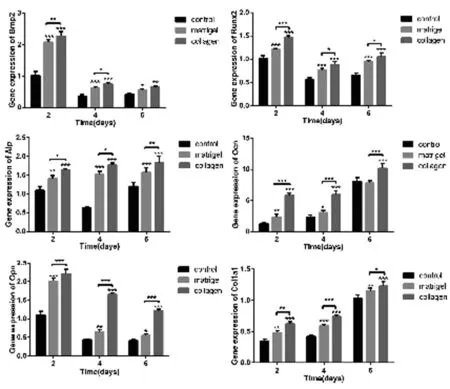
图7 Bmp2、Runx2、Alp、Ocn、Opn和Col1a1的相对表达情况(*代表P<0.05,**代表P<0.01, ***代表P<0.001)
3 讨 论
胶原水凝胶及基质胶均具有良好的生物相容性和极低的细胞毒性,有助于创造一个复杂的模拟体内的细胞微环境,它们被推荐作为表层细胞支架涂层修饰使用[7]。然而,目前还没有研究比较它们对细胞成骨分化的影响。
如图1所示,随着时间的推移,成骨细胞在胶原涂层比在基质胶涂层数量增加更显著,demon阐述了胶原涂层在细胞生存方面比基质胶涂层更有优势[10]。与FDA/PI染色一致,更多的细胞聚集在胶原涂层上,尤其是第4~6天(图2)。由成骨细胞产生并参与到无机焦磷酸盐的降解过程中,为矿化的发生提供足够的磷酸盐或无机焦磷酸盐,ALP通常作为骨生成的标记来反映成骨分化的程度[11-12]。图3中的ALP染色和图4中的ALP活性分析都表明在胶原组中有更多的ALP分泌,这与图7中Alp的mRNA水平一致。图5显示第 6天的茜素红染色矿化结节,证实了这两种涂层方法的成骨效应。Ⅰ型胶原作为细胞外基质的主要有机象,促进了细胞的附着、增殖和分化[13-14]。在图6中,利用免疫组织化学染色检测到的Ⅰ型胶原蛋白水平,与图7的基因表达相一致。骨钙素(Ocn)和骨桥蛋白(Opn)都是成骨分化的特征性标志物。Ocn是一种由成骨细胞分泌的特异性蛋白,是骨细胞分化良好的标志[15]。Opn被认为是细胞粘附因子,其分泌主要在骨形成过程的早期阶段[16]。图7所示,Ocn从第2天到第6天持续增加,而Opn在第2天达到峰值,与前期研究一致[15]。BMP-2信号通路是调节骨再生的主要通路之一[17],并通过BMP/Smad信号通路调节Runx2的表达和功能[18-20]。本研究中,胶原组Bmp2和Runx2在第2天显著上调了,并在第4天到第6天保持相对稳定的水平。实验中检测的基因表达表明了胶原涂层能够促进骨细胞分化,胶原蛋白的外源性增生可以引发和诱导基因编码程序和胶原蛋白的内源性分泌。
综上所述,本研究发现,与基质胶涂层比较,胶原水凝胶涂层更有利于骨形成且更适合在骨组织工程中作为细胞支架表面修饰材料,推荐其作为骨组织工程支架材料常用表面涂层材料。
[1] Masalskas BF,Martins JúniorW,Leoni GB,et al. Local delivery of strontium ranelate promotes regeneration of critical size bone defects filled with collagen sponge[J]. J Biomed Mater Res A,2018,106(2):333-341.
[3] Lawson AC,Czernuszka JT. Collagen-calcium phosphate composites[J].Proc Inst Mech Eng H,1998,212(6):413-425.
[4] Pederson AW,Ruberti JW,Messersmith PB. Thermal assembly of a biomimetic mineral/collagen composite[J].Biomaterials,2003,24(26):4881-4890.
[5] Werner J,Linner-Krcmar B,Friess W,et al.Mechanical properties and in vitro cell compatibility of hydroxyapatite ceramics with graded pore structure[J]. Biomaterials,2002,23(21):4285-4294.
[6] NieL,Chen D,Suo J,et al. Physicochemical characterization and biocompatibility in vitro,of biphasic calcium phosphate/polyvinyl alcohol scaffolds prepared by freeze-drying method for bone tissue engineering applications[J]. Colloids Surf B Biointerfaces,2012,100:169-176.
[7] Benton G,Arnaoutova I,George J,et al. Matrigel: from discovery and ECM mimicry to assays and models for cancer research[J]. Adv Drug Deliv Rev,2014,79-80:3-18.
[8] Jung YJ,Kim KC,Heo JY,et al. Induction of Angiogenesis by Matrigel Coating of VEGF-Loaded PEG/PCL-Based Hydrogel Scaffolds for hBMSC Transplantation[J]. Mol Cells,2015,38(7):663-668.
[9] Wang M,Deng Y,Zhou P,et al. In Vitro culture and directed osteogenic differentiation of human pluripotent stem cells on peptides-decorated two dimensional microenvironment[J]. ACS Appl Mater Interfaces,2015,7(8):4560-4572.
[10] Jiang T,Zhou B,Huang L,et al. Andrographolide Exerts Pro-Osteogenic Effect by Activation of Wnt/β-Catenin Signaling Pathway in Vitro[J]. Cell PhysiolBiochem,2015,36(6):2327-2339.
[11] Na K,Kim SW,Sun BK,et al. Osteogenic differentiation of rabbit mesenchymal stem cells in thermo-reversible hydrogel constructs containing hydroxyapatite and bone morphogenic protein-2 (BMP-2)[J].Biomaterials,2007,28(16):2631-2637.
[12] Li Y,Jiang T,Zheng L,et al. Osteogenic differentiation of mesenchymal stem cells (MSCs) induced by three calcium phosphate ceramic(CaP)powders: A comparative study[J].Mater Sci Eng C Mater Biol Appl,2017,80:296-300.
[13] Haimov H,Yosupov N,PinchasovG,et al. Bone Morphogenetic Protein Coating on Titanium Implant Surface: a Systematic Review[J]. JOralMaxllofac,2017,8(2):e1.
[14] Viguet-Carrin S,Garnero P,Delmas PD. The role of collagen in bone strength[J]. Osteoporos Int,2006,17(3):319-336.
[15] Nakamura A,Dohi Y,Akahane M,et al. Osteocalcin secretion as an early marker of in vitro osteogenic differentiation of rat mesenchymal stem cells[J]. Tissue Eng Part C Methods,2009,15(2):169-180.
[16] Mckee MD,Pedraza CE,Kaartinen MT. Osteopontin and wound healing in bone[J]. Cells Tissues Organs,2011,194(2-4):313-319.
[17] Benisch P,Schilling T,Klein-Hitpass L,et al. The transcriptional profile of mesenchymal stem cell populations in primary osteoporosis is distinct and shows overexpression of osteogenic inhibitors[J]. Plos One,2012,7(9):e45142.
[18] HanaiJ,Chen LF,Kanno T,et al. Interaction and functional cooperation of PEBP2/CBF with Smads. Synergistic induction of the immunoglobulin germline Calphapromoter[J]. JBiol Chem,1999,274(44):31577-31582.
[19] Javed A,Barnes GL,Jasanya BO,et al. runt homology domain transcription factors (Runx,Cbfa,and AML) mediate repression of the bone sialoprotein promoter: evidence for promoter context-dependent,activity of Cbfaproteins[J]. Mol Cell Biol,2001,21(8):2891-2905.
[20] Nishimura R,Hata K,Harris SE,et al. Core-binding factor alpha 1 (Cbfa1) induces osteoblastic differentiation of C2C12 cells without interactions with Smad1 and Smad5[J]. Bone,2002,31(2):303-312.
