基于QbD理念的雷公藤总三萜微波提取工艺研究
2018-05-09,,,,,,
,,,,,,
(浙江工业大学 药学院,浙江 杭州 310014)
雷公藤为卫矛科雷公藤属植物雷公藤(TripterygiumwilfordiiHook.f)干燥根,主产于云南、贵州、湖南、安徽、浙江和福建等地[1].在中国已有几千年的应用历史,最早记载于《神农本草经》,味辛、苦、性凉,入肝、脾二经,通十二经络,皮有毒,药用其木质部,具有清热解毒、祛风通络、舒筋活血、消肿止痛、杀虫止血等功效[2].目前已从雷公藤中成功分离出200多种化学成分[3],主要活性成分为二萜类、三萜类和生物碱类[4].其中三萜类成分具有较好的药理活性,毒性较小.雷公藤类制剂工艺过程复杂,三萜类成分总含量较低,最终产品质量难以保持一致.传统的中药煎煮法、索氏提取法、回流提取法等方法应用于雷公藤提取过程中,均显现出损失大、工序多、溶剂用量大和耗时长等缺点.近年来超声提取、超临界萃取和加压溶剂法提取等技术[5-7]的发展为雷公藤提取过程带来了新思路,而微波提取技术在雷公藤有效部位提取等过程中的应用鲜有报道.微波是频率为300 MHz~300 GHz的电磁波,在传输过程中微波电磁场瞬时作用于极性分子物质,产生的热效应使能量快速传递得到充分利用,从而迅速、有效地提取出植物中的有效成分.笔者将微波技术应用于雷公藤总三萜的提取中,微波提取技术在植物根提取过程中与其他新型技术相比较,具有快速高效、选择性好、能耗少、加热均匀和应用面广等明显优势[8].
雷公藤成分复杂,不同产地药材、制剂工艺和生产厂家的产品中有效成分及有效部位的含量存在明显差异性[9-10].因此本研究考虑将质量源于设计(Quality by design, QbD)理念[11]应用于雷公藤总三萜微波提取工艺,建立设计空间,进一步提高工艺过程可控性[12],获得符合质量的产品.笔者将干膏率和总三萜提取率作为关键质量属性,采用Plackett-Burman实验设计筛选出的关键工艺参数,通过Box-Behnken实验设计研究雷公藤微波提取工艺过程的关键工艺参数和关键质量属性之间的数学模型,建立设计空间并进行验证.在设计空间内操作能有效提高雷公藤总三萜微波提取产品质量一致性,为提高工艺过程控制水平提供了理论依据与新的思路[13]。
1 材 料
BS124(0.1 mg)电子天平(赛多利斯);微波合成仪(908010,美国CEM);酶标仪(Infinite®200 Pro NanoQuant,瑞士Tecan);96孔板;齐墩果酸对照品(阿拉丁,批号:C10109992,≥98.0%);其他试剂均为分析纯;雷公藤药材由浙江普洛康裕天然药物有限公司提供.
2 方 法
2.1 雷公藤总三萜提取方法
称取雷公藤药材5.0 g,加入一定量相应体积分数的乙醇溶剂微波提取,离心,取上清液旋干,即得.
2.2 雷公藤总三萜测定方法及方法学验证
2.2.1 对照品溶液的制备
精密称定齐墩果酸对照品3.03 mg,甲醇溶解并定容至10 mL,制得0.303 0 mg/mL的对照品储备液.
2.2.2 供试品溶液的制备
取微波提取后各雷公藤提取物,加甲醇定容至10 mL,即为供试品溶液.精密吸取供试品溶液50 μL于10 mL试管中,水浴挥干溶剂.加入0.4 mL新鲜配制的V(香兰素)∶V(冰乙酸)=1∶20的香兰素-冰乙酸和1.0 mL高氯酸显色,振摇均匀.置于65 ℃水浴中加热15 min,取出,冷却至室温.精密移取冰乙酸5.0 mL稀释,摇匀.在酶标仪546 nm处,测定吸光度值.通过线性回归方程计算样品溶液中雷公藤总三萜的含量.
2.2.3 线性关系考察
精密量取齐墩果酸储备液(0.303 0 mg/mL)0.2,0.4,0.6,0.8,1.0,1.2 mL于10 mL试管中,水浴挥干溶剂.照2.2.2中的方法进行显色,以试剂空白作为参比溶液,546 nm处测定吸光度值.以齐墩果酸质量浓度(mg/mL)为横坐标X,吸光度值为纵坐标Y,得回归方程Y=2.838 7X-0.008 2,R2=0.996 5.齐墩果酸在0.060 6~0.363 6 mg/mL质量浓度范围内与吸光度线性关系良好.
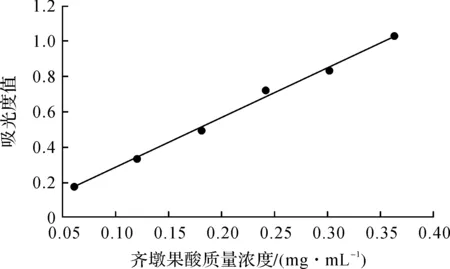
图1 齐墩果酸标准曲线Fig.1 Standard curve for determination of Oleanolic acid by UV
2.2.4 精密度试验
从同一份雷公藤提取物样品中,照2.2.2中的方法显色,分别精密吸取定容后的供试品溶液5 份50 μL于10 mL试管中,测定吸光度值,计算相对标准偏差RSD为1.85%,仪器精密度良好.
2.2.5 稳定性试验
雷公藤提取物样品,照2.2.2中的方法显色,精密吸取定容后的供试品溶液分别在0,4,12,24 h时测定吸光度值,计算相对标准偏差RSD为2.33%,样品稳定性良好.
2.2.6 重复性试验
准确称量雷公藤药材5 份,照2.1中的方法制备供试品溶液,照2.2.2中的方法测定吸光度值,计算相对标准偏差RSD为2.03%,该方法重复性良好.
2.3 实验设计
2.3.1 关键工艺参数筛选
确定雷公藤总三萜提取物以干膏率(%)、总三萜提取率(%)作为关键质量属性(分别以R1,R2表示),采用Plackett-Burman设计A乙醇体积分数、B料液比、C药材目数、D微波功率、E微波时间等5 个工艺控制点作为待筛选参数,进一步确定关键工艺参数,实验设计由Design-Expert.V8.0.6(美国Stat-Ease公司)生成,因素及相应水平具体见表1,结果见表2.
表1Plackett-Burman设计的因素及相应的水平
Table1CodedanduncodedvaluesofPlackett-Burmanfactors
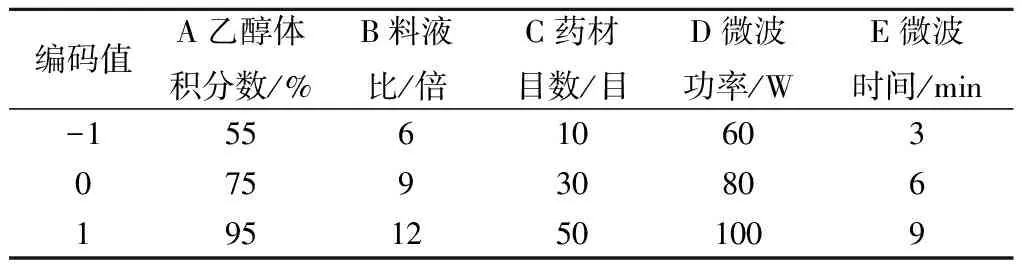
编码值A乙醇体积分数/%B料液比/倍C药材目数/目D微波功率/WE微波时间/min-15561060307593080619512501009
表2Plackett-Burman设计及结果
Table2Plackett-Burmandesignedexperimentsandresults
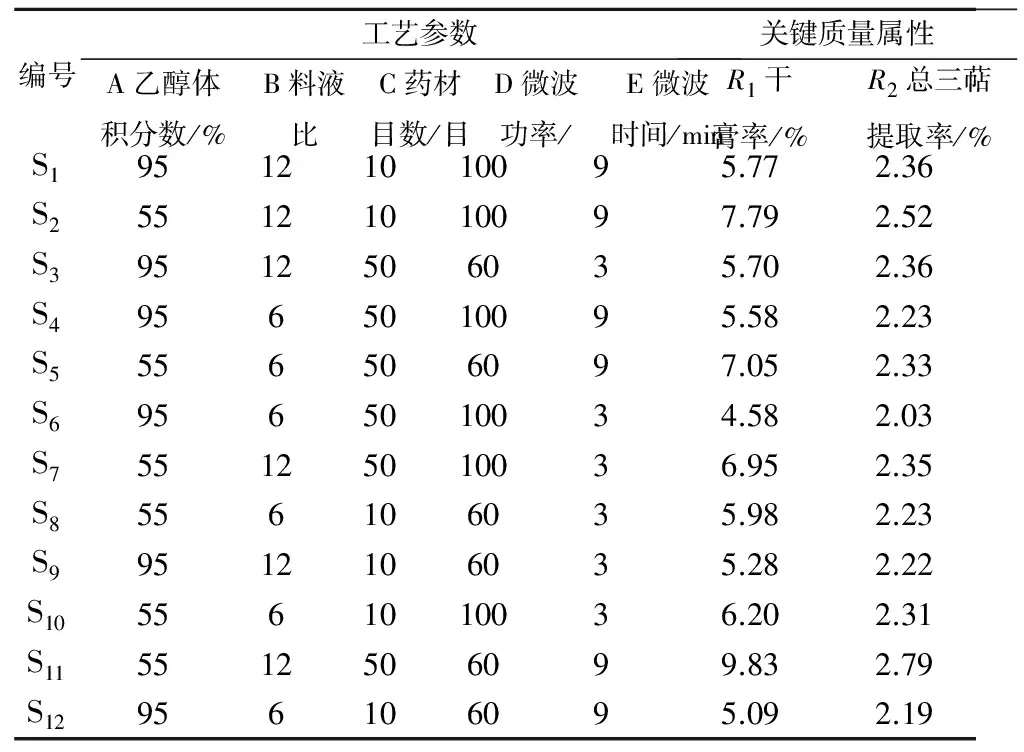
编号工艺参数A乙醇体积分数/%B料液比C药材目数/目D微波功率/E微波时间/min关键质量属性R1干膏率/%R2总三萜提取率/%S195121010095.772.36S255121010097.792.52S39512506035.702.36S49565010095.582.23S5556506097.052.33S69565010034.582.03S755125010036.952.35S8556106035.982.23S99512106035.282.22S105561010036.202.31S115512506099.832.79S12956106095.092.19
2.3.2 回归模型的建立
根据Plackett-Burman实验筛选出的关键工艺参数,采用Box-Behnken实验设计研究雷公藤微波提取工艺过程的关键工艺参数和关键质量属性之间的数学模型.实验设计由Design-Expert.V8.0.6(美国Stat-Ease公司)生成,因素及相应的水平见表3,设计及结果见表4.
表3Box-Behnken设计的因素及相应的水平
Table3CodedanduncodedvaluesBox-Behnkenoffactors

编码值A乙醇体积分数/%B料液比E微波时间/min-1556307596195129
表4Box-Behnken设计及结果
Table4Box-Behnkendesignedexperimentsandresults

编号工艺参数A乙醇体积分数/%B料液比E微波时间/min关键质量属性R2总三萜提取率/%R1干膏率/%1551268.382.05275966.882.27375966.832.27495663.832.06595934.682.34655999.101.88775966.682.198751237.482.49975634.291.9610951265.612.6411751296.912.491295995.602.721355665.461.501475966.312.151575966.052.101675694.591.851755937.451.97
3 结果与讨论
3.1 关键工艺参数的筛选
将表2中各工艺参数对关键质量属性产生的结果作Pareto图分析,可筛选出关键工艺参数,如图2所示,比较雷公藤总三萜微波提取总三萜提取率与对雷公藤微波提取的干膏率产生显著性影响的工艺参数,均为A乙醇体积分数(%)、B料液比、E微波时间(min).由此,可筛选出乙醇体积分数(%)、料液比和微波时间(min)作为雷公藤微波提取工艺过程的关键工艺参数,进一步研究.

图2 干膏率和总三萜提取率的因素筛选Pareto图Fig.2 Factor select Pareto chart of dry extract yielding rate and total triterpenoids extraction rate
3.2 回归模型的分析
3.2.1 模型的建立及分析
Box-Behnken设计结果如表4所示.17 组微波提取过程中,干膏率为3.83%~9.10%,总三萜提取率为1.50%~2.72%,由Design-Expert V8.0.6软件对上述实验数据进行模型拟合,结果见表5.方差分析和显著性检验结果见表6和表7.
由表6结果可知:干膏率Y1对乙醇体积分数、料液比和微波时间(分别以X1,X2,X3表示)的二次多元回归模型,F值为11.91,P值小于0.05,表明模型效果显著,失拟值大于0.1,实验误差不显著,决定系数R2为0.938 7,校正决定系数adjR2为0.859 9。此模型显示,乙醇体积分数和料液比对雷公藤微波提取的干膏率影响最为显著.
由表7结果可知:总三萜提取率Y2对乙醇体积分数、料液比和微波时间(分别以X1,X2,X3表示)的二次多元回归模型,F值为27.74,P值小于0.05,表明模型效果显著,失拟值大于0.1,实验误差不显著,决定系数R2为0.972 7,校正决定系数adjR2为0.937 7,说明模型效果与实际拟合较好.此模型显示,乙醇体积分数和料液比对雷公藤微波提取过程的总三萜提取率影响最为显著.

表5 回归方程
表6干膏率方差分析
Table6Analysisofvariancefordryextractyieldingrate
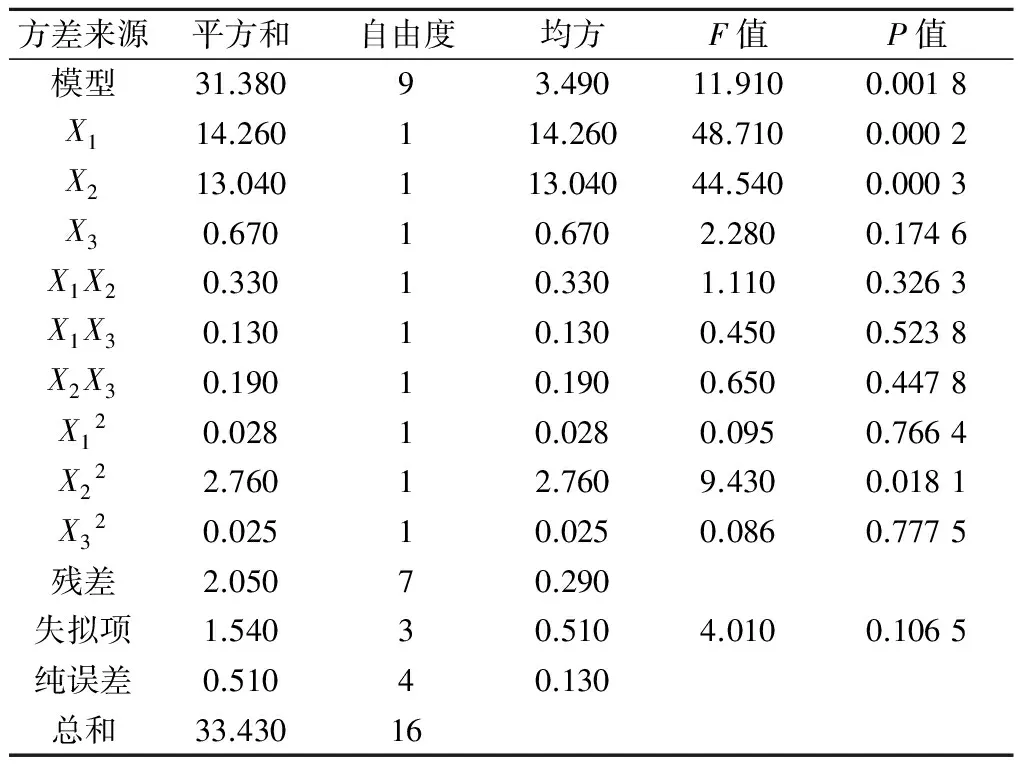
方差来源平方和自由度均方F值P值模型31.38093.49011.9100.0018X114.260114.26048.7100.0002X213.040113.04044.5400.0003X30.67010.6702.2800.1746X1X20.33010.3301.1100.3263X1X30.13010.1300.4500.5238X2X30.19010.1900.6500.4478X120.02810.0280.0950.7664X222.76012.7609.4300.0181X320.02510.0250.0860.7775残差2.05070.290失拟项1.54030.5104.0100.1065纯误差0.51040.130总和33.43016
表7总三萜方差分析
Table7Analysisofvariancefortotaltriterpenoids
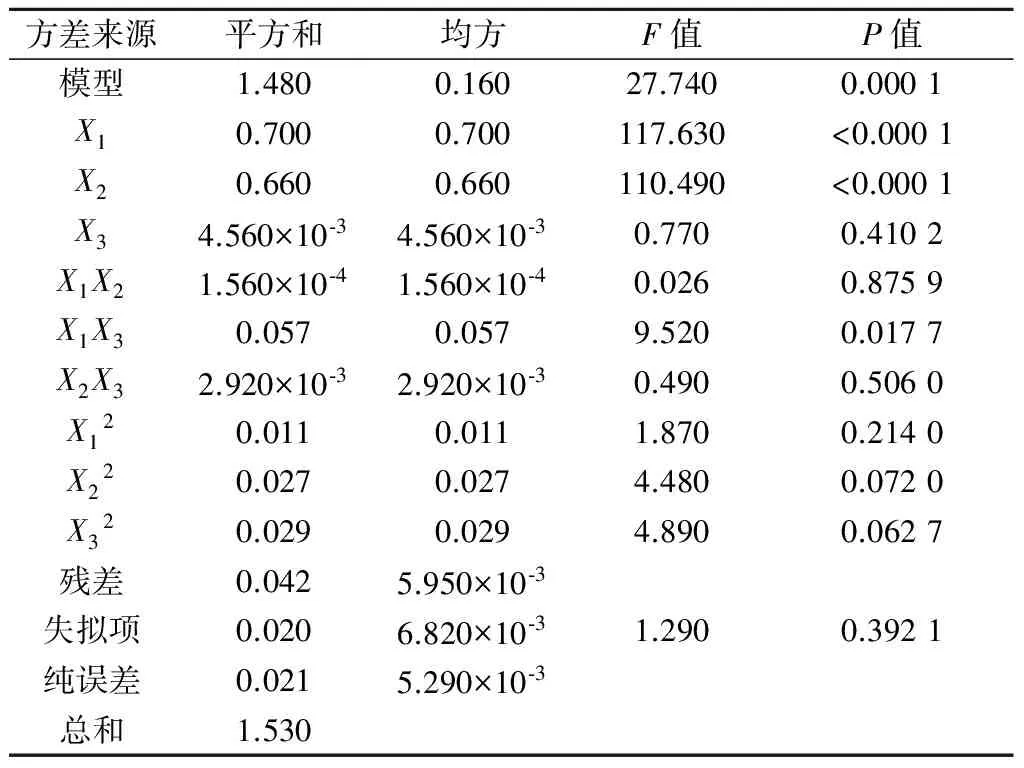
方差来源平方和均方F值P值模型1.4800.16027.7400.0001X10.7000.700117.630<0.0001X20.6600.660110.490<0.0001X34.560×10⁃34.560×10⁃30.7700.4102X1X21.560×10⁃41.560×10⁃40.0260.8759X1X30.0570.0579.5200.0177X2X32.920×10⁃32.920×10⁃30.4900.5060X120.0110.0111.8700.2140X220.0270.0274.4800.0720X320.0290.0294.8900.0627残差0.0425.950×10⁃3失拟项0.0206.820×10⁃31.2900.3921纯误差0.0215.290×10⁃3总和1.530
3.3 设计空间的建立与验证
根据相关雷公藤制剂的现行标准设定干膏率范围为5.0%~8.0%,总三萜下限为2.0%.利用Design-Expert.V8.0.6软件,并加入置信水平为0.05的置信区间优化,建立设计空间,结果如图3所示.综合考虑实际过程中对各参数控制的可操作性,进一步确认乙醇体积分数范围为71%~91%,料液比范围为9~12 倍(图3中画斜线矩形部分).在此空间内操作,所得雷公藤微波提取物均满足对干膏率和总三萜提取率的期望值.
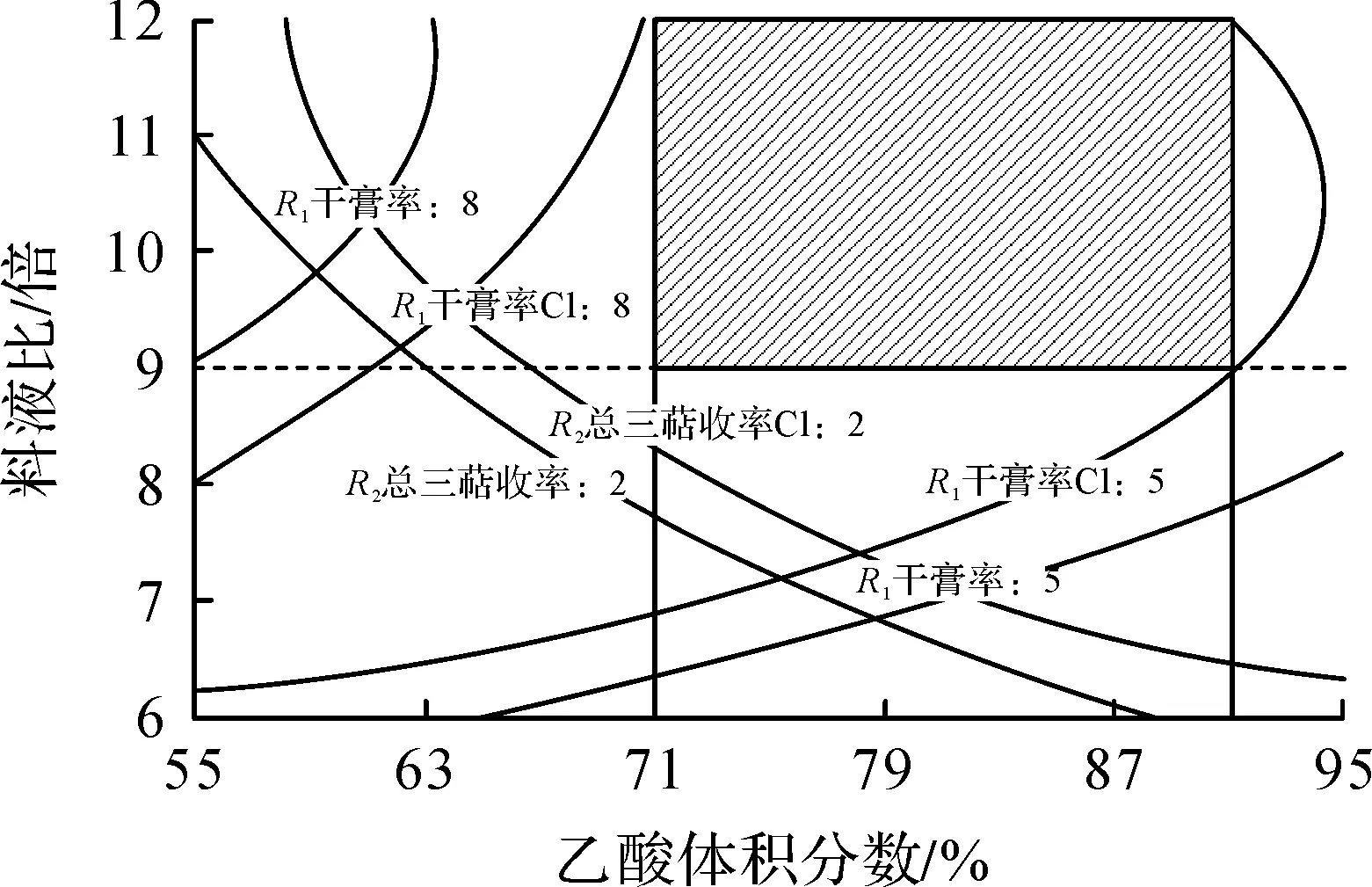
图3 加入95%置信区间的雷公藤总三萜微波提取工艺设计空间(微波时间6 min)Fig.3 DS of the microwave extraction of Tripterygium wilfordii total triterpenoids process with 95% confidence interval(microwave time of 6 min)
为验证设计空间的准确性,参照回归方程模型结合实际操作情况,在设计空间内外选取4 个点进行验证,4 个点分别表示为T1,T2,T3,T4,验证结果见表8.在空间内操作的点结果均符合质量要求.干膏率的实测值与预测值间的RSD不大于2.5%,总三萜提取率实测值与预测值间的RSD不大于1.5%,模型能较好的预测实际操作结果.
表8验证实验及结果
Table8Conditionsandresultsofverificationexperiments
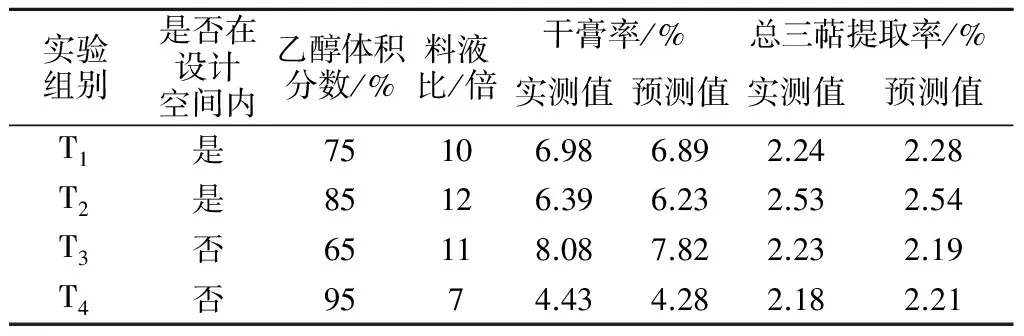
实验组别是否在设计空间内乙醇体积分数/%料液比/倍干膏率/%总三萜提取率/%实测值预测值实测值预测值T1是75106.986.892.242.28T2是85126.396.232.532.54T3否65118.087.822.232.19T4否9574.434.282.182.21
4 结 论
QbD理念前移药品质量控制至设计步骤,从源头保证药品质量[14].以QbD理念为指导,对雷公藤总三萜微波提取工艺进行研究.首先通过Plackett-Burman设计筛选,进一步采用Box-Behnken设计实验,确定以乙醇体积分数、料液比、微波时间为关键工艺参数和以干膏率、总三萜提取率为关键质量属性间数学模型,建立设计空间.最后结合操作实际确定最佳范围,微波时间为6 min,乙醇体积分数范围为71%~91%,料液比范围为9~12 倍,并通过验证实验表明,实测值与预测值无明显偏差,在设计空间内操作能有效提高雷公藤总三萜微波提取产物质量一致性,提高工艺过程控制水平.
参考文献:
[1] 中华本草编委会.中华本草[M].上海:上海科技出版社,1999.
[2] 刘雪梅,刘志宏,张晶,等.雷公藤临床应用及不良反应的研究进展[J].药学实践杂志,2015,33(2):110-113.
[3] 田振,刘志宏,宋洪涛.雷公藤有效部位提取纯化工艺研究进展[J].中草药,2012,43(2):408-412.
[4] XU R S, FIDLER J M, MUSSER J H.Bioactive compounds fromTripterygiumwilfordii[J].Studies in natural products chemistry, 2005, 32(5):773-801.
[5] 徐晓勇,马凤森,方剑乔,等.响应面法优选雷公藤超声提取工艺[J].中成药,2016,38(5):1030-1034.
[6] 王诗宏,杨祥良,韩定献,等.超临界二氧化碳萃取雷公藤中有效成分的研究[J].时珍国医国药,2002,13(11):641-642.
[7] 杨磊,李彤,祖元刚.加压溶剂法提取雷公藤多苷及其条件优化[J].中国中药杂志,2010,35(1):44-48.
[8] 涂瑶生,毕晓黎.微波提取技术在中药及天然药物提取中的应用及展望[J].世界科学技术,2005,7(3):65-70,90.
[9] 张茹萍,何昱,石森林,等.雷公藤药材中6种有效成分以及总二萜内酯、总生物碱、总三萜的含量测定[J].中华中医药杂志,2013,28(1):224-229.
[10] 运乃茹.雷公藤多苷片的HPLC指纹图谱和模式识别研究[J].临床医药实践,2016,25(8):598-601.
[11] JURAN J M.Juran on quality by design: the new steps for planning quality into goods and services[M].New York: Free Press, 1992.
[12] 徐冰,史新元,吴志生,等.论中药质量源于设计[J].中国中药杂志,2017,42(6):1015-1024.
[13] 龚行楚,陈滕,瞿海斌.基于质量源于设计理念的中成药二次开发研究进展[J].中国中药杂志,2017,42(6):1031-1036.
[14] 王晓宇,李文龙,瞿海斌,等.前馈控制技术研究进展及其在中药质控中的应用展望[J].中草药,2017,48(21):4560-4564.
