大豆分离蛋白酶解液抗氧化性的近红外光谱定量测定
2018-05-09邱智军
周 博 邱智军
(河南科技大学食品与生物工程学院,洛阳 471023)
大豆肽是大豆蛋白经酶水解获得的短肽混合物[1],也是大豆蛋白开发利用的研究热点。已发现大豆肽具有抗氧化、降血压、降胆固醇、降血糖、抗疲劳等生理活性[2-3]。大豆肽主要有3种工业生产方法:酶解法、微生物发酵法和合成法,其中,酶水解法具有专一性强、条件温和,无毒副作用的特点,而且对营养几乎无不良影响,受到人们的广泛关注[4]。抗氧化性作为大豆肽诸多生理功能的基础,同时也是其生产制备工艺的重要质量监测指标[5]。目前抗氧化检测方法很多,且多是化学分析方法[6-7],其需要耗费大量的人力物力财力,而且耗时长,分析效率低。近红外光谱技术(NIRS)是近年来发展迅速的一种绿色分析技术,相对于传统分析方法,具有无损样品,成本效益低,劳动效率高等优点[8],适于大规模产业化生产的在线检测。目前,在抗氧化检测方面,近红外光谱技术已经被成功地应用到可可豆、绿茶和大米等食品类物质[9-12]。而以大豆肽抗氧化性为定量检测目标进行近红外光谱建模研究鲜见报道。
用不同的蛋白酶水解同一种大豆蛋白,其水解产物均具有抗氧化性,但不同蛋白酶作用位点不同,所得水解产物的分子质量以及氨基酸组成不同,从而影响了水解产物的抗氧化活性[13-14]。为了提高大豆多肽类产品的营养功能和加工特性,多酶复合水解也常用于大豆肽制备[15-16]。目前在大豆肽工业生产中常用的酶有碱性蛋白酶、中性蛋白酶、木瓜蛋白酶和菠萝蛋白酶,本研究拟选取上述4种酶分别对大豆分离蛋白进行水解,对其水解样品进行近红外光谱扫描,以期建立多酶水解液光谱与对应抗氧化值之间的定量分析模型,探索同一模型应用于不同酶的水解液抗氧化性测定的可行性。
1 材料与方法
1.1 实验材料
中性蛋白酶(20万 U/g)、碱性蛋白酶(20万 U/g)、菠萝蛋白酶(50万 U/g)、木瓜蛋白酶(80万 U/g): 江苏锐阳生物科技有限公司;大豆分离蛋白(食品级):郑州博研生物科技有限公司;1,1-二苯基-2-苦基肼自由基(DPPH)(Biotech Grade):北京Ruitaibio公司。
1.2 主要仪器
VECTOR33傅里叶变换近红外光谱仪:德国Brüker公司;DR6000可见光分光光度计:美国HACH公司。
1.3 实验方法
1.3.1 样品制备
分别用中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和菠萝蛋白酶对大豆分离蛋白进行酶促水解。水解条件分别为其产品说明书最适条件,具体条件见表1,在1 h内间隔不同时间取样,每种酶取样29组,共116个样品,分别进行近红外光谱扫描获得光谱数据,同时测定其抗氧化值。由于操作失误,木瓜酶用于近红外光谱扫描的第28号样品损失,实际用于本研究建模的样品数为115。

表1 四种蛋白酶水解条件
1.3.2 抗氧化能力测定
由于缺乏一种标准方法准确评价抗氧化物质的抗氧化能力,根据不同的目标需要,目前使用的抗氧化测定方法非常多。本研究目的聚焦于探索构建大豆蛋白酶解液抗氧化能力近红外预测模型的可行性,并未全面评价样品抗氧化性,而是选择一种抗氧化研究中最常用的测定方法-DPPH法来测定样品的抗氧化能力[17,18 ]。
用DPPH法测定四种酶解大豆蛋白产物的自由基消除量,以此指标作为评价其抗氧化能力的指标。主要步骤为取1mL样液,加入1 mL的蒸馏水和2 mL配置好的0.004% DPPH溶液,充分混匀,避光静置30 min后,以蒸馏水为阳性对照,甲醇为空白对照,于517 nm波长处测定吸光度。每一样品重复测定3次,取其平均值。自由基清除量Y(mg/mL)按公式(1)计算:
(1)
式中:A1为样品吸光度或阳性对照吸光度;A2为空白对照吸光度。
1.3.3 近红外光谱采集
将样品装入样品杯中,采用近红外透射采样系统采集,光谱采集范围为3 500~12 000 cm-1,扫描次数为32,分辨率为4 cm-1,采用蒸馏水为参比,测量时的环境温度为20 ℃,湿度为35%。每个样品采集3张光谱,取其平均光谱。
1.3.4 全波长光谱和CARS法波长筛选优化模型构建
由于物理变化可能对光谱有影响,因此原始光谱不可避免地包含系统噪声或背景信息[19]。因此,需要适当的光谱预处理方法来减少不需要的光谱变化。本研究所有数据均采用Pareto scaling[20]方法进行预处理。
全波长光谱处理建模时,通过对原始光谱进行预处理,利用偏最小二乘留一交叉验证法进行近红外光谱建模,所建模型用相关系数(R)和均方根误差(RMSECV)来评价,其中R越接近1,RMSECV越小,模型精度越高,预测效果越好。
由于一些光谱区域包含来自环境的噪声和干扰变量,因此可以通过一些选择方法筛选出有效的校正模型变量而不是全光谱[21-22],Li等[23]提出的竞争性自适应重加权抽样(CARS)变量选择方法就是一种波长变量选择方法,其主要思想是基于达尔文进化论,运用“生存之道”的机制,将PLS模型中回归系数的绝对值用作评估每个变量重要性的指标。然后根据每个变量的重要程度,CARS以迭代和竞争的方式按照蒙特卡罗(MC)抽样运行顺序去选择N个子集的变量。此外,它采用了指数递减函数(EDF)和自适应重加权抽样(ARS)来消除一类权重相对较小的变量。最后,校正集交叉验证均方根误差(RMSECV)最小的子集被认为是变量的最优组合[24]。目前已经有很多研究证明CARS是复杂分析系统中强大而高性能的工具[25-26]。本研究将使用CARS方法进行变量筛选从而优化预测模型,优化计算时,交叉验证参数选择留一交叉验证法。
由于本研究中单个酶反应样本规模(29个样品)非大样本,所以,进行模型优化前后预测能力比较时,验证方法都选择留一交叉验证法,然后使用决定系数(R)和均方根误差(RMSECV)来评价模型的预测能力,考察CARS方法的有效性。
1.3.5 预测模型构建与评价
将全部4种酶酶解的大豆分离蛋白酶解液样本按DPPH自由基清除量从小到大排序,采用隔4选1的原则分别确定校正集和验证集[27],最终得到92个校正集样品,23个验证集样品。光谱预处理方法采用Pareto scaling方法,CARS方法进行波长变量筛选(计算时其交叉验证参数选择与校正集和验证集划分一致,即五折交叉验证法),用选择到的最优变量子集建立模型。采用校正集交叉验证相关系数(Rcv)、预测集相关系数(Rp)、RMSECV、预测均方根误差(RMSEP)和相对分析误差[验证集标准偏差和预测集标准偏差的比值(RPD)]进行模型性能评估,其中各评价指标的计算方法参考文献[28]。通常一个好的模型应该具有高的Rcv、Rp和RPD值,低的RMSECV和RMSEP值,并且RMSECV和RMSEP值的差异应尽量小。
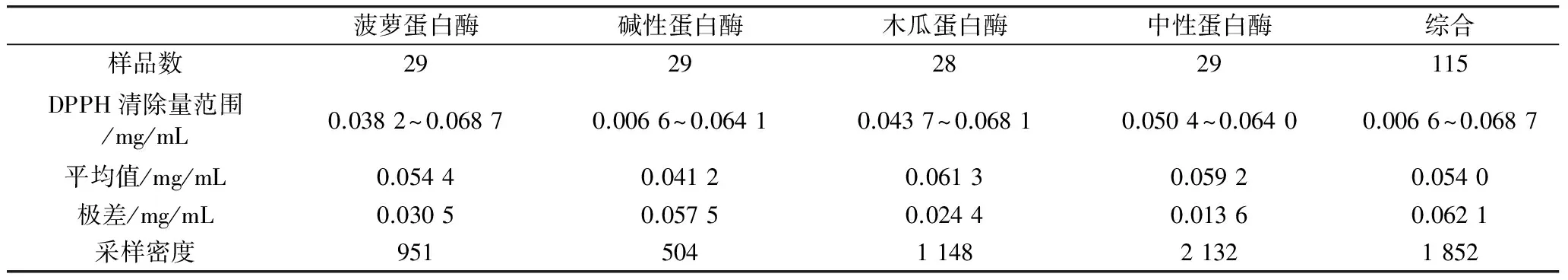
表2 4种酶的大豆蛋白水解液的DPPH清除量分析
注:采样密度为样品数和单位DPPH清除量范围的比值。
2 结果与讨论
2.1 试验样品的抗氧化值分析
本研究以清除DPPH自由基的程度来表示抗氧化性。4种不同的蛋白酶水解大豆分离蛋白,根据其水解时间不同,其水解产物的DPPH清除量也不同,不同采样时间四种酶水解的大豆蛋白水解液的DPPH清除能力见表2。
表2给出了建模所用基础数据(抗氧化值)的概况,对于不同酶解的采集样本,其抗氧化能力的上限基本相当,下限则差异较大,不同酶解样本的抗氧化能力极差差异明显,而样本容量又基本相等,鉴于此种情况,要考虑采样密度对模型的影响。构建统计预测模型时,采样密度相当于样本容量,在影响因素相同的情况下,样本容量越大,对统计量的估计或预测也就越准确。所以,表2中增加了采样密度项目,即单位目标值(DPPH清除量)范围上的采集样品数,即:样品数/极差。
2.2 近红外原始光谱分析
4种蛋白酶水解大豆蛋白水解液样本的近红外原始光谱图见图1,可以发现4个近红外原始光谱的整体趋势相似,说明其中所含物质的基团是相似的,制样时投入的不同酶物质对整体光谱形态并未引起明显变化。但同一种酶解样本(单酶)的吸光度值有明显变化,尤其是在2个高峰位置和波数3 500~5 000 cm-1范围内,吸光度的变异幅度很大。由图1可以观察到,4种酶样本的吸光度变异幅度由大到小排序为:碱性蛋白酶、菠萝蛋白酶、木瓜蛋白酶和中性蛋白酶,这与表1中样本的DPPH清除量极差情况相一致,这说明吸光度与抗氧化能力之间具有稳定的相关性,这也预示了预测模型构建的可行性。
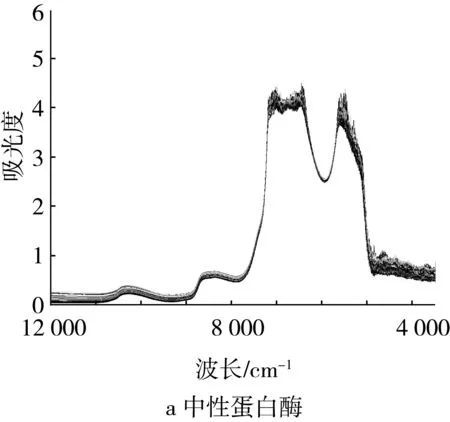
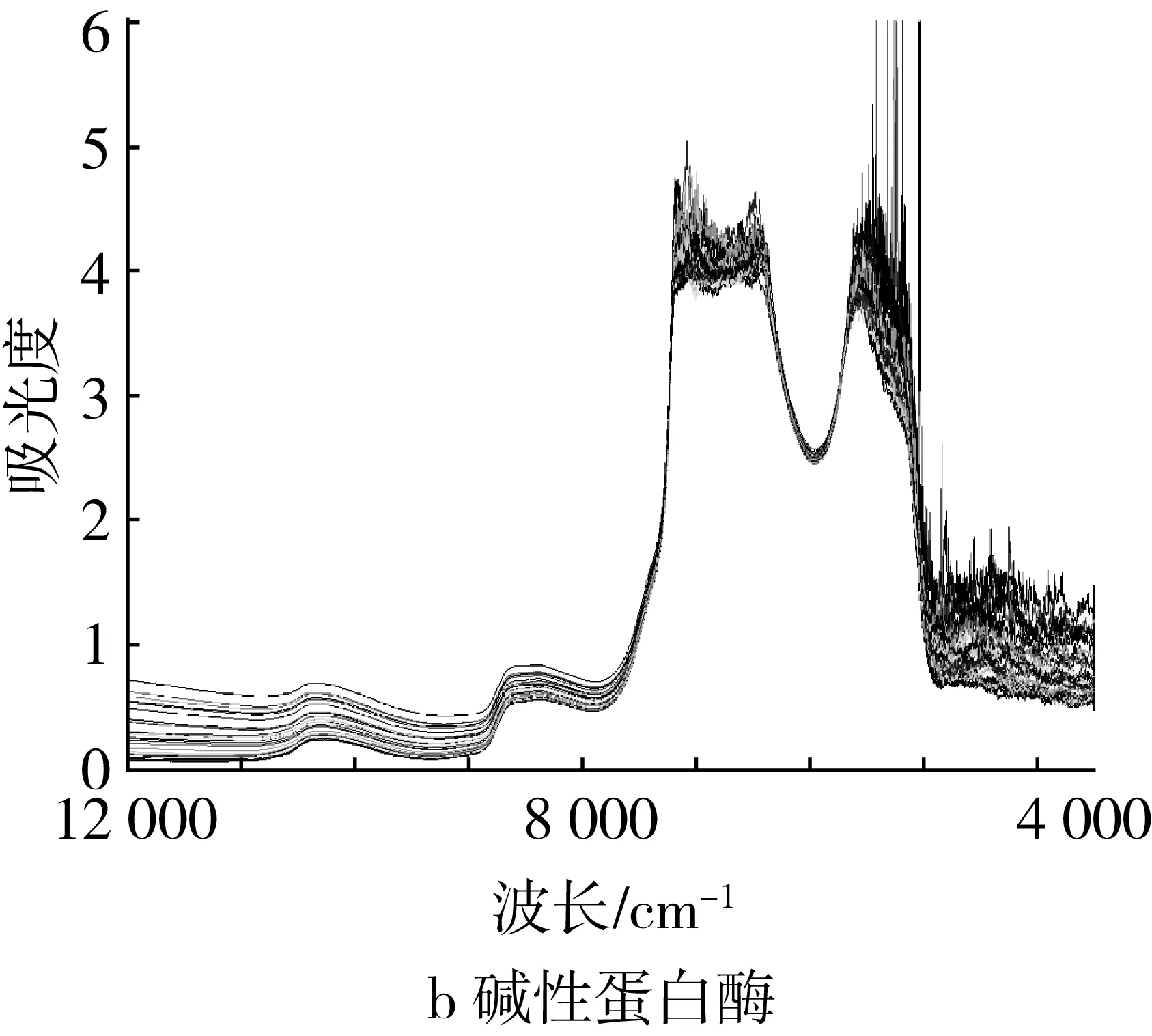


图1 近红外原始光谱图
2.3基于留一交叉验证的模型性能评价分析
光谱预处理可以有效地减少了一些类似水分子的强吸收噪声的干扰,从而提高模型的精度,使其具有更好的稳定性和预测性[29]。本实验中用pareto scaling方法对原始光谱经过预处理后,利用偏最小二乘留一交叉验证法进行近红外光谱建模,使用了5个样本数据建模:4个单酶样本和由4个单酶样本数据组成的混合样本数据模型,即综合样本数据模型,结果列于表3。表3中数据结果分为两部分:全波长模型和CARS优化模型,统一使用相关系数R和均方根误差RMSECV评价其性能。
从表3中全波长模型和CARS优化模型的交叉验证结果,两者比较,不管是单酶样本数据还是综合样本数据,经过CARS进行变量筛选优化后,相应预测模型的Rcv和RMSECV均更为优异,Rcv显著提高,RMSECV显著降低。这就说明经过CARS法进行变量筛选后,数据集的交叉验证模型精度均有显著提高,模型预测性能也随之提高。综上所述,采用PLS结合CARS优化对于构建更为优异的大豆蛋白酶解液抗氧化性数据预测模型是可行且有效的。
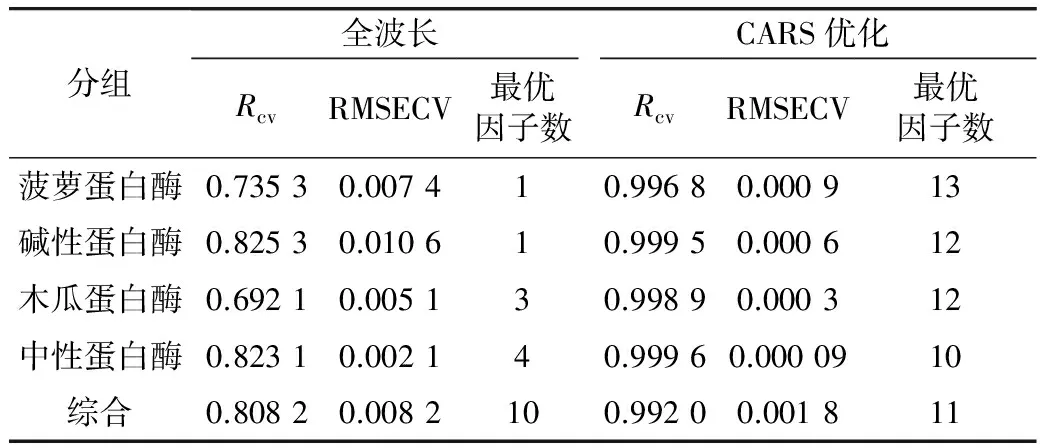
表3 全波长和CARS变量选择后的留一法交叉验证结果
全波长模型使用的光谱变量是原始光谱,包含4 499个不同波长上的吸光度。而CARS 变量选择法可有效选择与所测性质相关的最优变量组合,预测结果往往优于全谱偏最小二乘法(FS-PLS)[29]。CARS法筛选出的4个单酶样本和一个综合样本最优变量子集的变量个数分别为31个、27个、22个、25个、105个,波长范围分别是4 817.3~7 139.1 cm-1、4 026.3~7 114.1 cm-1、4 124.9~7 096.7 cm-1、4 080.6~7 121.8 cm-1、3 741.2~7 204.7 cm-1。从4个单酶样本数据预测模型的最优变量子集来看,筛选到的变量个数大致相当,其波长分布范围主体范围重叠,说明尽管不同酶物质的加入增加了样本间的差异,但这些差异并未完全主导模型的预测基础。相比较而言,综合样本数据预测模型的最优变量子集个数增加了数倍,波长范围与单个酶数据模型的一致且相对扩大,这说明综合样本数据预测模型为了准确预测多个酶解体系数据,增加了相应的波长变量以描述不同酶解体系数据的差异。
2.4采样密度和酶物质差异对模型性能的影响分析
本研究使用的采样方法使得表2中5个模型的采样密度不一致。采样密度越大,由此构建的统计预测模型性能会越好。CARS优化模型由于每个样本模型使用的波长变量不同,模型条件明显不一致,故而无法在此基础上讨论采样密度的影响。全波长模型使用的波长变量和模型算法PLS都是相同的,除了采样密度外,样本间的差异就只有加入的酶物质不同。每个单酶样本内,酶物质条件是相同的,样本间则酶物质条件不同,其对模型性能的影响无法简单分析确定。
假设检验方法可以用来分析酶物质差异对单酶样本数据模型的影响。在其他条件一致的情况下,采样密度对模型性能有确定性影响,即,采样密度和模型性能之间是相关的。如果统计检验显著,就可以认为不存在采样密度以外的其他因素的显著影响,也就是说,酶物质差异对单酶样本数据模型的性能没有显著影响。反之则说明酶物质差异对单酶样本数据模型的性能有显著影响。对于4个单酶样本数据模型,先假设酶物质差异对模型性能无显著影响,然后计算2个参数(采样密度和模型性能)的相关性。采样密度使用表1中数据,模型性能使用表2中相应全波长模型的RMSECV值,计算相关性r=-0.960,P=0.04。由于P<0.05,统计检验采样密度和模型性能之间相关性显著,说明酶物质差异对单酶样本数据模型的性能没有显著影响。
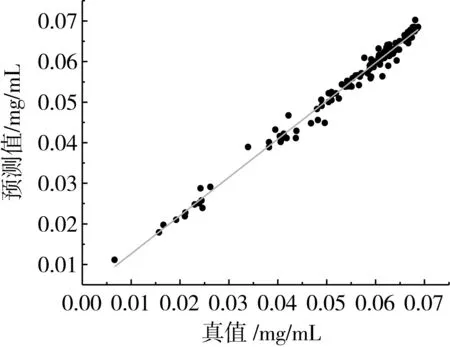
对于4个单对酶样本数据组成的混合样本数据模型,即综合样本数据模型,如表2所述,其RMSECV值为0.008 2,即0.002 1 图2 采样密度与RMSECV线性关系图 2.5 预测模型的测试评价 为了进一步验证模型的可行性,需要构建独立的验证集来对模型进行测试评价。另外,留一交叉验证表明,由于混合酶条件影响,相对于单酶样本数据模型,综合样本数据模型性能有所下降;且也可以看到CARS方法对于模型性能的提升作用。所以CARS优化模型被用于本小节的模型验证。 表4 近红外模型校正和预测结果 由抗氧化值及相应预测值得到散点图3,通过观察其散点分布,初步认定没有异常点。之后,将所有样品按照抗氧化值从小到大排序,采用隔4取1法划分为校正集和验证集。基于校正集,CARS方法筛选得到最优变量子集,由此建立的PLS预测模型的预测结果见表4,真实值与预测值之间的相关性见图4。由表4中的数据可以看出,预测集的RMSEP大于校正集的RMSECV,其差值为0.002 5,大约相当于校正集和验证集样本标准差s(分别为0.014 3和0.013 0)的五分之一,即小于0.2s,可以认为两者差异不大,说明建模样本和验证样本的代表性均比较好;另外,相对分析误差RPD也接近2.5,这些都表明模型具有很高的精度和较好的预测能力,而且其预测模型也比较稳定。 图3 综合样本CARS-PLS的交叉检验法结果 图4 近红外模型的校正集、验证集的预测值和真实值的相关性 本研究采用近红外光谱技术分别对菠萝蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶水解的大豆蛋白水解液的近红外图谱进行光谱预处理和CARS变量的筛选,比较了四种单个酶样品和综合酶样品近红外全波长算法和结合CARS算法后交叉验证模型的各个指标,再结合DPPH法测得四种酶水解的大豆蛋白水解液清除的DPPH含量进行建模,通过校正集的Rcv、RMSECV和验证集的Rp、RMSEP和模型的RPD值来评价四种酶水解的大豆蛋白水解液抗氧化性近红外定量分析模型的拟合效果与预测功能。另外,通过分析采样密度和酶物质对模型精度的影响,探究了同一模型应用于不同酶的水解液抗氧化性测定的可行性。结果表明,利用PLS和CARS算法结合可以大大提高模型的精确度,并由这个模型建立了一种基于近红外光谱结合CARS算法预测多种酶水解的大豆分离蛋白酶解液抗氧化活性的定量方法,从得到的模型评价参数可看出,大豆蛋白酶解产物的近红外光谱与抗氧化活性之间存在很好的相关性,其中Rcv为0.960 1,Rp为0.923 7,RMSECV和RMSEP分别为0.002 8 mg和0.005 3 mg,RPD值为2.45。 本研究方法和传统的化学分析方法相比,基于近红外光谱的抗氧化活性预测方法具有高效绿色,不消耗任何溶剂,分析成本低、分析速度快等优点。由本文建模效果评价来看,近红外光谱方法能够比较可靠地对多种蛋白酶水解蛋白质产物进行抗氧化性检测,这也预示着近红外方法在多肽类产品抗氧化性检测方面的潜在应用前景。随着近红外光谱技术的发展,以及近红外数据处理方法的研究与有效使用,利用近红外光谱技术建立的模型的准确性和稳定性也会大大提高,这都将有助于多肽类产品高效质量评价体系的建立。 [1]孙月梅. 大豆抗氧化肽酶法制备及其活性保护技术研究[D]. 哈尔滨:东北农业大学, 2008 SUN Y M. The antioxidative soybean peptide pruduced by enzymic method and it's antioxidative active preserve technique[D]. Haerbin: Northeast Agricultural University,2008 [2]汪建斌, 邓勇. 大豆多肽的生理功能及开发利用[J]. 现代食品科技, 2001, 17(3):52-53 WANG J B, DEN Y. Functional characteristic and exploitation of soybean peptides[J]. Moden Food Science and Technology, 2001, 17(3):52-53 [3]包媛媛, 林奇, 谢启军,等. 大豆多肽的生理功能及在食品工业中应用前景探讨[J]. 食品研究与开发, 2006, 27(2):141-144 BAO Y Y, LIN Q, XIE Q J, et al. Study on the physiological function of soybean peptides and its applied prospect in the food industry[J]. Food Research and Devel Opment, 2006, 27(2):141-144 [4]吴建中. 大豆蛋白的酶法水解及产物抗氧化活性的研究[D]. 广州:华南理工大学, 2003 WU J Z. Study on enzymatic hydrolysis of soybean protein and antioxidant activity of its products[D].Guangzhou:South China University of Technology,2003 [5]王莉娟. 大豆肽的制备及其体内外抗氧化活性研究[D]. 无锡:江南大学, 2008 WANG L J. Preparation of soybean peptide and its antioxidant activity in vitro and in vivo[D]. Wuxi:Jiangnan University,2008 [6]刘志东, 郭本恒, 王荫榆. 抗氧化活性检测方法的研究进展[J]. 天然产物研究与开发, 2008, 20(3):563-567 LIU Z D, GUO B H, WANG Y Y. Methods to determine antioxidative activity[J]. Natural Product Research and Development,2008,20(3):563-567 [7]王晓宇, 杜国荣, 李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报, 2012, 31(3):247-252 WANG X Y, DU G R, LI H. Progress of analytical methods for antioxidant capacity in vitro[J]. Journal of Food Science and Biotechnology, 2012, 31(3):247-252 [8]ZOU X, ZHAO J, Povey M J W, et al. Variables selection methods in near-infrared spectroscopy[J]. Analytica Chimica Acta, 2010, 667(1-2):14-32 [9]Huang X, Teye E, Samamoah L K, et al. Rapid measurement of total polyphenols content in cocoa beans by data fusion of NIR spectroscopy and electronic tongue[J]. Analytical Methods, 2014, 6(14):5008-5015 [10]LUYPAERT J, ZHANG M H, Massart D L. Feasibility study for the use of near infrared spectroscopy in the qualitative and quantitative analysis of green tea, Camellia sinensis, (L.)[J]. Analytica Chimica Acta, 2003, 478(2):303-312 [11]ZHANG C, SHEN Y, CHEN J, et al. Nondestructive prediction of total phenolics, flavonoid contents, and antioxidant capacity of rice grain using near-infrared spectroscopy [J]. Journal of Agricultural & Food Chemistry, 2008, 56(18):8268-8272 [12]焦爱权, 徐学明, 金征宇. 基于近红外及中红外光谱融合技术快速检测黄酒中的总酚含量及其抗氧化能力[J]. 食品与生物技术学报, 2016, 35(4):357-363 JIAO A Q, XU X M, JIN Z Y. Comparison and joint use of FT-NIR and ATR-IR spectroscopy for the determination of total antioxidant capacity and total phenolic content of chinese rice wine[J]. Journal of Food Science and Biotechnology,2016,35(4):357-363 [13]周川农, 刘飞, 刘丹怡,等. 酶法制备小分子大豆肽的蛋白酶筛选以及酶解条件优化[J]. 粮油加工:电子版, 2014(6):40-42 ZHOU C N, LIU F, LIU D Y, et al. Enzymatic preparation of small molecule soybean peptide protease screening and conditions optimization of enzymatic hydrolysis[J]. Cereals and Oils Processing (Electronic Version), 2014(6):40-42 [14]周婷婷. 抗氧化大豆多肽制备、纯化的研究[D]. 上海:上海海洋大学, 2009. ZHOU T. Preparation and purification of soybean peptides with anti-oxidant activity[D].shanghai: Shanghai Ocean University,2009 [15]刘通讯, 朱小乔, 杨晓泉. 多酶协同作用生产大豆多肽的研究[J]. 食品科学, 2002, 23(11):29-32 LIU T X, ZHU X Q, YANG X Q. Study on Multi-enzyme System to Produce Soy Polypeptide[J]. Food Science, 2002, 23(11):29-32 [16]刘静, 陈均志, 张海平,等. 多酶复合水解微波加热制备小分子大豆肽[J]. 化学研究与应用, 2007, 19(7):752-755 LIU J, CHEN J Z, ZHANG H P, et al. Study on protein hydrolyzed into soybean polypeptides with proteinic enzymes[J]. Chemical Research and Application, 2007, 19(7):752-755 [17]SCHERER R, GODOY H T. Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method.[J]. Food Chemistry, 2009, 112(3):654-658 [18]陈洁, 胡晓赟. 蛋白水解物的抗氧化性研究与展望[J]. 中国食品学报, 2011, 11(9):111-119 CHEN J, HU X Y. Review on the antioxidant properties of protein hydrolysates[J]. Journal of Chinese Institute of Food Science and Technology, 2011, 11(9):111-119 [19]王动民, 纪俊敏, 高洪智. 多元散射校正预处理波段对近红外光谱定标模型的影响[J]. 光谱学与光谱分析, 2014, 34(9):2387-2390 WANG D M, JI J M, GAO H Z. The effect of MSC spectral pretreatment regions on near infrared spectroscopy calibration results[J]. Spectroscopy and Spectral Analysis, 2014, 34(9):2387-2390 [20]GROMSKI P S, XU Y, Hollywood K A, et al. The influence of scaling metabolomics data on model classification accuracy[J]. Metabolomics, 2014, 11(3):1-12 [21]LI H D, LIANG Y Z, LONG X X, et al. The continuity of sample complexity and its relationship to multivariate calibration: A general perspective on first-order calibration of spectral data in analytical chemistry[J]. Chemometrics & Intelligent Laboratory Systems, 2013, 122(5):23-30 [22]DENG B C, YUN Y H, MA P, et al. A new method for wavelength interval selection that intelligently optimizes the locations, widths and combinations of the intervals.[J]. Analyst, 2015, 140(6):1876-85 [23]LI H, LIANG Y, XU Q, et al. Key wavelengths screening using competitive adaptive reweighted sampling method for multivariate calibration.[J]. Analytica Chimica Acta, 2009, 648(1):77 [24]李江波, 彭彦昆, 陈立平,等. 近红外高光谱图像结合CARS算法对鸭梨SSC含量定量测定[J]. 光谱学与光谱分析, 2014, 34(5):1264-1269 LI J B, PENG Y K, CHEN L P, et al. Near-Infrared hyperspectral imaging combined with CARS algorithm to quantitatively Determine soluble solids content in “Ya” pear[J]. Spectroscopy and Spectral Analysis, 2014, 34(5):1264-1269 [25]付丹丹, 王巧华. 鸡蛋新鲜度、pH值及黏度的高光谱检测模型[J]. 食品科学, 2016, 37(22):173-179 FU D D, WANG Q H. Predictive models for the detection of egg freshness, acidity and viscosity using hyper-spectral imaging[J]. Food Science, 2016, 37(22):173-179 [26]于霜, 刘国海, 梅从立,等. 基于CARS变量筛选的固态发酵pH值近红外检测[J]. 计算机与应用化学, 2014, 31(9):1143-1146 YU S, LIU G H, MEI C L, et al. NIRS detection of pH value in solid-state fermentation process based on variable selection method of CARS[J]. Computers and Applied Chemistry, 2014, 31(9):1143-1146 [27]刘建学, 张卫卫, 韩四海,等. 白酒基酒中己酸、乙酸的近红外快速检测[J]. 食品科学, 2016, 37(4):181-185 LIU J X, ZHANG W W, HAN S H, et al. Rapid detection of caproic acid and acetic acid in liquor base based on fourier transform near-infrared spectroscopy[J]. Food Science, 2016, 37(4):181-185 [28]褚小立. 化学计量学方法与分子光谱分析技术[M].北京:化学工业出版社, 2011:75-76 [29]刘国海, 夏荣盛, 江辉,等.一种基于SCARS策略的近红外特征波长选择方法及其应用[J].光谱学与光谱分析,2014, 34(8):2094-2097. LIU G H, XIA R S, JIANG H, et al. A wavelength selection approach of near infrared spectra based on SCARS strategy and its application[J]. Spectroscopy and Spectral Analysis, 2014, 34(8):2094-2097.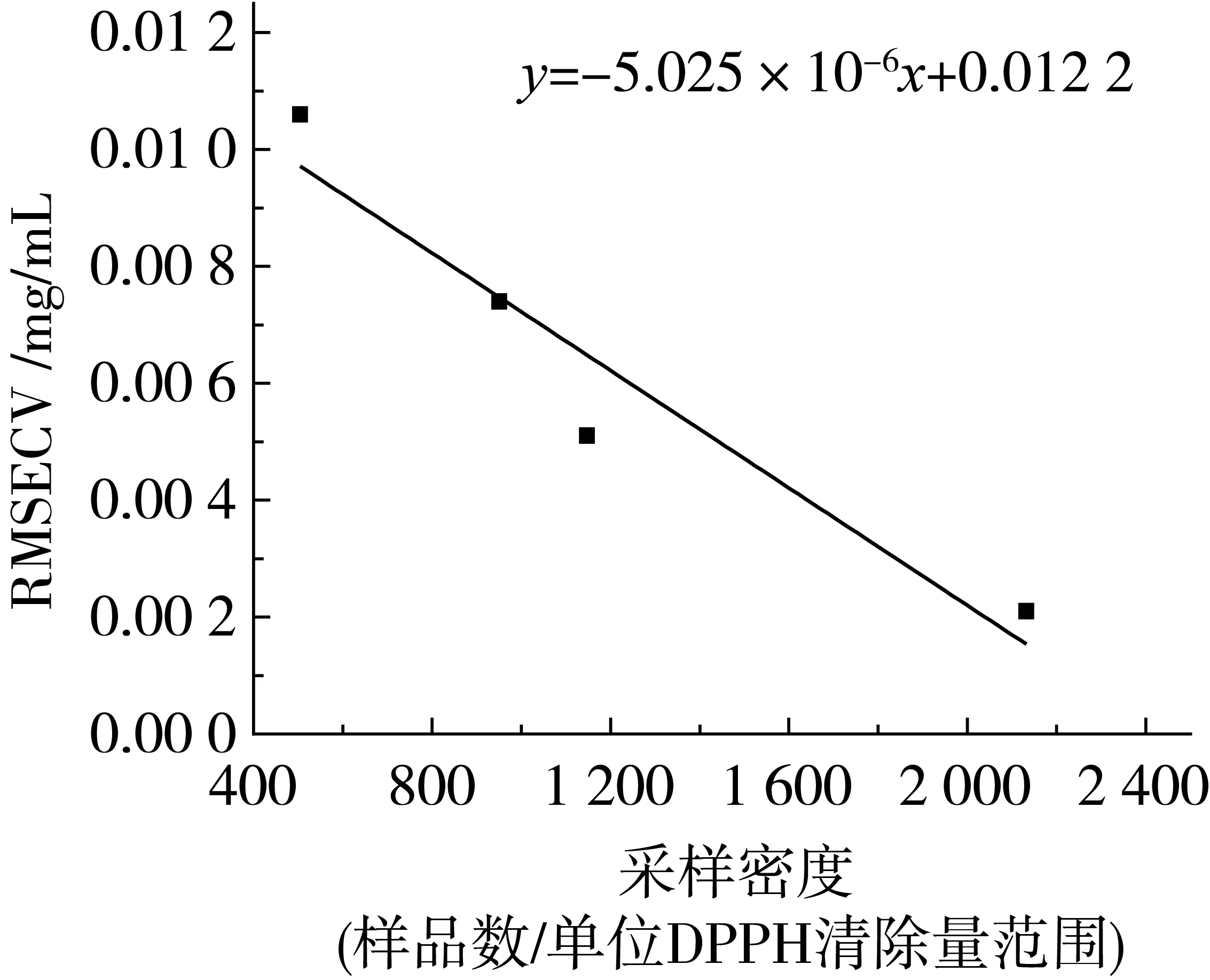


3 结论
