长骨骨折患者合并脊髓损伤对骨折愈合和血清血小板衍生因子、血管内皮生长因子含量的影响
2018-05-09岳春彦
岳春彦
(河南省确山县人民医院 骨科,河南 驻马店 463200)
临床上骨折患者病因多种多样,骨折的愈合是一种十分复杂的生物学过程。许多的临床研究发现,合并中枢神经系统损伤的骨折,其愈合速度加快,甚至出现异位骨化的现象[1-2],但是其发生机制仍不清楚[3]。近来的研究提示,神经激素或者神经体液机制是合并神经损伤的骨折患者骨折愈合加速的原因[4-12]。目前,国内外研究中,对合并脑外伤的骨折愈合研究较多[7,13-16],而对于合并脊髓损伤的长骨骨折愈合的研究较少[1]。本文主要研究合并脊髓损伤的长骨骨折愈合情况以及血清血小板衍生因子(platelet-derived growth factor,PDGF)和血管内皮生长因子(vascular endothelial growth factor, VEGF)水平的变化。
1 材料与方法
1.1 研究对象
收集2012年8月‐2016年10月在本院治疗的长骨骨折患者,纳入标准:①年龄18~60岁;②无慢性病史或全身性疾病史,所有患者对本研究知情,并签署知情同意书。排除标准:① 需要长期服药和治疗的糖尿病、缺血性心脏病、慢性肾衰竭及内分泌系统疾病的患者;②需要激素治疗的支气管哮喘、类风湿性关节炎、其他类风湿疾病、炎性疾病及自身免疫病患者。依据是否合并脊髓损伤,将患者分为单纯骨折组(A组,22例)和骨折合并脊髓损伤组(B组,26例)。所有骨折均进行相应的外科手术治疗。
骨折愈合及骨痂形成依据X光片、CT等影像学检查由影像科医师协助进行判断。骨折后3个月复查影像学显示骨折后无骨痂形成为骨折延迟愈合;骨折后6个月时复查影像学显示骨折断端无连接性骨痂,骨折线清晰可见,定义为骨折不愈合。
1.2 PDGF和VEGF测定
损伤发生后1 d、3 d、1周、2周、3周,分别取患者血10 ml,离心,留取血清,-80℃冻存,留待PDGF和VEGF测定。酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)试剂盒购自晶美生物,严格按照说明书操作,测定血清PDGF和VEGF水平。
1.3 统计学方法
本研究统计学分析使用SPSS 17.0(IBM Corp,Armonk, NY, USA)统计软件进行。计量资料以均数±标准差(±s)表示,计量资料比较采用t检验。计数资料以百分比(%)表示,计数资料比较采用χ2检验和Student's t检验。P <0.05为差异有统计学意义。
2 结果
如表1所示,A组患者共有22例,B组患者26例,A组年龄为(33.2±8.2)岁,与B组患者年龄差异无统计学意义(P =0.406);A组中女22.7%(5例),B组中女26.9%(7例),两组之间差异无统计学意义(P =0.738);在病因方面,由高能量交通事故所致的损伤A组有16例(72.7%),B组19例(73.1%),高空坠落所致的损伤A组6例(27.3%),B组7例(26.9%),两组之间差异无统计学意义(P =0.978);B组脊髓损伤在颈部的11例,在腰背部的15例,出现四肢瘫痪的8例,下肢瘫痪的18例;长骨骨折发生在股骨的A组10例,B组12例,发生在胫腓骨的A组12例,B组14例,两组在骨折部位方面差异无统计学意义(P =0.961)。

表1 骨折患者临床资料
如表2所示,A组患者愈合率为77.3%(17例),显著低于B组愈合率(26例,100%)(P =0.010);A组愈合时间(23.2±9.6)周,显著长于B组的(7.1±1.7)周(P <0.001);骨痂最大厚度A组为(9.3±8.7)mm,显著小于B组的(32.3±11.2) mm(P <0.001)。
如图1所示,B组患者损伤发生后血清PDGF和VEGF水平持续升高,且显著高于A组患者血清PDGF和VEGF水平,差异有统计学意义(P <0.05)。
表2 两组患者骨折愈合情况比较 (±s)
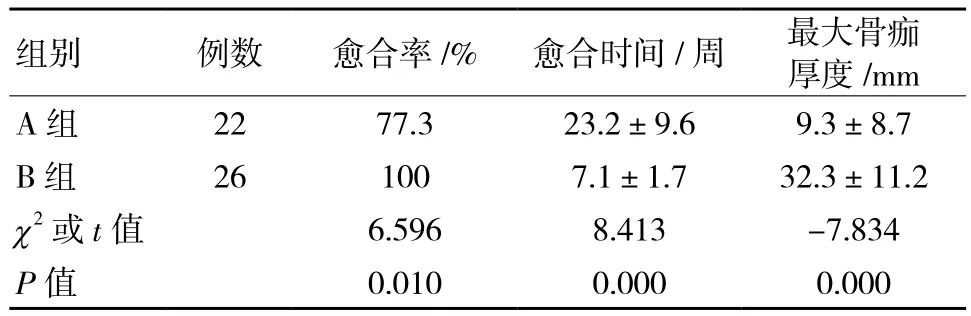
表2 两组患者骨折愈合情况比较 (±s)
组别 例数 愈合率/% 愈合时间/周 最大骨痂厚度/mm A 组 22 77.3 23.2±9.6 9.3±8.7 B组 26 100 7.1±1.7 32.3±11.2 χ2或 t值 6.596 8.413 -7.834 P值 0.010 0.000 0.000
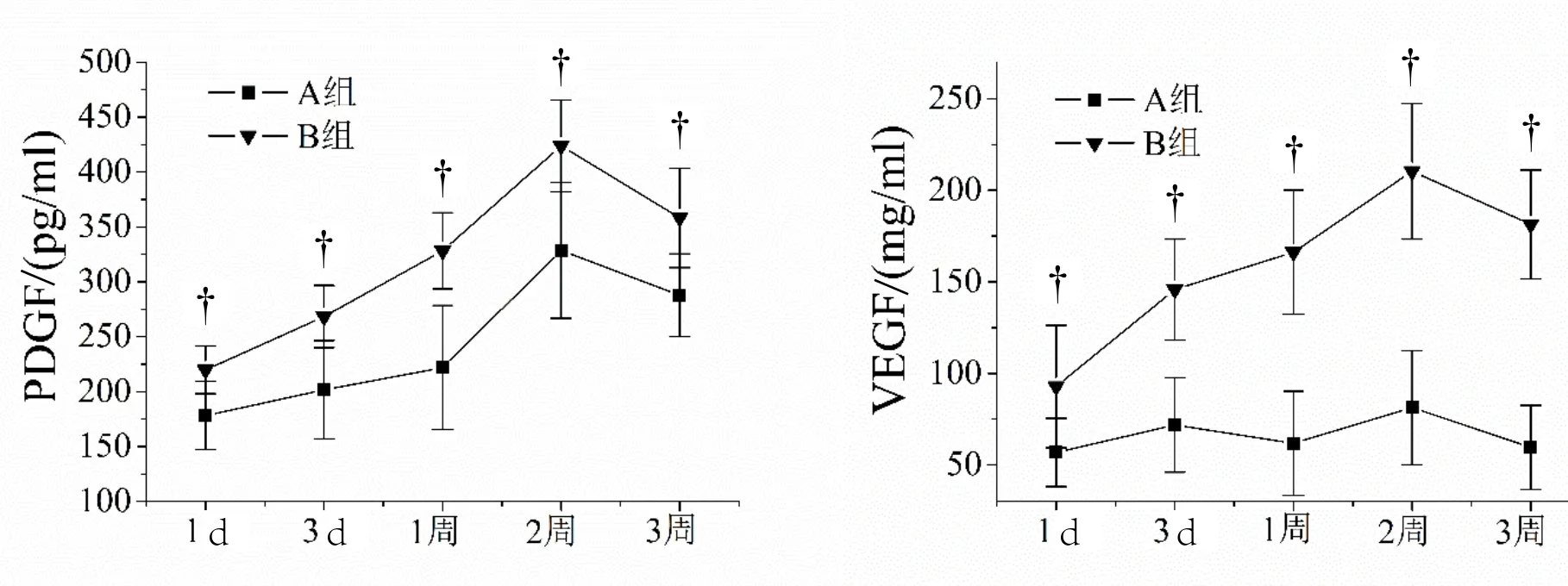
图1 单纯骨折患者(A组)与合并脊髓损伤患者(B组)血清PDGF水平及VEGF水平的变化。
3 讨论
骨折愈合是一个重建骨折处组织结构、完全恢复原有生理功能的过程,类似于胚胎发育时期骨生长的过程[17]。早期骨折愈合研究主要是细胞生物学方面的研究,随着分子生物学技术的发展,骨折愈合机制的研究进入到分子水平,特别是生长因子及其受体的研究[1]。本研究主要检测了骨折愈合过程中血液PDGF和VEGF的水平。
VEGF是一种能刺激血管内皮细胞分裂增殖的糖蛋白,在体内广泛表达,与血管新生有关,而新生血管对于早期骨形成具有重要作用[18-19]。PDGF最初从血小板中分离,故称为血小板源性生长因子,是平滑肌细胞、成纤维细胞的有丝分裂原,能刺激其分裂增殖;PDGF是骨折愈合早期即出现的细胞因子,作用贯穿骨折愈合全程,可以促进间充质细胞分裂增殖,成骨细胞分化成熟并分泌I型胶原,加快骨折愈合[19]。
国内外许多研究已经发现,在合并中枢神经系统损伤的骨折患者中,骨折愈合速度加快[2-3,9,14,18],其机制涉及血清细胞因子或者激素的变化,如在合并脑损伤的骨折患者中血清PDGF和VEGF水平均升高[14]。但既往的研究多偏向于合并脑损伤的骨折机制研究[13,15,20],对于合并脊髓损伤的骨折机制研究较少[1]。本研究另一个关注点是合并脊髓损伤对骨折愈合的影响,笔者的研究结果表明,合并脊髓损伤的骨折患者骨折愈合速度明显加快,与以往的研究结论相一致[1,15]。本研究还发现,损伤发生后3周内合并脊髓损伤的骨折患者血清PDGF、VEGF水平持续升高,且显著高于单纯骨折患者血清PDGF、VEGF水平,PDGF和VEGF水平的变化与以往合并脑外伤的骨折患者骨折愈合机制研究结果类似[14]。由于以往研究表明,在骨折后血清PDGF和VEGF水平增高[21-23],而且PDGF和VEGF治疗能够促进骨折的愈合过程[4-5,9,12,24-26],因此,笔者推测,血清VEGF、PDGF水平显著升高是促进合并脊髓损伤的骨折愈合加速的原因之一
综上所述,本研究结果表明,合并脊髓损伤的长骨骨折患者骨折愈合速度加快,其机制可能涉及PDGF和VEGF两种生长因子血清水平的升高。
[1] 杨森, 王海龙, 盛伟斌, 等. 骨折合并脊髓损伤患者血清中转化生长因子β1变化: 有利于促进骨折愈合[J]. 中国组织工程研究, 2015(2): 165-169.
[2] Kuijk AA, Geurts AC, Kuppevelt HJ. Neurogenic heterotopic ossification in spinal cord injury[J]. Spinal Cord, 2002, 40(7): 313-326.
[3] Morley J, Marsh S, Drakoulakis E, et al. Does traumatic brain injury result in accelerated fracture healing?[J]. Injury, 2005, 36(3):363- 368.
[4] Eckardt H, Ding M, Lind M, et al. Recombinant human vascular endothelial growth factor enhances bone healing in an experimental nonunion model[J]. Journal of Bone & Joint Surgery British Volume,2005, 87(10): 1434-1438.
[5] Eckardt H, Bundgaard KG, Christensen KS, et al. Effects of locally applied vascular endothelial growth factor (VEGF) and VEGF-inhibitor to the rabbit tibia during distraction osteogenesis[J].Journal of Orthopaedic Research, 2003, 21(2): 335-340.
[6] 王占义, 胡东旭, 杨晓琳, 等. IGF-1与VEGF促兔下颌骨骨折愈合作用的相关性研究[J]. 中国实验诊断学, 2013, 17(12):2147-2149.
[7] 许和贵, 陈楷, 张开伟, 等. 脑外伤不同程度对血清VEGF、TGF-β、bFGF的表达及对合并肢体骨折愈合速度影响机制的初步研究[J]. 临床医药文献电子杂志, 2016, 3(34): 6720,6723.
[8] 周正楠, 张岩, 邱旭升, 等. 骨折愈合过程中VEGF的表达与调控及其作用的研究进展[J]. 中国矫形外科杂志, 2015,23(24): 2248-2251.
[9] 陈雯辉, 王大业, 麻松, 等. 脑外伤后血小板衍生生长因子及血管内皮生长因子对骨折愈合影响的实验研究[J]. 首都医科大学学报, 2008, 29(6): 745-753.
[10] 田宝鹏, 陈雯辉, 潘海涛, 等. 脑外伤后胰岛素样生长因子-I及血小板衍生生长因子对骨折愈合的影响[J]. 首都医科大学学报, 2008, 29(1): 69-73.
[11] 徐亚青, 姜小华, 吴叶. PDGF在大鼠股骨干骨折愈合过程中的表达[J]. 中国骨肿瘤骨病, 2011, 10(1): 46-49.
[12] 罗云纲, 曲露露, 李美华. 骨形态发生蛋白与血小板衍生性生长因子在骨形成中协同作用的研究进展[J]. 吉林大学学报(医学版), 2013, 39(5): 1085-1088.
[13] 梁春雨, 田发明, 张柳, 等. 颅脑损伤对骨折愈合中BMP-2和VEGF表达的影响[J]. 中国煤炭工业医学杂志, 2012, 15(11):1761-1763.
[14] 高伟, 陈游, 谭丽. 合并脑外伤肢体骨折患者血清中血管内皮生长因子、血小板衍生生长因子的含量分析[J]. 实用骨科杂志,2013, 19(2): 136-138, 192.
[15] 刘继超, 孙骥, 李钰龙. 肢体骨折合并脑外伤患者血清中VEGF、PDGF的变化[J]. 生物骨科材料与临床研究, 2016,13(4): 52-54.
[16] 杨海, 董金波, 王维山, 等. PDGF-BB在脑外伤合并骨折患者血液中的表达及临床意义[J]. 系统医学, 2016, 1(11): 7-10.
[17] Urakawa H, Tsukushi S, Hosono K, et al. Clinical factors affecting pathological fracture and healing of unicameral bone cysts[J]. BMC Musculoskeletal Disorders, 2014, 15(1): 159.
[18] 安福, 王永刚, 刘文忠, 等. VEGF在大鼠脊髓损伤后股骨干骨痂形成过程中的表达[J]. 医学综述, 2014, 20(1): 129-131,135.
[19] 高伟. (2011)合并脑外伤肢体骨折患者血清中VEGF、PDGF的含量分析[D]: 中南大学.
[20] 姜小华, 张柳, 孙晓新, 等. 合并脑外伤的骨折愈合过程中PDGF的作用[J]. 中国修复重建外科杂志, 2008, 22(10):1227- 1231.
[21] 叶永成. EGF和VEGF在创伤性骨折愈合中的变化与意义[J].中国医药指南, 2012(25): 412-413.
[22] 于方, 俞猛, 付胜良. 转化生长因子-β、碱性成纤维生长因子和血小板衍生生长因子在大鼠骨折愈合中的表达[J]. 中国骨与关节外科, 2009, 2(3): 233-239.
[23] 张琼美, 张秀军. 血流变学指标及血清人可溶性细胞间黏附分子1、可溶性血管细胞黏附分子1、胰岛素样生长因子、血小板衍生生长因子水平在骨折延迟愈合患者中的临床意义[J].中国医药导报, 2013, 10(27): 43-45.
[24] Athanasopoulos AN, Schneider D, Keiper T, et al. Vascular endothelial growth factor (VEGF)-induced up-regulation of CCN1 in osteoblasts mediates proangiogenic activities in endothelial cells and promotes fracture healing[J]. Journal of Biological Chemistry,2007, 282(37): 26746-26753.
[25] Li R, Stewart DJ, Schroeder HPV, et al. Effect of cell-based VEGF gene therapy on healing of a segmental bone defect[J]. Journal of Orthopaedic Research, 2009, 27(1): 8-14.
[26] 孙永生, 温建民, 吴林生. 血小板源性生长因子在骨修复中的作用及应用研究[J]. 中国骨伤, 2004, 17(6): 380-382.
