1例犬卵巢畸胎瘤合并卵巢间质细胞瘤的病理学分析
2018-05-07丛淋淋肖建华
马 宁,丛淋淋,肖建华
(东北农业大学动物医学院,动物普通疾病防治重点实验室,哈尔滨 150030)
卵巢畸胎瘤是一种源于胚胎三个胚层成熟或未成熟组织的肿瘤[1]。正常的胚胎皮肤和神经组织来源于外胚层,脂肪、骨骼和肌肉组织来源于中胚层,胃肠组织来源于内胚层。由于卵巢畸胎瘤源于三个不同胚层,故在卵巢畸胎瘤内可见有皮肤和神经组织等。卵巢间质细胞瘤是卵巢肿瘤中的少见类型,发病率占卵巢肿瘤的0.21%~0.4%。本文为犬卵巢畸胎瘤合并卵巢间质细胞瘤,兽医临床实属罕见,查阅国内外文献未见报道,为此报道本病例,以飨读者。
1 临床资料与检查方法
雌性边境牧羊犬,2岁,体重9.5 kg。主诉:患犬体况良好,体温、呼吸正常,但叫声尖锐洪亮,烦躁不安,阴蒂肥大,无发情迹象,偶然会出现爬跨行为,要求手术绝育。
体检:腹平软,按压无肌肉收缩痉挛等现象。右中下腹部可触及一个鸡蛋大小肿物,质韧,活动范围大。剖腹探查,该肿块有5 cm×5 cm大小。
绝育后全部标本经10%甲醛固定、石蜡包埋切片、HE染色及光镜观察。犬术后恢复良好,术后1年电话回访,该犬健康,无任何异常。
2 结 果
2.1 肉眼观察
右侧卵巢肿物大小约 5.3 cm×6.5 cm×5.6 cm,肿瘤呈圆形,包膜完整,表面光滑,质地柔软,界清,为单侧,未与其他脏器粘连。左侧卵巢、子宫及双侧输卵管外观均无异常。肝、脾、胰、腹主动脉周围、盆腔内未见明显结节和肿块。未离体时肿瘤内容物以液化形式存在,手触似有波动感,手术离体后卵巢内的内容物呈半固体,为黄色油脂样物,其内混有黑色长短不一纤细毛发和皮脂(图1A)。
2.2 病理检查
2.2.1 右卵巢成熟性囊性畸胎瘤病理特征 右卵巢囊性肿物为囊性成熟性畸胎瘤,囊性区的肿瘤内可见皮肤及其附属组织、脂肪等多个胚层组织、皮下组织内成纤维细胞和小血管增生(图1B、C、D)。
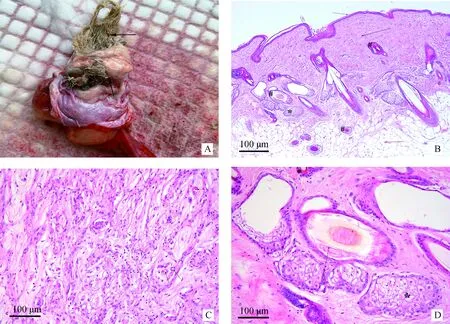
A.切开右侧肿物,可见皮脂和毛发等;B,C,D为右侧卵巢肿物的组织切片,其中,B. 可见皮脂结构、表皮层(蓝色箭头)、真皮层(黑色箭头)、毛囊(#)、皮脂腺(*)及皮下脂肪组织(红色箭头)(100×);C. 皮下组织内成纤维细胞和小血管增生(箭头所指是小血管)(200×);D. 箭头所指是毛囊,*所指是皮脂腺(200×)A. The sebum and hair can be seen with cutting the ovarian right mass; B, C and D are histological sections of the right ovary. B. The sebum structure, the epidermis (blue arrow), the dermis (black arrow), the hair follicle (#), the sebaceous glands (*), the subcutaneous adipose tissue (red arrow) (100×); C. Proliferation of fibroblasts and small blood vessels in the subcutaneous tissue (arrows refer to small vessels) (200×); D. The arrow refers to the hair follicle and the * represents the sebaceous gland (200×)图1 犬卵巢成熟性囊性畸胎瘤病理特征Fig.1 Pathological features of ovarian mature cystic teratoma in a dog
2.2.2 卵巢间质细胞瘤病理特征 间质细胞瘤常因体积小,临床检查难以发现。镜检可见肿瘤细胞呈弥漫性增殖,肿瘤组织有包囊,与周围组织界限明显。肿瘤组织中心部和边缘部可见大小不等的囊泡样结构(图2A)。肿瘤细胞呈中-大型类圆形、多角形或不规则形状,细胞间界限清晰,细胞质丰富,呈强嗜酸性,细胞核呈圆形,并可见明显的核仁,偶尔可见双核的肿瘤细胞(图2B)。较多肿瘤细胞的细胞质内有空泡形成或泡沫化(图2C)。卵巢局部皮质和髓质内可见出血(图2D)。两种肿瘤成分界限清楚,无相互混杂。病理诊断:右侧卵巢成熟性囊性畸胎瘤合并卵巢间质细胞瘤。
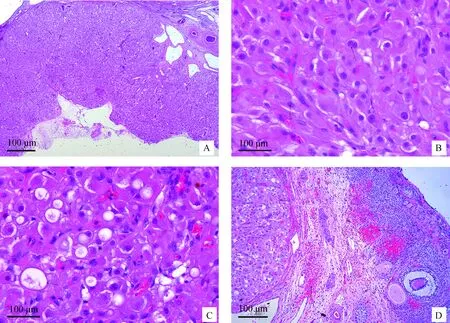
A.卵巢组织内可见肿瘤细胞呈弥漫性增殖,肿瘤组织有包囊,与周围组织界限明显(40×);B.细胞质丰富呈强嗜酸性,细胞核呈圆形,并可见明显的核仁,偶见双核肿瘤细胞(200×);C.肿瘤细胞细胞质内有空泡形成或泡沫化(200×);D.卵巢皮质和髓质内可见出血,肿瘤组织缺乏间质细胞,血管网丰富(100×)A. The tumor cells showed diffuse proliferation in ovarian tissue, and the tumor tissues were encapsulated and the boundaries of the surrounding organization are obvious (40×); B. The cytoplasm is rich, which is strongly eosinophilic, nuclei is round which cntains visible nucleoli, and double core tumor cells are seen occasionally (200×); C. There is vacuole formation or foaming in the cytoplasm of tumor cells (200×); D. Hemorrhage is seen in the cortex and medulla of the ovary, the tumor tissue lacks mesenchymal cells and the vascular network is abundant (100×)图2 卵巢间质细胞瘤病理特征Fig.2 Pathological features of leydig cell tumor in ovary
3 讨 论
卵巢囊性成熟性畸胎瘤属于生殖细胞肿瘤[2],间质细胞瘤(leydig cell tumor,LCT)属于性索间质肿瘤,两者生长于同一卵巢在临床上极为少见[1]。卵巢囊性成熟性畸胎瘤起源于减数分裂后的生殖细胞,主要显示一个或更多的囊,内衬表皮及皮肤附属器,通常含有一个或更多其他成熟组织[3]。卵巢间质细胞瘤绝大多数为良性肿瘤,手术切除后预后良好[4]。镜下间质细胞瘤的瘤细胞圆形或多角形,大小一致,可有一个或多个嗜碱性核仁,细胞质丰富,嗜碱性颗粒状或空泡状,纯间质细胞瘤多数由卵巢门细胞发生,少数由卵巢间质发生,间质内血管丰富[5]。
LCT是一种雄性睾丸间质的罕见肿瘤。LCT的产生机制尚不明确,有研究认为是由于产生过量的促黄体生成激素,引起了内分泌紊乱导致间质细胞的过度分泌[6];还有研究认为是雄激素过多所致。众所周知,间质细胞是分泌雄激素的细胞来源,雄激素旺盛会导致雌性排卵功能障碍并表现出雄性的一些特征,例如,掉毛,痤疮和长期激素失衡导致生殖器官畸形[7]。LCT作为类固醇分泌肿瘤的一种,可直接产生雄性激素(主要是睾酮),也可通过产生雌二醇或使睾酮外周结构部分芳构化来产生雌激素。患有此种肿瘤的雄性动物会出现性早熟的症状(阴茎的生长发育,加速骨骼发育,肌肉得到加强),成年雄性会出现性欲减退,不孕,睾丸内有肿块,乳房发育[8];雌性表现为多毛症,阴蒂肥大,身体脂肪含量及肌肉质量比发生明显改变,乳房萎缩,声音低沉[9]。当患者出现雌性化或雄性化的症状时,临床医生应对LCT进行鉴别诊断。WHO在卵巢肿瘤分类中将LCT单独归为一组,主要分为间质黄素瘤、LCT以及类固醇细胞瘤三大类[10],其中卵巢间质细胞瘤发病率仅为15%。LCT的病理组织学检查通常是根据肿瘤细胞的形态特征进行确诊,患有卵巢间质细胞瘤57%的病例在瘤细胞细胞质中或细胞核中可见Reinke结晶,少部分含嗜酸性颗粒或呈空泡状,LCT一般为单侧,表面光滑,瘤细胞多呈大圆形或多边形,细胞质透亮[4]。良性肿瘤直径一般小于6 cm,细胞无异型性,核分裂象小于1个/10 HPF(high power field,HPF)[11]。恶性者直径一般大于6 cm,核分裂象大于2个/10 HPF,细胞有中度以上异型性[12]。大约20%的病人患有间质细胞瘤会发生转移性病变,早期治疗对于防止肿瘤恶化是非常必要的[13]。
畸胎瘤起源于潜在多功能的原始胚细胞,是一种性腺生殖细胞肿瘤[14]。卵巢畸胎瘤多数为良性肿瘤,好发于育龄期,占该器官肿瘤发病率的14%~45%,肿瘤结构通常由两个以上胚层的不同组织成分形成,包括骨骼、牙齿、毛发、神经和油脂等。按组织病理学分类可将畸胎瘤分为两种类型:(1)成熟型畸胎瘤(皮样囊肿),即良性畸胎瘤,由三个胚层中至少两个成熟的成分组成,以囊性畸胎瘤为主,实质性的很少见;(2)未成熟型畸胎瘤,多为实质性钙化征象,在分化成熟的组织结构中,常混有未成熟的胚胎组织,约5%的卵巢畸胎瘤是不成熟的,转移率高达32%~58%,可以发生在腹腔(肾、肠系膜、胰腺)内或是其他部位(骨、肺)[15]。而本病例中的卵巢成熟性畸胎瘤需要与恶性畸胎瘤鉴别,卵巢成熟型畸胎瘤是卵巢常见的肿瘤之一,任何年龄均可发生,但好发于育龄阶段[16-17]。恶性畸胎瘤也是未成熟型畸胎瘤,其实性组织成分较多,钙化密度低,容易侵犯周围的组织或邻近器官,可转移,常为神经胶质或神经管样的结构,多有未分化,有丝分裂增多的恶性病理表现[18]。本病例肿瘤囊内脂肪成分较多,以液体的状态存在,与周围组织界限清晰,盆腔内未见明显结节或肿块,可资鉴别。畸胎瘤常有多种并发症,如压迫致使后肠梗阻,尿潴留,表现为腹痛,排便困难,排尿不畅或尿频等症状。腹腔探查肿瘤囊与其他脏器并未发现粘连,患犬无任何腹痛及排便困难等症状。
文献报道,卵巢成熟型畸胎瘤恶变预后不良,生存率仅为15%~30.8%[19],对良性畸胎瘤应尽可能早的完整切除肿瘤,不应有任何残留,因为残留的瘤组织复发后有恶性变的可能。1只1.5岁的杜宾犬同侧卵巢患有卵巢畸胎瘤合并卵巢颗粒细胞瘤,采取肿块切除术,并进行两个周期的卡铂治疗,6周后病情发生转移并出现呼吸苦难的症状,后实施安乐死[20]。成熟畸胎瘤极易发生蒂扭转、破裂、感染及变性。且随着发病年龄的增长和临床病史的延长,良性肿瘤恶变率相应升高。一经确诊,根据患畜年龄及畜主对生育的要求和对侧卵巢状况决定手术范围,尽早实施手术治疗。卵巢畸胎瘤并发卵巢间质细胞瘤,肿瘤多为单侧发生,如患畜年龄小,畸胎瘤的手术原则是对于良性成熟性肿瘤尽量保留生育功能的采取单侧附件切除,如无生育要求患畜可行双侧附件及子宫切除术。一旦根据病理组织学特点确定为恶性肿瘤,手术要点是完整地切除肿瘤,卵巢和睾丸肿瘤均作一侧卵巢或睾丸切除,以免残留多功能细胞而导致肿瘤复发。治疗卵巢间质细胞瘤的标准方法是采取切除卵巢(睾丸)[21],但也存在几例采取器官保留术结合术中活组织检查的病例,预后理想[22-23],保守治疗发生局部复发需行全部切除术。本例肿瘤细胞无异型性,尚未发现核分裂象,组织内无坏死,所以诊断为良性,采取手术切除患侧附件即可。
4 结 论
临床确诊1例2岁雌性边境牧羊犬患卵巢囊性成熟性畸胎瘤合并卵巢间质细胞瘤,病理检查为良性。行绝育术后恢复良好,回访无异常。
参考文献(References):
[1] 范嫏娣. 卵巢临床与病理[M]. 天津: 天津科学技术出版社, 1993.
FAN L D. Ovarian clinic and pathology of the ovary[M]. Tianjin: Tianjin Science and Technology Press, 1993. (in Chinese)
[2] FLETCHER C D M. 肿瘤组织病理诊断[M]. 周庚寅, 刘洪琪, 张庆慧, 译. 济南: 山东科学技术出版社, 2001.
FLETCHER C D M. Diagnostic histopathology of tumors[M]. ZHOU G Y, LIU H Q, ZHANG Q H, trans. Jinan: Shandong Science and Technology Press, 2001. (in Chinese)
[3] 孙春龙, 杨 丽. 卵巢囊性成熟性畸胎瘤伴腹膜神经胶质瘤病一例[J]. 中华病理学杂志, 2009, 38(9): 646.
SUN C L, YANG L. Ovarian mature cystic teratoma with gliomatosis peritonei: Report of a case[J].ChineseJournalofPathology, 2009, 38(9): 646. (in Chinese)
[4] 熊淑杰, 高咏慧. 卵巢间质细胞瘤1例并临床病理分析[J]. 中国社区医师: 医学专业, 2008(15): 160.
XIONG S J, GAO Y H. A case of ovarian stromal tumor and clinicopathological analysis[J].ChineseCommunityDoctors:MedicalProfession, 2008(15): 160. (in Chinese)
[5] 刘彤华. 诊断病理学图谱[M]. 北京: 人民卫生出版社, 1998.
LIU T H. Diagnostic pathology atlas[M]. Beijing: People's Medical Publishing House (PMPH), 1998. (in Chinese)
[6] AL-AGHA O M, AXIOTIS C A. An in-depth look at Leydig cell tumor of the testis[J].ArchPatholLabMed, 2007, 131(2): 311-317.
[7] AZZIZ R, SANCHEZ L A, KNOCHENHAUER E S, et al. Androgen excess in women: Experience with over 1000 consecutive patients[J].JClinEndocrinolMetab, 2004, 89(2): 453-462.
[8] SUARDI N, STRADA E, COLOMBO R, et al. Leydig cell tumour of the testis: presentation, therapy, long-term follow-up and the role of organ-sparing surgery in a single-institution experience[J].BJUInt, 2009, 103(2): 197-200.
[9] HOSKINS W J, PEREZ C A, YOUNG R C. Principles and practice of gynecologic oncology[M]. 4th ed. Philadelphia: Lippincott Williams & Wilkins, 2005.
[10] 张建民. WHO新的卵巢肿瘤组织学分类特点[J]. 中华病理学杂志, 2002, 31(2): 175-178.
ZHANG J M. WHO new histological classification of ovarian tumors[J].ChineseJournalofPathology, 2002, 31(2): 175-178. (in Chinese)
[11] 朱梅刚. 细胞核分裂象在肿瘤病理诊断中的作用[J]. 诊断病理学杂志, 2004, 11(1): 4-6.
ZHU M G. Role of mitotic figures in tumor pathological diagnosis[J].JournalofDiagnosticPathology, 2004, 11(1): 4-6. (in Chinese)
[12] 周 琦. 肿瘤专题讲座(4) 肿瘤的分化、间变和异型性[J]. 中国乡村医药, 1997, 4(5): 6-7.
ZHOU Q. Special lecture on tumor (4) Differentiation, variation and atypia of tumor[J].ChineseJournalofRuralMedicineandPharmacy, 1997, 4(5): 6-7. (in Chinese)
[13] HAJI A G, SHARMA S, BABU M, et al. Androgen secreting steroid cell tumor of the ovary in a young lactating women with acute onset of severe hyperandrogenism: a case report and review of literature[J].JMedCaseRep, 2007, 1: 182.
[14] MCKENNEY J K, HEEREMA-MCKENNEY A, ROUSE R V. Extragonadal germ cell tumors: a review with emphasis on pathologic features, clinical prognostic variables, and differential diagnostic considerations[J].AdvAnatPathol, 2007, 14(2): 69-92.
[15] SELVAGGI S M. Tumors of the ovary, maldeveloped gonads, fallopian tube, and broad ligament[J].ArchPatholLabMed, 2000, 124(3): 477.
[16] SATO T, HONTAKE S, SHIBUYA H, et al. A solid mature teratoma of a feline ovary[J].JFelineMedSurg, 2003, 5(6): 349-351.
[17] PATTERSON-KANE J C, SCHULMAN F Y, SANTIAGO N, et al. Mixed germ cell tumor in the eye of a dog[J].VetPathol, 2001, 38(6): 712-714.
[18] 韩志伟. 良性肿瘤 恶性肿瘤 类癌 癌前病变 息肉[J]. 中国社区医师, 1993(2): 4.
HAN Z W. Benign tumor, malignant tumor, carcinoid, precancerous lesion, polypus[J].ChineseCommunityDoctors, 1993(2): 4. (in Chinese)
[19] 闫晓娟, 鹿 欣. 卵巢肿瘤[M]. 北京: 科学技术文献出版社, 2009.
YAN X J, LU X. Ovarian tumours[M]. Beijing: Scientific and Technical Documentation Press, 2009. (in Chinese)
[20] COGGESHALL J D, FRANKS J N, WILSON D U, et al. Primary ovarian teratoma and GCT with intra-abdominal metastasis in a dog[J].JAmAnimHospAssoc, 2012, 48(6): 424-428.
[21] CARMIGNANI L, SALVIONI R, GADDA F, et al. Long-term followup and clinical characteristics of testicular Leydig cell tumor: experience with 24 case[J].JUrol, 2006, 176(5): 2040-2043.
[22] CARMIGNANI L, COLOMBO R, GADDA F, et al. Conservative surgical therapy for Leydig cell tumor[J].JUrol, 2007, 178(2): 507-511.
[23] GHEORGHISAN-GALATEANU A A. Leydig cell tumors of the testis: a case report[J].BMCResNotes, 2014, 7: 656.
