K亚群禽白血病病毒5′LTR序列及启动活性分析
2018-05-07赵子君饶明章袁丽霞曹伟胜
赵子君,饶明章,陈 建,张 杰,袁丽霞,廖 明,曹伟胜
(华南农业大学兽医学院,农业部兽用疫苗创制重点实验室,广东省动物源性人兽共患病预防与控制重点实验室,广州 510642)
禽白血病病毒(avian leukosis virus, ALVs)属于反转录病毒科、α反转录病毒属,是一类能够引起禽类多种肿瘤性疾病的病毒群,对养禽生产危害巨大。根据宿主范围、囊膜蛋白抗原性和交叉中和反应等,将其分为A~K共11个亚群,其中A~D、J和K亚群为外源性ALV,而 C、D亚群在野外极为少见[1];E~I 亚群为内源性 ALV,其中 E 亚群为整合在鸡染色体中一种前病毒 DNA,在鸡群中普遍存在,而 F~I 亚群主要感染野生禽类,包括雉、鹧鸪和鹌鹑等[2]。
K亚群禽白血病病毒(ALV-K)是2012年王鑫等[3-4]首次从我国地方品种芦花鸡中分离到的新亚群,随后,2014年郝建勇等[5]、2016年X.J.Li等[6]以及2017年H. X. Shao等[7]在我国地方鸡群中也分离到ALV-K。将这些新分离的ALV-K LTR部分与其余已知亚群LTR进行序列比对分析发现,除了王鑫等[3-4]分离到的ALV-K LTR部分属于外源性ALV外,其余地方分离到的ALV-K LTR部分均属于内源性ALV。值得注意的是,这种LTR为内源性的ALV-K毒株与我国台湾地区发生的神经胶质瘤突变株TW3539[8]高度相似,并且我国台湾地区的研究报道认为LTR为内源性的ALV-K在台湾地区很常见[8]。目前,本课题组还分离到14株LTR为内源性的ALV-K毒株,推测LTR是内源性的ALV-K毒株可能一直存在于我国地方品种鸡中。
ALV前病毒基因组结构中含两段长末端重复序列(5′LTR和3′LTR),包括R区、U5区和U3区,负责控制病毒基因的转录,不编码蛋白质,其中5′LTR是ALV基因表达的调控中心,与病毒复制、 翻译、 致瘤等密切相关。内源性和外源性ALV具有相同的结构特征,但LTR部分差异较大。张青婵[9]研究发现带有内源性LTR的ALV在DF-1细胞上的复制显著低于带有外源性LTR的ALV,病毒滴度可相差100倍,其推测ALV基因组中的LTR序列与ALV在细胞上的复制水平以及致病性有关,但未对LTR的启动活性作进一步探究。
本研究以源于广东某黄羽祖代种鸡场健康鸡群中分离到的ALV-K毒株(GDFX0601)作为研究对象,比较分析了其5′LTR核苷酸序列,并评估了ALV-K(GDFX0601)在DF-1细胞上的复制能力,且分别在DF-1、CEF和293T细胞上评估了不同亚群ALV毒株5′LTR的启动活性差异。
1 材料与方法
1.1 载体、细胞和质粒
pGL3-Basic、pGL3-Control和pRL-TK海肾荧光素酶载体购自美国Promega公司。DF-1细胞、CEF细胞、293T细胞和ALV-K毒株(GDFX0601)、ALV-A毒株(GD13)、ALV-B毒株(CD08)和ALV-J毒株(CHN06)均由农业部兽用疫苗创制重点实验室提供。
1.2 LTR片段的扩增与序列分析
ALV-K毒株(GDFX0601)和ALV-J毒株(CHN06)前病毒DNA为模板进行PCR扩增,反应条件:95 ℃ 预变性3 min;95 ℃ 变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min。PCR产物通过琼脂糖凝胶电泳和回收后,分别克隆至pMD18-T载体中,阳性重组质粒送至上海Invitrogen公司进行测序。测序结果用生物学软件DNAStar7.1及在线软件TFSEARCH进行序列相似性分析和细胞转录因子结合位点分析。
1.3 ALV-K(GDFX0601)在DF-1细胞上的复制
将ALV-K毒株(GDFX0601)、ALV-A毒株(GD13)、ALV-B毒株(CD08)和ALV-J毒株(CHN06),以每孔接种100 μL毒液(103.5TCID50),分别接种24孔细胞培养板中,5% CO2、10% FBS、37 ℃培养箱中培养。待接种毒液后第2天,细胞长满单层后,换为1% FBS的细胞维持液进行培养。连续培养7 d,期间持续监测细胞的生长情况,收集1~7 d的细胞上清液用IDEXX公司的Avian Leukosis Virus Antigen Test Kit进行检测,使用前试剂盒中所有试剂(包括包被板)应回温2 h以上,使其恢复至室温(18~25 ℃),试剂及冻融样品在使用前应轻轻振摇彻底混匀。
1.4 重组质粒的构建
重组质粒pGL3-Basic-GDFX0601-LTR、pGL3-Basic-CHN06-LTR、pGL3-Basic-ev-1-LTR、pGL3-Basic-JS11C1-LTR的构建。将ALV-K(GDFX0601)、ALV-J、ALV-E和LTR为外源性的ALV-K(JS11C1) LTR的PCR产物和不含启动子的萤光素酶报告基因载体pGL3-Basic分别用KpnⅠ和HindⅢ双酶切后回收。将双酶切后的LTR回收产物分别与pGL3-Basic进行连接,重组质粒经初步鉴定正确后送广州艾基生物技术有限公司测序验证。
1.5 重组质粒的转染
用OMEGA去内毒素质粒提取试剂盒抽提pGL3-Basic-GDFX0601-LTR、pGL3-Basic-CHN06-LTR、pGL3-Basic-ev-1-LTR、pGL3-Basic-JS11C1-LTR质粒。消化前期准备的DF-1细胞、CEF细胞和293T细胞,铺24孔细胞培养板,10% FBS,5% CO2、37 ℃培养。24 h内进行转染,Corning公司24孔 细胞培养板每孔转染体系为:1 μg质粒(900 ng重组质粒和100 ng 海肾荧光素酶内参质粒)和2.5 μL POLOdeliverer 3000分别用50 μL Opti-MEM®稀释并孵育5 min,然后再混合,共同孵育15 min,将100 μL质粒-脂质体复合物加入到准备好的24孔细胞培养皿中。按照上海锐赛POLOdeliverer 3000转染试剂盒操作说明进行转染。
1.6 荧光素酶的检测
转染后的细胞,培养48 h后,按Promega双荧光检测试剂盒(Dual -Luciferase®Reporter Assay System)说明书操作进行荧光素酶的检测。主要步骤有用细胞裂解缓冲液裂解细胞,检测萤火虫荧光信号和海肾荧光信号,二者比值即为重组质粒启动活性。
2 结 果
2.1 LTR相似性及转录结合位点分析
利用DNAStar7.1基因分析软件对ALV-K(GDFX0601)毒株的LTR基因核苷酸序列与GenBank中已公开发表的国内外各参考毒株的LTR基因核苷酸序列进行相似性分析,发现外源性ALV LTR的大小在325 bp左右,内源性ALV LTR的大小在274 bp左右,ALV-J国外参考株(HPRS103)的LTR长度为325 bp,其中U3为224 bp,R为21 bp,U5为80 bp。经典外源性ALV-A、ALV-B和ALV-J之间LTR的相似性在80%左右,与内源性ALV-E LTR的相似性最高只有70%左右。将本课题组分离到的ALV-K(GDFX0601)毒株进行相似性分析,发现其LTR与ALV-E相似性高达98.5%,与外源性ALV相似性只有70%(图1),与已报道的台湾株(TW3539)相似性达99%(图1)。
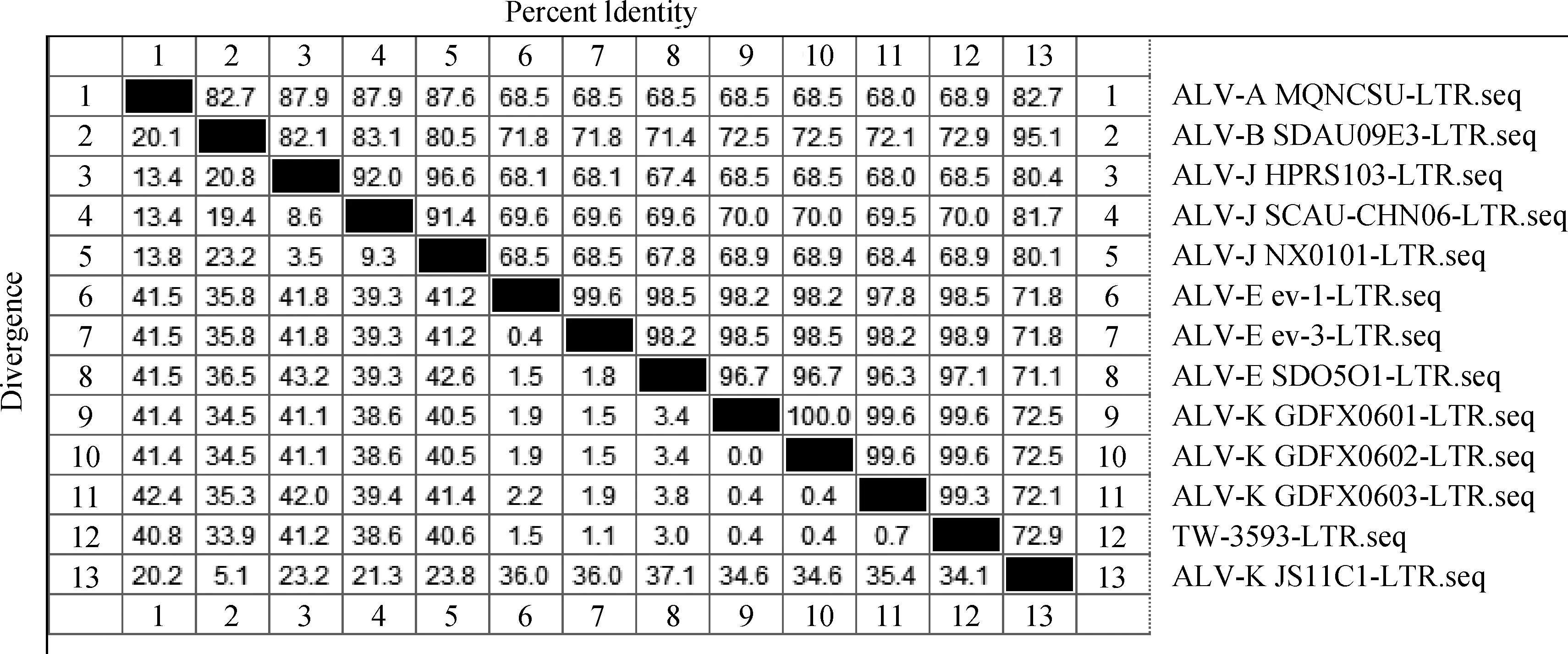
上三角表示相似性,下三角表示分歧度Data in upper-triangle is percent indentity, data in lower-triangle is divergence图1 ALV-K(GDFX0601)与不同亚群ALV参考株LTR基因核苷酸序列相似性分析Fig.1 The homology of nucleotide sequences of LTR of subgroup K ALV isolates and other reference strains
2.2 LTR转录因子结合位点分析
ALV-K (GDFX0601) LTR与其他参考毒株相比R区域与所有参考毒株相似性较高,U5区域和外源性病毒有83.3% ~93.6%的相似性,相似性也较高,而包括CArG box、Y box、PRE box、CAAT box和 TATA box 等转录调节元件的U3 区域与外源性病毒差异较大,其中CAAT box、CArG box和TATA box均有碱基突变(图2)。ALV-K (GDFX0601) LTR U3 区域的转录调节元件和ALV-E一致,相对保守(图2)。
2.3 ALV-K(GDFX0601)在DF-1细胞上的复制动力学
将ALV-A、ALV-B、ALV-J和ALV-K(GDFX0601)接种DF-1细胞培养,连续7 d取细胞培养上清ELISA检测p27抗原,检测结果显示:ALV-K(GDFX0601)在DF-1细胞上的增殖能力显著低于ALV-A、ALV-B和ALV-J (P<0.05,图3)。这表明ALV-K(GDFX0601)在细胞上的复制速度与其感染能力弱于ALV-A、ALV-B和ALV-J。
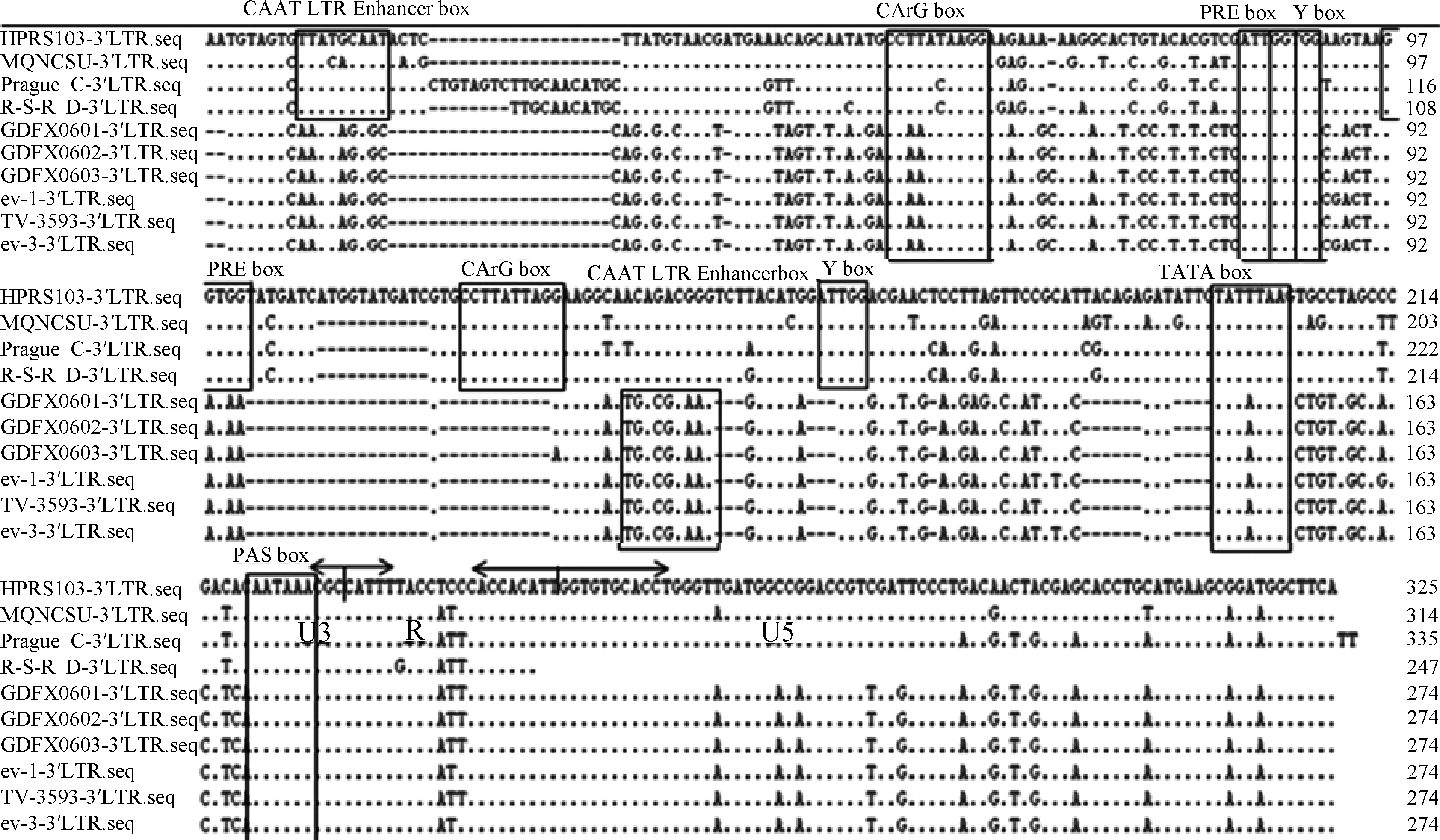
箭头表示U3区、R区和U5区划分;·代表碱基相同,而字母代表碱基突变;-代表碱基缺失;方框代表不同的转录调节元件The arrows indicate the division of the U3, R and U5 zones; Dots (·) indicate identical residues, while letters indicate base substitutions. Dashes (-) indicate gaps in the alignment. Locations of putative transcriptional regulatory elements are indicated in boxes and are marked图2 ALV LTR各区域核苷酸序列及转录因子结合位点分析Fig.2 Nucleotide sequence alignments and motifs of the ALV LTR region
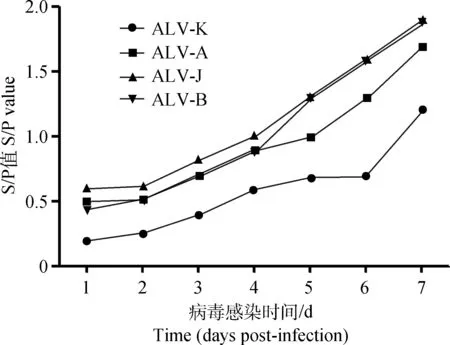
图3 ALV-A、ALV-B、ALV-J和ALV-K在DF-1细胞中复制Fig.3 Replication of the ALV-A, ALV-B, ALV-J, and ALV-K in DF-1 cells
2.4 在DF-1上各毒株LTR启动活性的比较
在DF-1细胞上转染ALV-K(GDFX0601)LTR、 ALV-J(HN06)LTR、ALV-E (ev-1) LTR和ALV-K(JS11C1)LTR含荧光素酶报告基因重组质粒,结果显示ALV-K(GDFX0601)LTR重组质粒的荧光素酶的平均相对表达量均低于ALV-J(CHN06)LTR和王鑫等[3]分离到的LTR为外源性的ALV-K (JS11C1)LTR重组质粒,但高于ALV-E (ev-1) LTR(图4)。
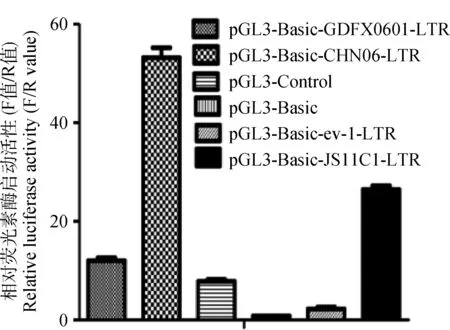
图4 含不同LTR重组质粒在DF-1细胞的荧光素酶启动活性分析Fig.4 Luciferase activity analysis of DF-1 cells with different LTR recombinant plasmids
2.5 在CEF上各毒株LTR启动活性的比较
由于ALV-K(GDFX0601)的LTR部分属于内源性ALV,本研究又在可感染ALV-E 的CEF细胞上进行试验,试验结果与在DF-1细胞上一致(图5),说明ALV-K(GDFX0601)毒株LTR的启动活性比ALV-J和LTR为外源性的ALV-K(JS11C1)毒株LTR的启动活性弱。
图5 含不同LTR重组质粒在CEF细胞的荧光素酶启动活性分析Fig.5 Luciferase activity analysis of CEF cells with different LTR recombinant plasmids
2.6 在293T上各毒株LTR启动活性的比较
本研究同时在293T细胞上进行试验,结果发现转染含ALV-K(GDFX0601)LTR重组质粒的荧光素酶的平均相对表达量也均低于转染ALV-J(CHN06)LTR和LTR为外源性的ALV-K(JS11C1)LTR重组质粒,但高于转染内源性ALV(ev-1)LTR(图6)。结果再次说明LTR属于内源性毒株的ALV-K(GDFX0601)的LTR的启动活性比外源性ALV-J毒株和LTR为外源性的ALV-K(JS11C1)毒株的LTR的启动活性弱。
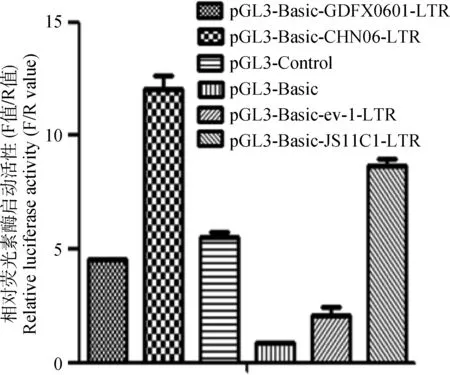
图6 含不同LTR重组质粒在293T细胞的荧光素酶启动活性分析Fig.6 Luciferase activity analysis of 293T cells with different LTR recombinant plasmids
3 讨 论
近几年来,ALV在我国流行情况依然严重,不同亚群ALV感染我国地方品系鸡均有相关报道,包括ALV-A、B、E、J、K[3,10-12]。中国作为养禽大国,养殖数量大、品种多、养殖场分散,使得ALV的净化和防控难以有效实施,加上禽白血病可通过垂直传播,严重影响雏鸡的质量,还可引起鸡群直接发病而死亡或使感染鸡群产生免疫抑制而继发其他疾病,从而降低疫苗免疫应答效果,影响鸡的生产性能[13-15],给养殖业造成了巨大的损失。在外源性ALV中,以ALV-A、ALV-B和ALV-J为主,对养禽生产的危害较大[13]。2012年,王鑫等[3-4]从我国芦花鸡中分离到3株毒株,鉴于其gp85基因不同于其他各已知亚群,故将其命名为ALV-K;随后,2014年郝建勇等[5]和2016年X.J.Li等[6]从广东地方品系鸡中、2017年H. X. Shao等[7]从江苏也分离到该亚群病毒,ALV-K在我国地方种鸡中逐渐流行起来。2017年从山东地区肉鸡中鉴定到一株ALV-K并完成其全基因组序列分析[16]。值得注意的是,2014年后分离到的ALV-K 其LTR部分均属于内源性ALV,大小与内源性病毒相近,而王鑫等[3]分离到的ALV-K的LTR大小与外源性病毒相近。
ALV基因组结构主要由5′LTR-gag-pol-env-LTR3′组成,长末端重复序列LTR不编码蛋白质,分别由3′独特区U3、 短重复区R 及 5′独特区U5 3部分组成。ALV的LTR与病毒复制、 翻译、 致瘤等密切相关[17]。5′LTR是反转录病毒基因表达的调控中心。ALV-K作为新的亚群,近些年在我国很多地方品系鸡中被分离到[3, 5-7],但有关其生物学特性的研究报道相对较少,本研究以LTR为内源性的ALV-K(GDFX0601)毒株为研究对象,感染DF-1细胞并将其LTR部分克隆进pGL3-Basic载体。对LTR基因核苷酸序列进行相似性分析,发现ALV-K(GDFX0601)LTR部分大小只有274 bp,与内源性ALV LTR相似性大于98.5%,而与外源性ALV LTR相似性小于72.5%;LTR区的U3是强转录调控单位,决定LTR启动活性强弱,序列分析结果显示ALV-K(GDFX0601)U3区的转录调节元件与其他外源性ALV差异较大,与内源性ALV相似性较高。本研究进一步将ALV-K(GDFX0601)接种DF-1细胞,发现LTR为内源性的ALV-K(GDFX0601)在细胞上的复制速度较LTR为外源性毒株慢,这与张青婵[9]将LTR为内源性及外源性的ALV-A同时接种DF-1细胞的研究结果一致,LTR为内源性的毒株在DF-1细胞上复制更慢,病毒滴度更低。由于LTR为内源性的毒株复制速度慢,可致p27抗原表达水平低,易使ELISA方法漏检已感染这类外源性病毒的鸡,从而造成广泛传播,这应该引起足够的重视。根据研究结果推测ALV-K(GDFX0601)的复制能力低可能与其5′LTR基因密切相关。
本课题组张贺楠等[18]在体外细胞水平分析显示不同病变型ALV-J国内分离株LTR之间的启动活性差异不显著,之后本课题组冯少珍等[19]研究发现ALV-J LTR启动活性高于ALV-A和ALV-B,但其并未报道ALV-E LTR的启动活性。因此,本研究选择ALV-J (CHN06)、ALV-E (ev-1)、ALV-K (GDFX0601)和LTR为外源性的ALV-K (JS11C1) 5′LTR作为研究对象,分析LTR启动活性差异,为了避免重复,本研究没有选择ALV-A和ALV-B LTR。pGL3-Basic载体缺少启动子序列,但有荧光素酶报告系统,将LTR序列插入pGL3-Basic载体,可以通过检测荧光素酶活性,反映LTR启动活性的强弱;pGL3-Control载体具有启动子序列,能启动荧光素酶的表达,作为对照;PRL海肾荧光素酶载体为内参。5′LTR的启动活性试验结果发现ALV-K(GDFX0601) LTR的启动活性比ALV-J(HN06)和LTR为外源性的ALV-K(JS11C1)的启动活性弱。由于LTR为内源性的ALV-K启动活性弱,而导致其复制能力低,使得ELISA检测血浆或者泄殖腔样本时漏检。目前我国地方品系鸡群中分离到的LTR为内源性的ALV-K,究竟是王鑫等[3]分离到的ALV-K毒株在净化演变过程中与内源性病毒发生了重组,还是内源性病毒与外源性病毒发生重组从而产生LTR属于外源性的ALV-K毒株,即ALV-K本身LTR是内源性还是外源性还有待进一步探究。
4 结 论
大部分反转录病毒LTR序列不仅具有真核生物启动活性,而且具有原核细胞启动活性,目前鲜有对ALV-K 5′LTR启动活性研究的报道。本研究验证了LTR属于内源性的ALV-K(GDFX0601)的 5′LTR启动活性低于5′LTR属于外源性的ALV毒株(P<0.05),这可能是ALV-K(GDFX0601)复制能力和致病性弱的原因。同时试验结果显示转染ALV-K (GDFX0601)毒株LTR启动活性高于转染ALV-E(ev-1)毒株LTR,究其LTR属于内源性毒株的ALV-K (GDFX0601)LTR比内源性毒株LTR启动活性高的原因,推测与LTR U3区碱基的突变有关。本研究也为进一步研究内源性ALV LTR调控病毒复制的机制奠定了基础。
参考文献(References):
[1] 杨玉莹. J亚群禽白血病病毒研究进展[J]. 中国病毒学, 2003, 18(1): 93-97.
YANG Y Y. Advance inAvianleukosisvirus subgroup J[J].VirologicaSinica, 2003, 18(1): 93-97. (in Chinese)
[2] PAYNE L N. Developments in avian[J].Leukemia, 1999, 6(3): 150-152.
[3] 王 鑫, 赵 鹏, 崔治中. 我国地方品种鸡分离到的一个禽白血病病毒新亚群的鉴定[J]. 病毒学报, 2012, 28(6): 609-614.
WANG X, ZHAO P, CUI Z Z. Identification of a new subgroup of avian leukosis virus isolated from Chinese indigenous chicken breeds[J].ChineseJournalofVirology, 2012, 28(6): 609-614. (in Chinese)
[4] CUI N, SU S, CHEN Z M, et al. Genomic sequence analysis and biological characteristics of a rescued clone of avian leukosis virus strain JS11C1, isolated from indigenous chickens[J].JGenVirol, 2014, 95(Pt 11): 2512-2522.
[5] 郝建勇, 秦建如, 邱倩倩, 等. 地方鸡种K亚群禽白血病病毒的分离及遗传鉴定[C]//中国畜牧兽医学会. 中国畜牧兽医学会2014年学术年会论文集. 广州: 中国畜牧兽医学会, 2014.
HAO J Y, QIN J R, QIU Q Q, et al. Identification and evolution analysis of ALV-K isolated from local Chinese chicken[C]. Guangzhou: Chinese Association of Animal Science and Veterinary Medicine, 2014. (in Chinese)
[6] LI X J, LIN W C, CHANG S, et al. Isolation, identification and evolution analysis of a novel subgroup of avian leukosis virus isolated from a local Chinese yellow broiler in South China[J].ArchVirol, 2016, 161(10): 2717-2725.
[7] SHAO H X, WANG L, SANG J J, et al. Novel avian leukosis viruses from domestic chicken breeds in mainland China[J].ArchVirol, 2017, 162(7): 2073-2076.
[8] CHANG S W, HSU M F, WANG C H. Gene detection, virus isolation, and sequence analysis of avian leukosis viruses in Taiwan country chickens[J].AvianDis, 2013, 57(2): 172-177.
[9] 张青婵. A亚群禽白血病病毒不同分离株的基因组和生物学特性比较[D]. 泰安: 山东农业大学, 2010.
ZHANG Q C. Comparison of genome and biological characteristic of different subgroup A avian leukosis virus strains[D]. Tai’an: Shandong Agricultural University, 2010. (in Chinese)
[10] 高玉龙, 邵华斌, 罗青平, 等. 2009年我国部分地区禽白血病分子流行病学调查[J]. 中国预防兽医学报, 2010, 32(1): 32-35, 43.
GAO Y L, SHAO H B, LUO Q P, et al. Molecular epidemiology of avian leukosis virus isolates from some regions of China in 2009[J].ChineseJournalofPreventiveVeterinaryMedicine, 2010, 32(1): 32-35, 43. (in Chinese)
[11] 王 帅. 地方品系鸡白血病流行病学调查与ALV p27基因的表达分析[D]. 泰安: 山东农业大学, 2013.
WANG S. Epidemiological investigation of avian leukosis in local strains chicken and expression analysis of ALV p27 gene[D]. Tai’an: Shandong Agricultural University, 2013. (in Chinese)
[12] 冯 敏, 谭利强, 代曼曼, 等. 种禽场A亚群禽白血病病原学调查及分离株遗传进化分析[J]. 华南农业大学学报, 2014, 35(4): 11-15.
FENG M, TAN L Q, DAI M M, et al. Etiology surveys and phylogenetic analyses of avian leukosis virus subgroup A isolated from breeder chickens farms[J].JournalofSouthChinaAgriculturalUniversity, 2014, 35(4): 11-15. (in Chinese)
[13] 郝建勇. 黄羽肉鸡配套系核心群AL净化方案的研究[D]. 广州: 华南农业大学, 2015.
HAO J Y. Eradication protocol study of Avian Leukosis in Yellow broiler chickens[D]. Guangzhou: South China Agricultural University, 2015. (in Chinese)
[14] 秦立廷, 高玉龙, 潘 伟, 等. 我国部分地区蛋鸡群ALV-J及与REV、MDV、CAV混合感染检测[J]. 中国预防兽医学报, 2010, 32(2): 90-93.
QIN L T, GAO Y L, PAN W, et al. Investigation of co-infection of ALV-J with REV, MDV, CAV in layer chicken flocks in some regions of China[J].ChineseJournalofPreventiveVeterinaryMedicine, 2010, 32(2): 90-93. (in Chinese)
[15] 张振杰, 刘绍琼, 王 波, 等. 地方品种皖南黄肉种鸡ALV-J与REV的共感染及其分子变异分析[J]. 中国农业科学, 2011, 44(11): 2379-2386.
ZHANG Z J, LIU S Q, WANG B, et al. Identification of co-infection of ALV-J and REV and molecular characterization of the two viruses isolated from Wannan yellow feather broilers[J].ScientiaAgriculturaSinica, 2011, 44(11): 2379-2386. (in Chinese)
[16] 李久庆, 刘 强, 郭 雷, 等. 一株新亚群禽白血病病毒全基因组序列分析[J]. 畜牧兽医学报, 2017, 48(9): 1718-1723.
LI J Q, LIU Q, GUO L, et al. Genomic sequence analysis of a new subgroup of avian leukosis virus[J].ActaVeterinariaetZootechnicaSinica, 2017, 48(9): 1718-1723. (in Chinese)
[17] BROWN D W, ROBINSON H L. Influence of env and long terminal repeat sequences on the tissue tropism of avian leukosis viruses[J].JVirol, 1988, 62(12): 4828-4831.
[18] 张贺楠, 齐 岩, 史伟伟, 等. 不同病变型J亚群禽白血病病毒LTR启动子序列分析及活性比较[J]. 病毒学报, 2010, 26(5): 402-406.
ZHANG H N, QI Y, SHI W W, et al. Sequence and promoter efficacy analysis of avian leukosis virus subgroup J strains of different pathotypes[J].ChineseJournalofVirology, 2010, 26(5): 402-406. (in Chinese)
[19] 冯少珍, 李 娇, 吴晓婵, 等. 不同亚群禽白血病病毒5′LTR序列及启动子活性分析[J]. 中国畜牧兽医, 2011, 38(8): 125-131.
FENG S Z, LI J, WU X C, et al. Sequence and promoter activity analysis of 5′LTR from different subgroups of avian leukosis viruses[J].ChinaAnimalHusbandry&VeterinaryMedicine, 2011, 38(8): 125-131. (in Chinese)
