猪丁型冠状病毒与猪流行性腹泻病毒双重实时荧光定量RT-PCR方法的建立和初步应用
2018-05-07罗尚星范京惠刘宝京师乾凯侯林杉左玉柱
罗尚星,范京惠*,刘宝京,师乾凯,侯林杉,左玉柱,2*
(1. 河北农业大学动物医学院,保定 071001;2. 河北农业大学动物科技学院,保定 071001)
猪丁型冠状病毒(porcine deltacoronavirus,PDCoV)属冠状病毒属,是一种以腹泻、脱水为临床症状的猪肠道传染病,各年龄段的猪均易感,其中新生仔猪最易发病[1]。本病于2012年首次于我国香港发现,2014年于美国大面积暴发,后在韩国、加拿大均检出此病毒[2-4]。国内一些学者研究发现PDCoV的感染率为20%~30%,个别地区高达40%[5-7],使猪场腹泻形势更加严峻。猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)是目前我国引起仔猪腹泻的主要病原,自1976年传至我国以来,给养猪业造成了严重的效益损失,2010年由于PEDV流行毒株的变异,导致中国南方十余个省份上亿头仔猪死亡[8-9]。由于感染PDCoV的动物临床症状与感染PEDV的动物临床症状相似,且PDCoV常与PDEV等发生混合感染,导致确诊困难,因此,建立一种快速、准确而又灵敏的检测手段对于仔猪腹泻病的确诊、监控及分子流行病学调查等均具有重要意义。
目前用于PDCoV和PEDV检测RT-PCR方法较多,有单一RT-PCR也有多联RT-PCR的方法,但无论PDCoV还是PEDV,一旦发病,肠道内的病原数量不稳定,常规RT-PCR有可能由于敏感性低出现较高的假阴性较多,并且不能进行准确的定量,且由于后续需要电泳才能观察结果,存在安全问题;荧光定量RT-PCR检测方法因具有快速,简便,安全,灵敏度高,且可定量等优点,是一种更适用于临床检测的检测方法。
本研究根据PDCoV和PEDV的保守基因序列设计了两对特异性引物,分别扩增其保守区基因并将其克隆至pMD19-T载体,以梯度稀释的混合重组质粒为标准品,利用SYBR Green I染料的非特异性与PDCoV和PEDV的cDNA分别进行结合,并利用RT-PCR中扩增片段的Tm值的不同进行核酸片段的区分,构建了检测PDCoV和PEDV的双重荧光定量RT-PCR方法。为仔猪腹泻病的诊断及分子流行病学调查提供了一种快速、定量检测方法。
1 材料与方法
1.1 病毒
猪丁型冠状病毒(PDCoV)HB-BD株(N基因GenBank登陆号KY129986),猪流行性腹泻病毒(PEDV)HB/HS株(M基因登录号:JF690779)、猪伪狂犬病毒(PRV)、猪博卡病毒(PBoV)、猪传染性胃肠炎病毒(TGEV)、猪圆环病毒Ⅱ型(PCV2)均由河北农业大学动物医学院动物传染病实验室分离并保存。
1.2 临床样品
2016—2017年在河北省保定市、石家庄市、邯郸市以及张家口市等地区,发生腹泻病新生仔猪的肠道内容物130份,-80 ℃保存备用。
1.3 主要试剂
RNA提取试剂盒和Top Green qPCR Super Mix 为TransStart 公司产品;反转录试剂盒、DL2000 DNA Marker 、pMD19-T 载体等为TaKaRa 公司产品;罗氏96型荧光定量 PCR仪为罗氏诊断产品(上海)有限公司产品;Nanodrop 2000为美国Thermo Scientific 公司产品。
1.4 引物的设计
根据GenBank中登陆的PDCoV基因序列设计了一对特异性引物,对PDCoV的N基因保守序列进行扩增。上游引物NF1:5′-TACTGGTGCCAATGTCGGCTCTG-3′,下游引物NR1:5′- AGTTGGTTTGGTGGGTGGCTCAT -3′ 由三博远志公司合成。根据 GenBank 登录的 PEDV的M基因序列,设计荧光定量 RT-PCR 引物,PEDVF1:5′-GGTGGTCTTTCAATCCTG-3′,PEDVF2:5′-GCAACCTTATAGCCCTCT-3′。引物由三博远志公司合成。
1.5 病毒cDNA的获取
按照RNA提取试剂盒说明书进行病毒核酸的提取,将提取的核酸产物通过反转录试剂盒进行反转录,获得cDNA。
1.6 荧光定量RT-PCR方法的建立
1.6.1 标准品的制备 将PDCoV和PEDV的 cDNA分别使用特异性引物进行PCR扩增,扩增体系含有模板cDNA 4 μL,dNTP 3 μL,10×Buffer (2.5 μmol·L-1)2.5 μL,上、下游引物(20 μmol·L-1)各1 μL,Taq酶(5 U·μL-1) 0.5 μL。PDCoV的反应程序:94 ℃ 5 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸5 min。PEDV反应程序:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 延伸5 min。将扩增的目的基因片段与载体pMD19-T连接并转化至大肠杆菌DH5α。重组质粒经PCR鉴定并送至上海生工生物工程技术服务有限公司测序。测序结果与GenBank 序列比对无误后,通过Nanodrop 2000测定质粒的OD值,用公式转换成拷贝数,作为标准品。
1.6.2 单一荧光定量RT-PCR的反应 将制备的标准品分别进行10倍梯度稀释后进行PCR扩增。每个梯度做三个重复,对扩增结果进行分析,建立各自的标准曲线。同时对其熔解曲线进行分析,以排除引物二聚体及非特异性扩增的干扰。反应体系为SYBR Green I Mix 7.5 μL,ROX Ⅱ 0.2 μL,上下游引物各(20 μmol·L-1)0.6 μL,模板1.5 μL,去离子水4.6 μL。PDCoV的反应条件:95 ℃ 5 min;95 ℃ 20 s,59 ℃ 20 s,72 ℃ 20 s,35个循环;PEDV的反应条件:95 ℃ 5 min;95 ℃ 20 s,53 ℃ 20 s,72 ℃ 20 s,35个循环。同时设置无菌水为阴性对照。
1.6.3 多重荧光定量RT-PCR的反应 对多重荧光定量RT-PCR的反应温度,反应体系进行优化,确定反应条件。以梯度稀释的标准品为模板,反应体系为SYBR Green I Mix 7.5 μL,ROX Ⅱ 0.2 μL,PDCoV上下游引物(20 μmol·L-1)各0.2 μL,PEDV上下游引物(20 μmol·L-1)各0.6 μL,PEDV模板1.2 μL,PDCoV模板0.4 μL,去离子水4.4 μL。反应条件:95 ℃ 5 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 20 s,35个循环。同时设置无菌水为阴性对照。
1.6.4 敏感度试验 用有限稀释法对标准品进行稀释,用已经建立的反应条件进行定量检测,确定其敏感度。
1.6.5 特异性试验 提取病毒PCV2、PRV、PBoV、TGEV的核酸(其中TGEV的RNA提取后,经反转录得到cDNA),按本试验所建立的检测方法进行扩增,同时设置无菌水作为阴性对照,PDCoV和PEDV的混合重组质粒阳性对照,检测该方法的特异性。
1.6.6 重复性试验 将同一批不同稀释度的标准品按建立的方法重复3次进行组内重复试验,对3次不同时间段稀释的同一浓度的标准品进行组间重复试验,对试验结果进行统计,分析此方法的重复性。同时设置无菌水为阴性对照。
1.7 临床样品的检测
对收集的130份临床样品进行检测,以本实验室建立的PDCoV和PEDV的双重SYBR Green I荧光定量RT-PCR检测方法与普通RT-PCR检测方法进行同步检测,以掌握河北省腹泻病猪中PDCoV和PEDV的感染情况。
2 结 果
2.1 标准品的制备
用设计的特异性引物对提取的核酸进行特异性扩增,得到PDCoV(262 bp)和PEDV(145 bp)的预期大小基因片段。将PDCoV (262 bp)的片段与PEDV(145 bp)的片段分别克隆至pMD19-T载体后,经序列测定分析,与GenBank相应序列完全一致。重组质粒经Nanodrop 2000测定,PDCoV质粒的浓度为165 μg·mL-1,通过公式换算得到重组质粒的拷贝数为5.1×1010拷贝·μL-1,PEDV质粒的浓度为100 μg·mL-1,通过公式换算得到重组质粒的拷贝数为3.2×1010拷贝·μL-1。图1为重组质粒PCR鉴定图。
2.2 标准曲线的建立
将制备的标准品10倍梯度稀释后进行荧光定量RT-PCR扩增,通过系统自动分析软件分析,可以得到以拷贝数的对数为纵坐标,Ct值为横坐标绘制荧光定量RT-PCR的标准曲线(图2)。由图2可知,在101~108拷贝·μL-1的范围内,构建的2个标准品的标准曲线均呈现良好的线性关系,扩增效率均大于90%,相关系数R2均在0.99以上。标准曲线比较理想。
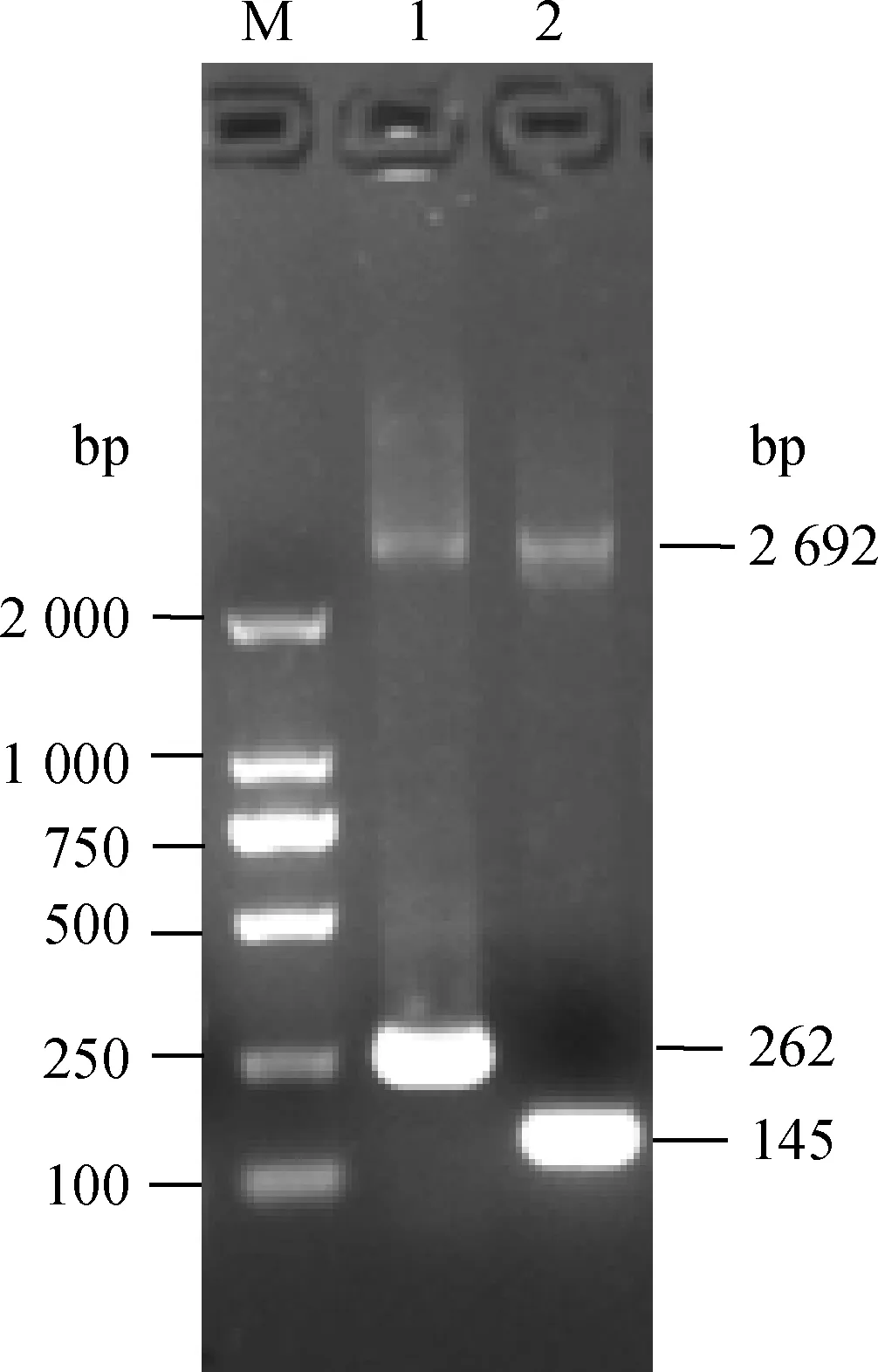
M. DL2000相对分子质量标准;1. PDCoV N基因条带;2. PEDV M基因条带M. DL2000 marker; 1. PDCoV N gene stripe; 2. PEDV M gene stripe图1 重组质粒PCR鉴定Fig.1 PCR identification of recombinant plasmid
2.3 熔解曲线的分析
标准品各个稀释度的熔解曲线有且仅有一个峰值,没有杂峰出现,其中PEDVM基因的熔解温度约为85 ℃,PDCoVN基因的熔解温度约为87 ℃(如图3A所示)。双重荧光定量熔解曲线图如图3B所示,熔解曲线有两个特异性峰值,分别为85和87 ℃,阴性对照没有峰值。
2.4 灵敏度分析
将标准品进行10倍梯度稀释,按照所建立的条件,进行荧光定量RT-PCR扩增。结果表明,双重的荧光定量RT-PCR最低可以检出含51拷贝·μL-1的PDCoV的样品,含32拷贝·μL-1的PEDV的样品。
2.5 特异性分析
利用建立的荧光定量RT-PCR方法对PBoV、TGEV、PCV2和PRV进行特异性检测,并选取PDCoV和PEDV的混合重组质粒以作为阳性对照,以去离子水作阴性对照,结果如图4所示,除阳性对照外,其他病毒与阴性对照均没有出现特异性扩增曲线,表明该检测方法的特异性较好。
2.6 重复性分析
为验证所建立的检测方法的重复性,对同一批稀释的标准品按建立的方法重复3次进行组内重复试验,并对3次不同时间稀释的同一浓度的标准品进行组间重复试验,结果显示,组内检测的变异系数为0.327%~1.901%,组间检测的变异系数为0.622%~2.858%,表明该方法具有较高的可重复性。
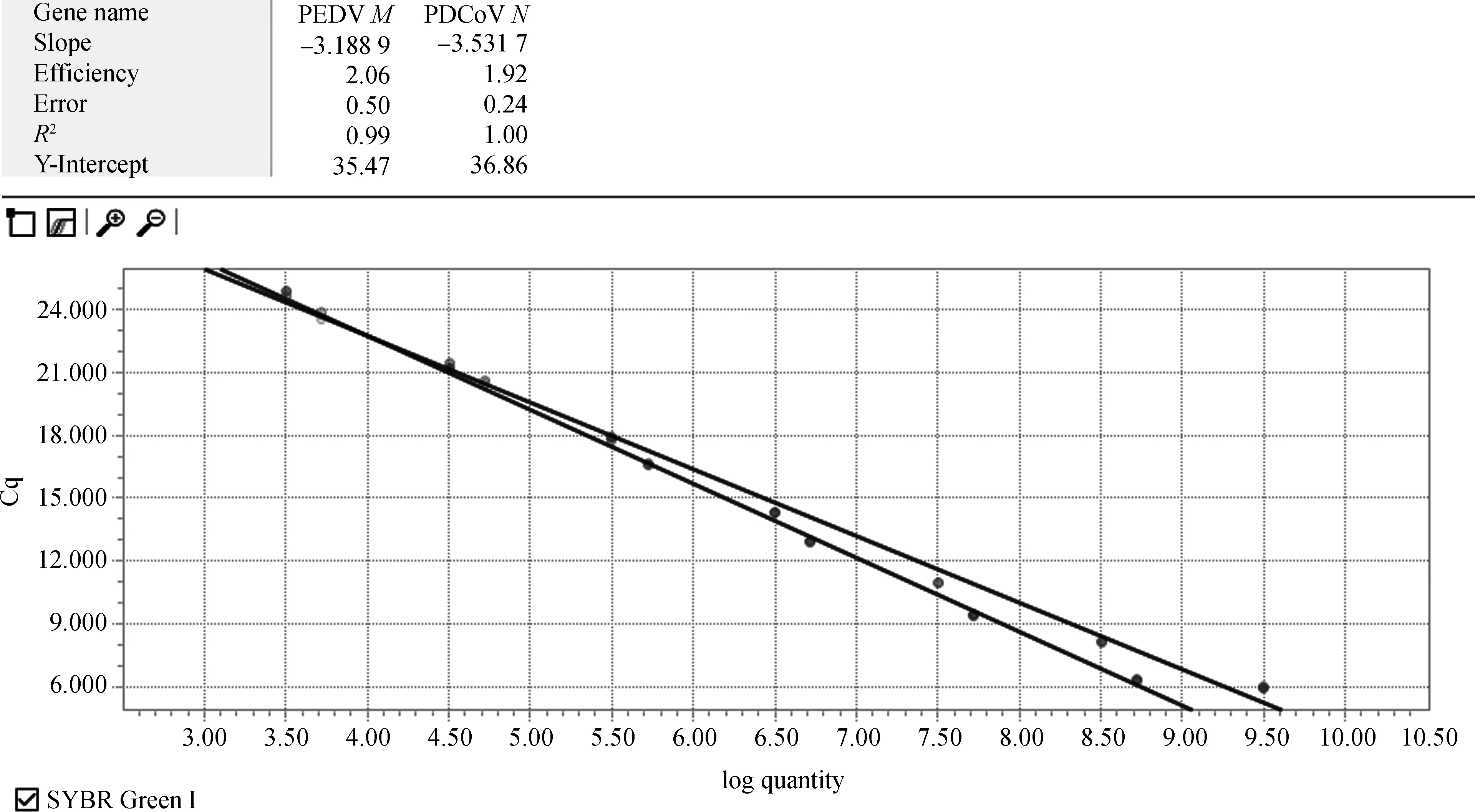
图2 荧光定量标准曲线Fig.2 Fluorometric standard graph

A. 标准品的熔解曲线;B. 双重荧光定量熔解曲线A. The melting curve of the standard product; B. Two fluorescence quantitative melting curves图3 熔解曲线的分析Fig.3 Analysis of the melting curve

1.PDCoV和PEDV的混合重组质粒;2~6. PBoV、TGEV、PCV2、PRV和水1.PDCoV and PEDV recombinant plasmid; 2-6. PBoV, TGEV, PCV2, PRV, and water图4 特异性检测Fig.4 Specificity detection
2.7 临床样品的检测
用本试验所建立的PDCoV和PEDV的双重荧光定量RT-PCR检测方法,与普通RT-PCR检测方法分别对来自河北省不同地区的130份临床样本进行检测。检测结果显示,普通RT-PCR检测方法检出率较双重荧光定量RT-PCR检测方法检出率低,双重荧光定量RT-PCR检测方法PDCoV的检出率为16.9%(22/130),PEDV的检出率为66.2%(86/130),二者同时感染的检出率为2.3%(3/130),普通RT-PCR检测方法的PDCoV检出率为11.5%(15/130),PEDV的检出率为60.8%(79/130),二者同时感染的检出率为0.8%(1/130),结果提示这两年引起仔猪腹泻的主要病原仍为猪流行性腹泻病毒。
3 讨 论
PDCoV又称δ冠状病毒,是继α冠状病毒属的PEDV和猪传染性胃肠炎病毒(TGEV)之后,发现的又一能引起猪腹泻的冠状病毒,可引起各个年龄段猪的呕吐和腹泻,以及哺乳仔猪的脱水和死亡[10]。猪流行性腹泻是由PEDV引起仔猪腹泻、呕吐的一种高致死性的肠道传染病[11]。两者发病率均较高,给我国养猪业造成了巨大的经济损失,目前二者并没有有效的药物进行防治,且在发病症状,病理变化上均无明显差异,又易发生混合感染,因此,建立一种快速、准确而又灵敏的检测手段,对PDCoV和PEDV进行多重检测,是非常有必要的。
近年来,多重RT-PCR的诊断方法已被很多学者用于病原混合感染的鉴别诊断。传统的检测方法(如细胞分离培养、酶联免疫吸附试验等)虽能对病原鉴别诊断,但其具有耗时长、检测灵敏度低的缺点。而多重荧光定量RT-PCR技术是目前鉴别诊断二者的最为快速、灵敏的方法。胡慧等建立了PDCoV和TGEV的多重RT-PCR检测引物及检测方法,其对PDCoV和TGEV的最低检测量分别为40.5和547拷贝·μL-1 [12];任玉鹏等建立一种同时检测PEDV、TGEV、PDCoV的多重RT-PCR方法,其最低检测量分别为60.96、102.69和58.85 pg[13];陈小芬建立了一种检测PEDV、TGEV和PDCoV三重RT-PCR检测方法,检出PEDV、TGEV、PDCoV的最低含量分别为33.4、28.56、322.3 pg[14]。本研究建立了一种检测PDCoV和PEDV 的双重SYBR Green I荧光定量PCR方法,与以上学者的结果相比,结果更为灵敏,敏感度更好一些。
SYBR Green I染料是一种非特异性染料,可以与DNA小沟进行结合,但其在多重PCR反应中并非均一结合,而会与某些片段优先结合[15],这就需要对其反应体系进行优化,本试验就对反应体系进行了优化,并最终确定了PDCoV和PEDV之间的比例。特异性试验结果显示,本试验建立的PDCoV和PEDV的双重SYBR Green I荧光定量RT-PCR方法,能特异的扩增PDCoV和PEDV的靶基因片段,并利用熔解曲线的特异性峰值进行区分,而PBoV、TGEV、PCV2、PRV及去离子水均未见特异的扩增曲线,提示该方法具有良好的特异性。对2016年至2017年在河北省不同地区收集的130份临床样本进行PDCoV检测,结果显示,PDCoV的检出率为16.9%,PEDV的检出率为66.2%,二者同时感染的检出率为2.3%,提示这两年引起仔猪腹泻的主要病原仍为PEDV,但河北省猪群中存在PDCoV的感染,应加强该病的防控。
4 结 论
建立了一种快速检测猪丁型冠状病毒(PDCoV)与猪流行性腹泻病毒(PEDV)的双重SYBR Green I荧光定量RT-PCR方法,其对PDCoV和PEDV的最低检测量分别为51和32拷贝·μL-1,与PBoV、TGEV、PRV、PCV2无交叉反应,特异性较好。用其检测130份仔猪腹泻样本,PDCoV检出率为16.9%,PEDV检出率为66.2%,二者同时感染的检出率为2.3%。为PDCoV和PEDV的诊断及分子流行病学调查提供了一种快速、定量检测方法。
参考文献(References):
[1] 方谱县, 方六荣, 董 楠, 等. 猪δ冠状病毒的研究进展[J]. 病毒学报, 2016, 32(2): 243-248.
FANG P X, FANG L R, DONG N, et al. Research advances in the porcine deltacoronavirus[J].ChineseJournalofVirology, 2016, 32(2): 243-248. (in Chinese)
[2] WOO P C Y, LAU S K P, LAM C S F, et al. Discovery of seven novel Mammalian and avian coronaviruses in the genusDeltacoronavirussupports bat coronaviruses as the gene source ofAlphacoronavirusandBetacoronavirusand avian coronaviruses as the gene source ofGammacoronavirusandDeltacoronavirus[J].JVirol, 2012, 86(7): 3995-4008.
[3] WANG L Y, BYRUM B, ZHANG Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014[J].EmergInfectDis, 2014, 20(7): 1227-1230.
2.2.3 教练员对运动员文化学习的监管情况 教练员与文化课老师就运动员的文化学习进行沟通、交流的情况,在一定程度上也会左右运动员的学习态度。调查发现,绝大多数教练员勤于与文化课老师进行沟通,这对于运动员的学习将会起到良好的监管和督促作用。只有个别教练员表示与文化课老师交流情况“一般”。显然,这不利于帮助运动员端正学习态度。这可能是由于教练员自身训练和比赛的压力较大,缺少时间,交通不便等,从而与文化课教师疏于沟通和配合。
[4] 陈建飞, 王潇博, 焦贺勋, 等. 国内首株猪德尔塔冠状病毒(Porcinedeltacoronavirus)的分离鉴定[J]. 中国预防兽医学报, 2016, 38(3): 171-174.
CHEN J F, WANG X B, JIAO H X, et al. Isolation and identification of the firstPorcinedeltacoronavirusstrain in China[J].ChineseJournalofPreventiveVeterinaryMedicine, 2016, 38(3): 171-174. (in Chinese)
[5] 逄凤娇, 俞正玉, 何孔旺, 等. 猪Deltacoronavirus RT-PCR检测方法的建立及其应用[J]. 中国预防兽医学报, 2015, 37(9): 683-686.
PANG F J, YU Z Y, HE K W, et al. Development and application of a RT-PCR assay for detection of porcine Deltacoronavirus[J].ChineseJournalofPreventiveVeterinaryMedicine, 2015, 37(9): 683-686. (in Chinese)
[6] 王逸雯. 猪丁型冠状病毒感染率调查、全基因组克隆及进化分析[D]. 杭州: 浙江大学, 2016.
WANG Y W. Detection、full Length genomic cDNA cloning and phylogenetic analysis of porcine Deltacoronavirus in China[D]. Hangzhou: Zhejiang University, 2016. (in Chinese)
[7] 张利卫, 曹贝贝, 张云飞, 等. 猪δ冠状病毒SYBR Green Ⅰ荧光定量RT-PCR检测方法的建立及初步应用[J]. 农业生物技术学报, 2017, 25(6): 969-975.
ZHANG L W, CAO B B, ZHANG Y F, et al. Development and application of SYBR Green Ⅰ real-time Reverse Transcription-PCR assay for detection ofPorcinedeltacoronavirus[J].JournalofAgriculturalBiotechnology, 2017, 25(6): 969-975. (in Chinese)
[8] SUN R Q, CAI R J, CHEN Y Q, et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China[J].EmergInfectDis, 2012, 18(1): 161-163.
[9] CHEN J F, LIU X Z, SHI D, et al. Complete genome sequence of a porcine epidemic diarrhea virus variant[J].JVirol, 2012, 86(6): 3408.
[10] SONG D, ZHOU X, PENG Q, et al. Newly emerged porcineDeltacoronavirusassociated with diarrhoea in swine in China: identification, prevalence and full-length genome sequence analysis[J].TransboundEmergDis, 2015, 62(6): 575-580.
[11] 甘孟侯, 杨汉春. 中国猪病学[M]. 北京: 中国农业出版社, 2005.
GAN M H, YANG H C. Chinese swine epidemiology[M]. Beijing: China Agriculture Press, 2005. (in Chinese)
[12] 胡 慧, 梁秀丽, 曹贝贝, 等. 猪德尔塔冠状病毒和猪传染性胃肠炎病毒多重RT-PCR检测引物及检测方法: 中国, CN105400910A[P]. 2016-03-16.
HU H, LIANG X L, CAO B B, et al. Porcine Deltacoronavirus and swine transmissible gastroenteritis virus multiplex RT-PCR detection primer and detection method: CN105400910A[P]. 2016-03-16. (in Chinese)
[13] 任玉鹏, 张 斌, 汤 承, 等. 同时检测PEDV和TGEV及PDCoV的多重RT-PCR方法的建立及初步应用[J]. 中国兽医科学, 2016, 46(6): 756-762.
REN Y P, ZHANG B, TANG C, et al. Development and application of a multiplex RT-PCR for detecting PEDV, TGEV and PDCoV[J].ChineseVeterinaryScience, 2016, 46(6): 756-762. (in Chinese)
[14] 陈小芬. PEDV/TGEV/PDCoV快速检测方法的建立及PEDV COE基因和ORF3基因遗传变异研究[D]. 广州: 华南农业大学, 2016.
CHEN X F. The Establishment of differential detection method to three different porcine diarrheal pathogene and gene sequence analysis to COE and ORF3 of PEDV[D]. Guangzhou: South China Agricultural University, 2016. (in Chinese)
[15] GIGLIO S, MONIS P T, SAINT C P. Demonstration of preferential binding of SYBR Green I to specific DNA fragments in real-time multiplex PCR[J].NucleicAcidsRes, 2003, 31(22): e136.
