肉牛克雷伯氏菌和溶血性曼氏杆菌混合感染的实验室诊断
2018-05-07于季申倪宏波
于季申,李 鹏,倪宏波
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163000)
在集约化养牛生产的条件下,牛呼吸系统疾病是一种典型的多因素性疾病。近年来,因呼吸障碍和系统衰竭死亡的牛犊占牛犊死亡总数居多,给养殖场造成较大的经济损失。引起牛犊呼吸系统衰竭的病原很多,其中传染性病原是导致牛犊高发病率和高死亡率的重要原因,为了防止疾病的进一步蔓延,需要对病原进行快速、准确的诊断。
牛克雷伯氏菌(Klebsiella)既是一种人兽共患病病原,又是一种条件性致病菌,可引起多种动物患病。该菌属于肠杆菌科、克雷伯氏菌属,为革兰氏阴性、兼性厌氧杆菌[1-2],牛肺炎克雷伯氏菌具有传播范围广、速度快、死亡率高的特点,是目前公认的条件致病菌,牛肺炎克雷伯氏菌成暴发式流行,已有多起该细菌流行的养殖户,可使人畜发生肺炎、子宫炎、泌尿道感染、化脓性腹膜炎及腹泻,甚至发生败血症[3-4],属于人兽共患菌属,且深得养殖户日益关注[5]。
溶血性曼氏杆菌(Mannheimia haemolytica)是曼氏杆菌属的一个种,能引起牛、羊的肺炎、羊乳腺炎和新生羔羊急性败血症,具有全球分布性[6]。溶血性曼氏杆菌感染羊主要引起发热、咳嗽、呼吸困难,并引起肺部损伤[7-8],与多杀性巴氏杆菌与许多相似临床症状,例如全身皮下或脏器降魔局限性或点状出血斑的败血症、炎性出血、呼吸困难、鼻镜干裂、心跳呼吸加快、黏膜发绀、腹泻等[9]。据统计,全球约30%的病死牛与其有关,每年给北美国家造成的经济损失超过10亿美元[10]。由于存在呼吸道疾病症状,很容易与其他呼吸道疾病混淆,牛生长的各个阶段都会感染和传播此病,所以给许多养殖户带来了巨大的经济损失。
本试验根据对大庆安达市某牛场送检牛的流行病学调查、病理剖检和实验室诊断,确诊其发病原因是该牛同时感染牛克雷伯氏菌和溶血性曼氏杆菌,牛群很容易因周围生活环境的刺激(如长途运输、过冷、过于拥挤、过热、空气干燥等)而使机体产生应激反应导致免疫抵抗力降低继而诱发感染牛肺炎型克雷伯氏菌。该牛场饲养管理水平低,饲养密度大,饲料不科学;环境消毒不合格,排泄物没有无害化处理;免疫程序混乱,没有经过科学的疫苗免疫程序,这些因素给病原提供大量繁殖并发生变异的机会,造成多种病原存在牛只体内,当环境骤变时,牛体抵抗力下降,从而感染克雷伯氏菌牛溶血性曼氏杆菌于牛多杀性巴氏杆菌临床症状极为相似,很难在解剖诊断过程中鉴别出来,该牛场可能多次诊断失误没有对症下药来治疗溶血性曼氏杆菌,所以必要时要进行实验室诊断来确保万无一失,现将诊断过程汇报如下。
1 材料与方法
1.1 病料的采集 大庆安达市地区某牛场送检的病死犊牛,实验室无菌采集牛的肺脏、肝脏、脾脏、肾脏和肠,保存备用。
1.2 试验材料 DL 2000 DNA Marker购自大连宝生物工程有限公司,TIANamp Genomic DNA Kit DNA提取试剂盒购自TIANGEN公司,PCR Master Mix缓冲液,RNeasy Plus Mini Handbook RNA提取试剂盒购自QIAGEN公司,RevertAid First Strand cDNA Synthesis Kit反转录试剂盒购自MBI公司。
1.3 引物设计 根据GenBank中已发表的克雷伯氏菌(klebsiella)、多杀性巴氏杆菌(Pasteurella multocida)、牛结核分枝杆菌(Mycobacterium tuberculosis)、呼吸道合胞体(Respirator syncytial)、牛副流感(Bovine parainfluenza)、牛流行性腹泻病毒(Bovine epidemic diarrhea virus)、牛传染性鼻气管炎(Infectious bovine rhinotracheitis)、牛溶血性曼氏杆菌(Bovine hemolytic mansonibacillus)和牛支原体病毒(Mycoplasma bovine virus)的基因序列设计特异引物。见表1。
1.4 细菌分离培养 将各种病料通过无菌操作,接种于5%兔血琼脂培养基上,置37℃恒温箱中培养24 h,观察血液琼脂培养基上菌落形态;再挑取菌落进行革兰氏染色,镜检时观察菌体形态和染色特性。
1.5 核酸的提取与PPCCRR鉴定
1.5.1 组织DNA和RNA提取 按照TIANamp Genomic DNA Kit操作进行提取DNA;按照RNeasy Plus Mini Handbook RNA提取盒进行提取RNA,-20℃保存备用。
1.5.2 RNA反转录和PCR扩增 按RevertAid First Strand cDNA Synthesis Kit反转录盒说明书操作步骤将病毒提取的RNA进行反转录,得到的cDNA在-20℃进行保存备用。用得到的DNA和cDNA为模板,牛肺炎型克雷伯氏菌、牛结合分枝杆菌、牛支原体病毒、牛多杀性巴氏杆菌和牛溶血性曼氏杆菌特异性引物进行PCR反应扩增,取10 μL的扩增产物于1%琼脂糖凝胶电泳鉴定。
1.6 药敏试验 将鉴定为克雷伯氏菌和溶血性曼氏杆菌混合感染的纯培养物用接种棒均匀涂布在鲜血培养基上,将药敏纸片(氟苯尼考、头孢呋辛钠、硫酸庆大霉素、硫酸链霉素、盐酸林可霉素、氨苄西林钠等10种药物)分别贴于平皿中,37℃培养24 h,测定抑制菌圈直径大小,根据检测标准判定结果。
2 结果与分析
2.1 剖检变化 剖检可见剖检病死牛肺脏、肝脏肿大,表面有胶冻状坏死灶,心包积液与肺部黏连,胃黏膜有严重溃疡,肠系膜淋巴结轻度肿胀,肾脏、胆囊肿大,心脏与肺部黏连、胸包积液。

表1 引物序列Table 1 Peimer sequence

图1 胃黏膜严重溃疡Fig.1 Severe gastric ulcer
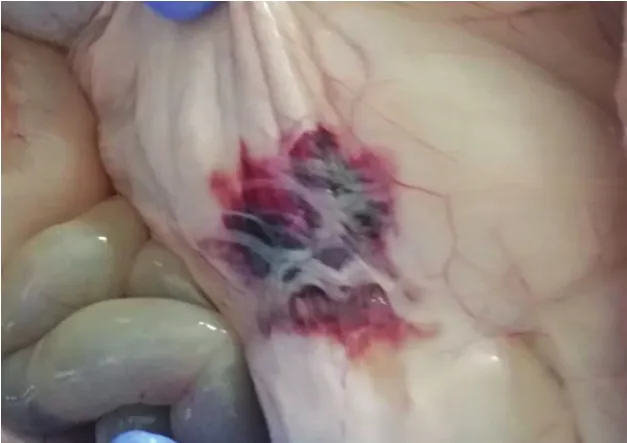
图2 肺脏肿大有坏死灶纤维素样白色渗出物Fig.2 Lung swelling with cellulosic white exudates from the necrotic foci

图3 心脏与肺部黏连,胸包积液Fig.3 Adhesion of the heart to the lungs,pleural effusion
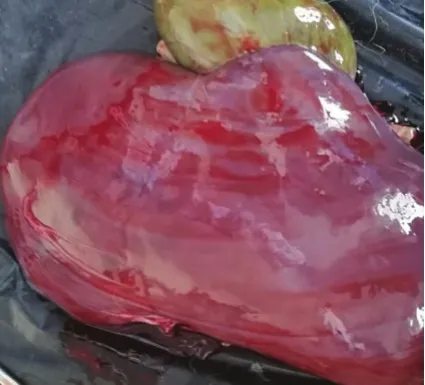
图4 肾脏、胆囊肿大Fig.4 Renal and gallbladder enlargement
2.2 涂片染色特性 将病料肺组织中所分离的细菌进行纯培养,进行革兰氏染色、涂片、镜检。可见到革兰氏染色阴性菌,球状或杆状,呈单个、成对、短链状排列,菌体周边可见荚膜影(见图5)。由于溶血性曼氏杆菌和多杀性巴氏杆菌的形态及染色特征十分相似,所以为了区分这两种细菌,又将无菌采集病死牛的肺脏、肝脏用平板划线法涂抹于5%兔血琼脂培养基上,置37℃恒温箱中培养24 h,观察血液琼脂培养基上菌落为圆形、边缘整齐、表面光滑、扁平隆起、淡白色中等大小菌落(见图6)。观察到较大的灰白色黏液菌落,以接种环挑之,易拉成丝;再次进行革兰氏染色镜检观察发现较短粗的杆菌,大小0.5~0.8 μm至2 μm,单独,成双或短链状排列,无芽孢,无鞭毛的菌体;判定为革兰氏阴性杆菌具有肺炎克雷伯氏菌形态特征(如图7)。
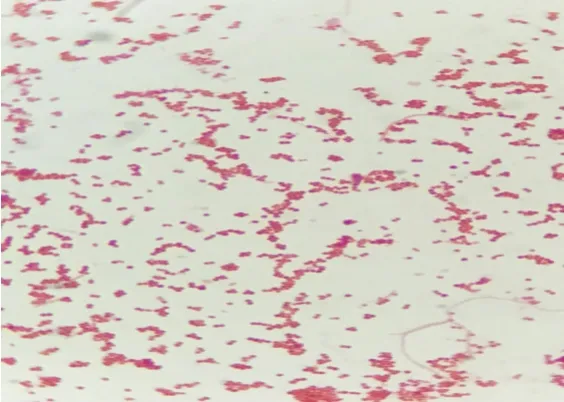
图5 革兰氏阴性球状杆状、单个成对短链状排列(10×10)Fig.5 A gram-negative,bulblike,single pair of short chain arrangement
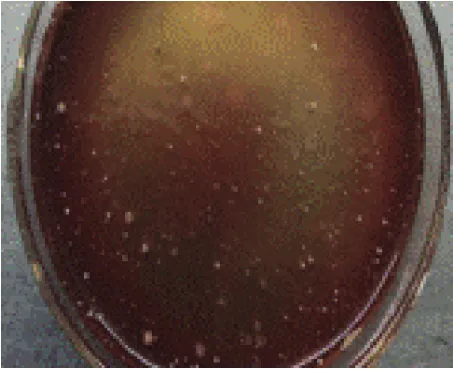
图6 5%兔血琼脂培养基淡白色中等大小菌落Fig.6 5%rabbit blood agar medium light white medium size colony
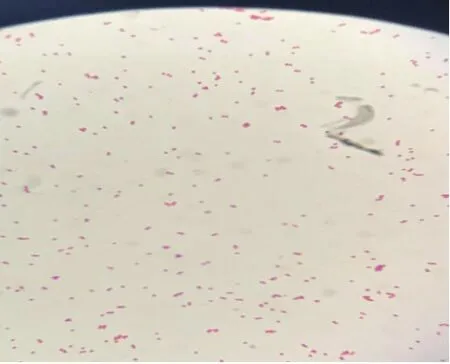
图7 革兰氏阴性杆状、较短粗单独成双或短链状排列、无芽孢(10×10)Fig.7 Gram negative rod-shaped,with separate double short or short chains,ASPOROUS round colony pink,smooth
2.3 PPCCRR检测结果 以组织中提取的病毒DNA以及病毒RNA反转录的cDNA为模板,分别选用克雷伯氏菌、溶血性曼氏杆菌、多杀性巴氏杆菌、牛结合分枝杆菌、牛呼吸道合胞体病毒、牛副流感病毒、牛流行性腹泻病毒、牛传染性鼻气管炎病毒、牛支原体病毒特异性引物进行PCR鉴定。其中第1孔在251 bp左右有一条条带,与牛溶血性曼氏杆菌预期片段大小相符。其中2孔在501 bp左右有一条带,与牛肺炎型克雷曼氏菌预期片段大小相符(如图8)。
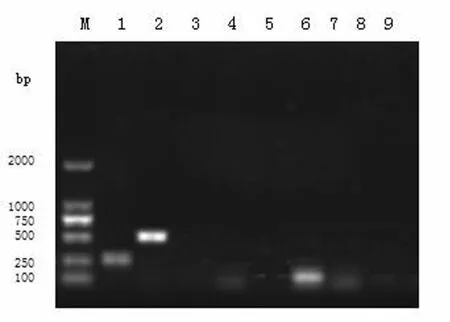
图8 PCR产物琼脂糖凝胶电泳结果Fig.8 PCR electrophoresis analysis chart
2.4 药敏试验结果

表2 药敏结果Table 2 The results of drug susceptibility
3 讨论
3.1 发病原因 对该牛场牛犊的发病原因进行调查:该牛场饲养管理水平低,饲养密度大,饲料不科学;环境消毒不合格,排泄物没有无害化处理;免疫程序混乱,没有经过科学的疫苗免疫程序。这些因素给病原提供大量繁殖并发生变异的机会,造成多种病原存在牛只体内,当环境骤变时,牛体抵抗力下降,病原侵入牛体造成严重损失。
3.2 防治措施 病死牛要进行无害化处理,被污染的圈舍、器具要进行消毒,粪便要进行堆积发酵处理,牛场环境要经常消毒,疫情严重威胁时,消毒1次/d,连续消毒1周,以后夏天2次/周,冬天1次/周;牛舍净化。在多数牛场尚无多点生产体系情况下,保育舍和育肥舍要作到单元式全进全出生产管理,即每个牛舍的用具、人员等要独立,用具不可共用,人员不要来往[10-11]。要加强护理,一旦发现病牛最好隔离,单独饲养,创造一个安静舒适的环境,减少应激,有利于疾病的康复。
4 结论
通过对该病死猪的病理解剖和实验室诊断,确诊送检的病死牛死亡原因是该牛感染了牛肺炎型克雷伯氏菌和牛溶血性曼氏杆菌,牛溶血性曼氏杆菌与牛多杀性巴氏杆菌临床症状极为相似,很难在解剖诊断过程中鉴别出来[12],该牛场可能多次诊断失误,没有对症下药,所以必要时要进行实验室诊断来确保万无一失,由于各牛场在治疗牛病时习惯用的抗生素种类不尽相同,克雷伯氏菌会形成不同的耐药性,各牛场在针对本病进行预防时应选用不同的抗生素[13],不可生搬硬套。
[1] 侯相山,王洪水.猪肺炎克雷伯氏菌感染的诊断与防治[J]. 中国兽医杂志,2007,43(7):74-74.
[2] 郝中香,廖红,刘丹,等.扭角羚肺炎克雷伯氏菌的分离鉴定[J]. 中国畜牧兽医,2015,42(1):203-208.
[3] 高建新,卢兆芸,涂俊凌,等.婴幼儿配方乳粉中检出肺炎克雷伯氏菌肺炎亚种的报告[J].中国人兽共患病学报,2009,25(6):611-612.
[4] 张志祥,吴文汉.56株粘质沙雷菌的分布及其耐药性分析[J]. 中国消毒学杂志,2013,30(12):1134-1137.
[5] 韩猛立,康立超,钟发刚,等.细菌性牛呼吸道疾病的研究进展[J]. 中国畜牧兽医,2013,(5):165-172.
[6] 刘康军,丁志国,李军朝,等.三株羊溶血性曼氏杆菌的分离与鉴定[J].黑龙江畜牧兽医,2016,(5下):120-121.
[7] 徐慧,贺云霞,叶飞,等.溶血性曼氏杆菌的分离与鉴定[J]. 黑龙江畜牧兽医,2009(12上):97.
[8] 李娟,刘阳,彭欠欠,等.羊溶血性曼氏杆菌的分离鉴定[J]. 黑龙江畜牧兽医,2013,(10下):96-97.
[9] 倪宏波,何宏轩,乔军.预防兽医学检验技术[M].长春:吉林人民出版社,2002.
[10] REGGIEYC.Lo Genetic Analys is of Virulence Factors of Mannheimia(Pasteurella)Haemolytica A1[J].Veterinary Micro-biology,2001,83(1):23-35.
[11] BAI L,WU X,JIANG L,et al.Hydroge production by over-expression of hydrogenase subunit inoxygen-tolerant Kleb-siella oxytoca HP1[J].International journal of hydrogen ener-gy,2012,37(17):13227-13223.
[12] 张永久,王萍萍,武广文.溶血性曼氏杆菌毒素的作用及其分子致病机理[J].黑龙江畜牧兽医,2007,(7):38-40.
[13] 吴丹丹,白云龙,李雪纯,等.犊牛群发性肺炎鉴别诊断与药敏实验[J].黑龙江八一农垦大学学报,2016,28(6):92-96.
