不同介质保存的辽宁绒山羊液态精液低温(0℃)状态下品质比较
2018-05-07王晓铭刘兴伟朱延旭
王晓铭,刘兴伟,郭 丹,吴 冰,朱延旭⋆
(1.辽宁省畜牧科学研究院,辽宁 辽阳 111000;2.辽宁省本溪市动物疫病预防控制中心,辽宁 本溪 117000)
辽宁绒山羊液态精液的保存时间对开展绒山羊人工授精具有重要的影响,保存时间延长,既可以延长精子有效存活时间,又可以进行长距离的输精配种,从而提高液态精液的利用效率。通过查阅相关技术资料,绒山羊液态精液正常在0~4℃下保存[1],可以达到延长精子存活时间的目的,而0℃是保存液态精液的温度下限,与0℃以下的低温保存存在哪些差异?另外,0℃又分为0℃的水和0℃的冰水混合物或0℃的冰等物理状态,具体保存液态精液的效果如何?目前还没有相关报导。因此,笔者于2016年秋季进行了在冰水混合状态下辽宁绒山羊液态精液保存方法的试验研究。
1 试验材料
1.1 精液来源 试验用精液为辽宁省辽宁绒山羊科技示范场饲养的一级种用公羊的混合精液,混合后精液的平均活力达70%[2]。
1.2 精液保存温度环境的获取方法
1.2.1 0℃冰水混合物 在冰箱中通过制冷冻成冰水混合物,然后将冰块压成碎块,将超低温温度仪的触头插入碎冰中,测得实际温度,如果冰的温度低于0℃,则搅动冰水混合物,使之达到0℃,冰水混合物达到0℃后,冰与水按4:1混后取150 mL,备用。
1.2.2 0℃的冰 将1.2.1中制成的冰水混合物捞出150 mL,备用。
1.2.3 0℃的水 将1.2.1中制成的冰水混合物的水取出150 mL,备用。
1.2.4 3~5℃的低温水的制取 在将冰箱保鲜层的温度调节到3~5℃,然后以适当的窗口装入一定量的水,在保鲜层内降温,当用温度计测得水的温度降到3~5℃时即3~5℃的低温水的制取成功,取出150 mL,备用。
2 试验方法
2.1 精液采集 公羊精液合格后,即进入试验准备期,共5 d时间,采精3次,测定不同时间阶段精子活力的变化规律,由此确定,试验开始时每3 h测定精子活力,当精液保存至第3天后,每2 h测定活力1次,直至精子活力为0[3]。
2.2 精子活力的评定方法 采用肉眼在150~600倍光学显微镜下观察,并结合“羊精子全自动分析系统”测定,对试验公羊的精子活力进行评定,观测羊精子的环境温度为37℃[4]。
2.3 精液稀释液的配制 用电子天平称取乳糖、葡萄糖、柠檬酸钠、EDTA、Tris等分析纯药剂,加入双次蒸馏水,煮沸降温后再加入卵黄及抗菌素,配制成辽宁绒山羊液态精液稀释液[5]。
2.4 精子顶体完整率的评定方法 精子快速染色液染色,取少量稀释精液抹片,用95%乙醇铺满载玻片固定2~3 min,空气中自然晾干[6],干透后水合1~2 min,倒净液体。滴加试剂一(细胞核染液)铺满载玻片染色30 s~2 min,流水洗净倒净液体。试剂二(细胞质染液)铺满载玻片染色20 s~2 min,不要倒丢,立即滴加若干滴增色夜混合作用5 s左右,再用试剂三(增色液)充分冲洗一遍,滤纸吸干。利用精子分析仪分析。随机选取200个精子,观察顶体,标记顶体不完整的精子。顶体完整率=(200-顶体不完整精子数/200)×100%。
3 结果与分析
3.1 辽宁绒山羊液态精液最佳保存介质的确定试验分为A、B、C、D四组,其中A、B、C为试验组,D为对照组。A组为0℃冰,B组为0℃冰水混合物,C组为0℃水,D组为3~5℃的低温水,为保持温度不明显波动,每12 h更换一次冰、水或冰水混合物,放入精液后,置于4~5℃的恒温冰箱中,精液与稀释液1:1混合,跟踪对照稀释后的精液的低温存活时间、活力50%时回温38℃存活时间、活力≥0%时存活时间及顶体完整率的变化情况如表1所示。

表1 稀释后精液在四种介质中的活力与存活时间对比Table 1 Comparison of the vitality and survival time of diluted semen in four mediums
由表1可知,活力≥50%存活时间和活力≥0%存活时间,以B组最高,A组次之,C最再次之,D组最低,但A、B、C三组间差异不显著(P>0.05);A、B、C三组与D组比较,差异极显著(P<0.01)。活力50%时回温38℃存活时间,以B组最高,C组次之,A组再次之,但A、B、C三组相互间差异不显著(P>0.05);A、B、C三组与D组比较,差异显著(P<0.05)。顶体完整率A、B、C、D各组差异不显著(P>0.05)。由此结果可以初步判定,B组0℃冰水混合物是保存液态辽宁绒山羊精液的最佳介质。
3.2 以 00℃冰水混合物为保存介质液态精液最佳稀释比例的研究 根据前面的研究结论,以0℃冰水混合物为辽宁绒山羊液态精液的保存介质。分别设立A、B、C、D四组,精液与稀释液的比例分别为1:1、1:2、1:3、1:4,并跟踪观察稀释后的精液的低温存活时间、活力50%时回温38℃存活时间、活力≥0%时存活时间及顶体完整率的变化情况,结果如表2所示。
由表2可知,活力≥50%存活时间,以B组最高,D组次之,C组再次之,但B、C、D三组间差异不显著(P>0.05)。活力≥0%存活时间,以B组最高,C组次之,D组再次之,但B、C、D三组间差异不显著(P>0.05)。活力50%时回温38℃存活时间,以B组最高,D组次之,C组再次之,但B、C、D三组间差异不显著(P>0.05);B、C、D三组与A组比较,差异显著(P<0.05)。顶体完整率A、B、C、D各组差异不显著(P>0.05)。
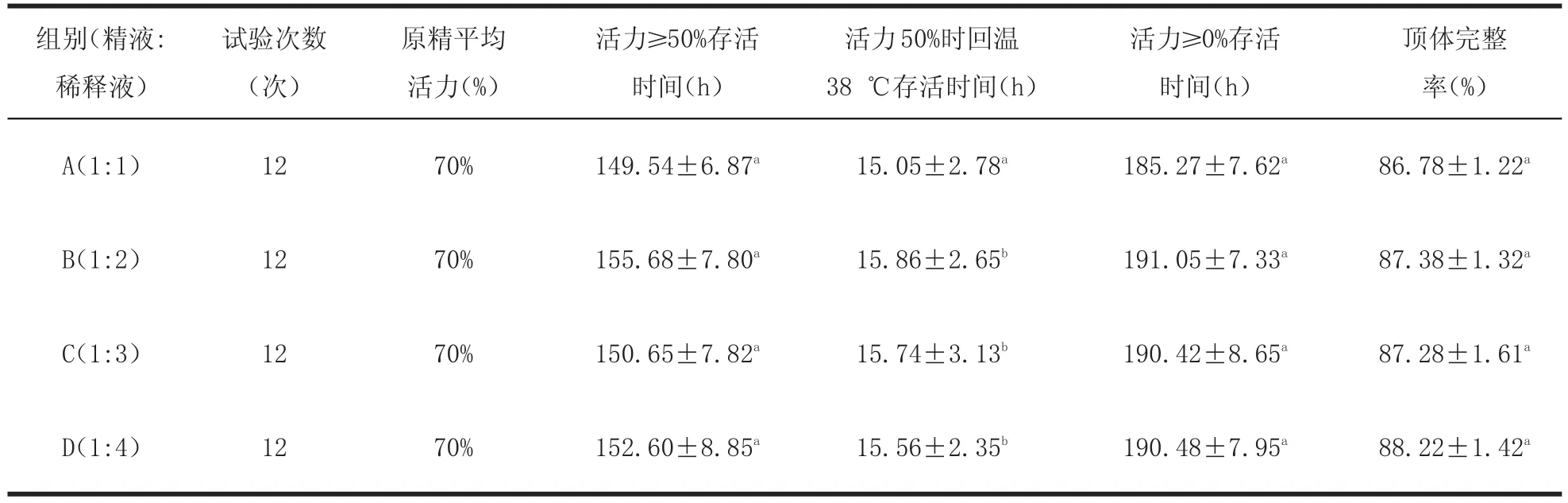
表2 以0℃冰水混合物为保存介质不同稀释比例的对比Table 2 Comparison of different dilution ratios at 0℃ice water mixture as storage medium
4 讨论
4.1 笔者在设计试验时,对精液的稀释比例以1:1、1:2、1:3、1:4作为各不相同的试验条件,主要是考虑到精液的稀释比例不同时,会引起稀释液成份浓度在稀释后的精液中的浓度不同,从而引起精子对温度的降低的适应能力不同,最终引起精子结构的损坏程度可能不同,但是由于试验条件的限制,没有对其他比例的稀释精液进行试验,需以后做其他试验加以完善。
4.2 0℃冰、0℃冰水混合物、0℃水的试验效果均优于3~5℃的低温水,说明0℃以上的环境下,精子仍存在能量消耗,为验证这一结论,笔者观察了3~5℃条件下精子的运动状态。具体方法是将光学显微镜和精液置于3~5℃的低温平衡柜内,待温度稳定后对精子进行观察,发现低温下精子仍有摆动、颤动和小量的前进运动,据此推测,精子运动消耗能量,同时精子代谢仍在进行,如果精子保存时间较长,精子代谢和运动的能量消耗是不可忽视的。
4.3 由于冰水混合物与0℃冰、0℃水比较,具有温度稳定、吸热量多、制取及控温容易等优点,因此,可作为生产实践中精液降温的推广方法。
4
4.4 本试验比较了部分的精液技术指标,而精子的质膜完整性、畸形率、代谢产物的变化、输精受胎率等指标没有进行相关试验进行验证,只是对人工授精技术环节的研究起到了一定的抛砖引玉的作用,有待于今后开展更为系统深入的研究。
[1] 刘兴伟,陈宁.绒山羊液态精液稀释技术[J].黑龙江动物繁殖,2016,24(2):29-31.
[2] 张世伟,杨术环,宋先忱,等.绒山羊饲养管理技术规程(NY/T2893-2016)[S].
[3] 杨术环,宋先忱,王世泉,等.辽宁绒山羊人工授精技术操作规程(DB21/T 24342015)[S].
[4] 张世伟,等.辽宁绒山羊生产实用技术[M].呼和浩特:内蒙古出版社,2003.
[5] 傅文栋,王新平.家畜精液品质评定项目及其方法[J]. 新疆畜牧业,2010,12:53-55.
[6] 张世伟,宋先忱,朱延旭,等.辽宁绒山羊细管冷冻精液研究[J]. 中国畜牧杂志,2006,42(3):23-25.
