狭叶柴胡侧根发育过程及影响因素研究
2018-05-07段莎莎徐冬梅舒晓燕唐志康侯大斌
段莎莎,徐冬梅,余 马,舒晓燕,唐志康,刘 丹,侯大斌
(西南科技大学生命科学与工程学院,四川 绵阳 621000)
侧根为植物地上部位提供营养及水分,在植物根部生长发育过程中发挥着极其重要的作用[1-2]。外源植物激素和营养物质可以调控内源生长素水平[3],从而影响植物根部表型。外源生长素可促进植物根部中柱鞘细胞脱分化为侧根原基[4],增加侧根数目,促进侧根形成。TIBA作为生长素极性运输的输出抑制剂,能抑制PIN蛋白从胞内到质膜的循环和移动[5],通过结合生长素输出复合体来有效阻止IAA的极性运输[6],从而导致IAA在细胞和组织的积累,可以刺激或者抑制根的生长。Ca2+作为第二信使,参与植物生长发育的各个阶段,促进植物根系发育。EDTA作为Ca2+螯合剂,阻止Ca2+在植物体内转运,抑制侧根形成。
柴胡以根入药,主要药用成分为皂苷类化合物[7-10]。在柴胡根部中,韧皮部总皂苷含量高于木质部。因此,侧根数目越多,比表面积越大,总根皂苷含量越高[11]。本研究选用狭叶柴胡审定品种川红柴1号,直根系,双子叶,地下部位表现为主根粗大,须根较少,产量相对偏低。针对这一问题,本实验研究了川红柴1号侧根发育动态过程,并讨论了生长调节物质IAA、TIBA、Ca2+及EDTA对川红柴1号侧根发育的影响,以明确川红柴1号侧根形成机理,为川红柴1号商品性改良提供理论基础。
1 材料和方法
1.1 供试材料
本研究供试材料为狭叶柴胡审定品种“川红柴1号”,该品种系四川德培源中药科技开发有限公司、中国医学科学研究院药用植物研究所、四川农业大学及西南科技大学共同选育,是通过四川省品种审定委员会审定的首个狭叶柴胡新品种。
1.2 研究方法
1.2.1 水培法
选取饱满柴胡种子,置于装有珍珠岩的纸杯中,每个杯子放置5颗种子,于恒温培养箱中发芽。待种子根长至3 cm左右,将幼苗胚轴轻夹于海绵空隙,漂浮在Hoagland营养液中,进行水培,并对根部进行遮光处理。培养条件:昼温(25±2)℃,夜温(22±2)℃,每日光照时间16 h,光照强度约为500 μmol/(m2·s)。
1.2.2 侧根原基发育过程观察
选取10株生长健壮的柴胡幼苗,对主根成熟区进行石蜡切片,经固绿染色后在倒置显微镜下观察与拍摄侧根原基发育动态图。
1.2.3 生长调节物质对侧根发育影响
幼苗在Hoagland营养液中培养10 d后,选取根部长势一致的幼苗进行生长素(IAA)、生长素抑制剂(TIBA)、Ca2+和 Ca2+螯合剂(EDTA)处理,处理浓度见表1,处理时间12 h,每种浓度处理15株。之后转入Hogland培养液中继续培养15 d后测定根系参数。培养过程中每3 d换1次营养液,每组处理均设置3次重复。
1.3 根系参数测定
将收获后的根系样品立即保存于25%的酒精溶液中,通过数字扫描仪(EPSON PERFECTIONV700 PHOTO)将完整的根系图像存入计算机,之后用WinRhizo根系分析系统软件对侧根数目、总根长度、根表面积及根体积进行定量测定。方差分析采用SPSS处理数据,多重比较方法为LSD法和Ducan法,置信区间为95%,使用Origin 8.0作图。
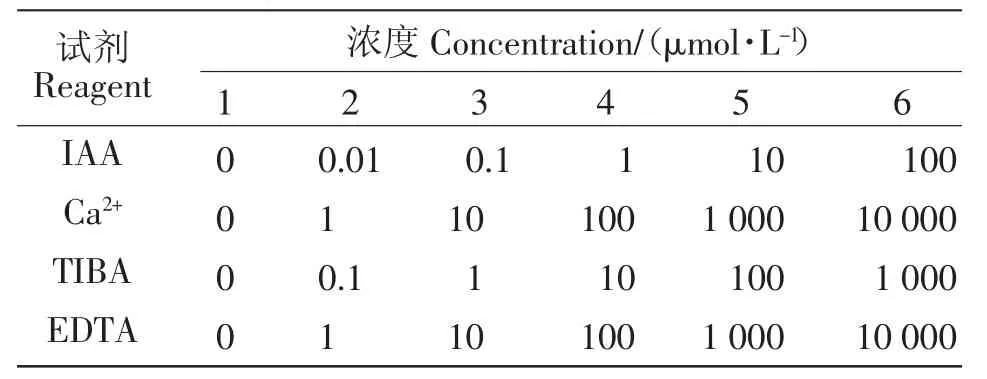
表1 各试剂处理浓度Table 1 Reagent concentrations in different treatments
2 结果与分析
2.1 川红柴1号侧根原基发育过程
2.1.1 侧根原基建成
由图1-A(Ⅰ)可知,中柱鞘细胞发生脱分化,进行细胞分裂,此时细胞分裂旺盛,细胞排列密集,且长度明显变短,细胞质变浓,细胞染色性增强。中柱鞘细胞经垂周分裂形成建成细胞(PFCs);建成细胞又经平周和垂周分裂形成多细胞层侧根原基,细胞排列密集,细胞质变浓,染色加深,原基向外凸起形成拱形(图1-A-Ⅱ-Ⅲ,图1-B-Ⅱ);多细胞层侧根原基经垂周分裂向外侧生长膨大,原基向外凸起形成圆锥形(图1-A-Ⅳ,图1-B-Ⅲ);圆锥形侧根原基逐渐向外发育,不断挤压表皮,表皮层破碎,并出现明显裂痕(图1-A-Ⅴ,图1-B-Ⅳ)。
2.2.2 侧根原基突破表皮
侧根原基由内向外生长,突破表皮层,露出母体,形成真正意义上的侧根。新生侧根基部与母根中柱相连。(图1-A-Ⅵ)。
2.2 川红柴1号侧根发育影响因素
2.2.1 IAA和TIBA对川红柴1号侧根发育的影响
随IAA浓度增加,川红柴1号根系参数值整体表现出先升高后降低的趋势。其中,当IAA浓度为0.01 μmol/L时极显著促进侧根数目和根体积的增大,显著促进总根长和根表面积的增加,浓度超过10 μmol/L时抑制侧根生长。与对照组相比,低浓度TIBA促进根系发育,浓度过高则起抑制作用。其中,0.1 μmol/L TIBA浓度显著促进根系参数增加,浓度超过1 μmol/L时抑制根系发育,浓度达到1 000 μmol/L时完全抑制根系发育,导致植株死亡。

图1 川红柴1号侧根发育过程Figure 1 Lateral root development of“Chuanhongchai No.1”
2.2.2 Ca2+和EDTA对川红柴1号侧根发育的影响
随Ca2+浓度增加,川红柴1号根系参数整体表现为先升高后降低的趋势。其中,Ca2+浓度为1 μmol/L时根系参数值达到最大,极显著促进侧根数目、总根长和根表面积的增加;浓度超过1 μmol/L时对侧根数目、总根长、根表面积及根体积无显著影响。与对照组相比,施加Ca2+螯合剂EDTA,总体表现为抑制柴胡根系发育。其中,10 μmol/L EDTA浓度极显著抑制侧根数目发育,而对总根长、根表面积及根体积无影响;100 μmol/L EDTA浓度极显著抑制侧根数目、根体积增加,显著抑制总根长增加;超过100 μmol/L EDTA浓度极显著抑制侧根发育。
3 讨论
在拟南芥等双子叶植物中,侧根起始于原生木质部中柱鞘细胞[12];在水稻、玉米等单子叶植物中,侧根起始于原生韧皮部中柱鞘细胞[13]。对川红柴1号研究表明,侧根原基起始于靠近原生木质部中柱鞘细胞,此发育模式与双子叶植物侧根发育模式一致,说明侧根起始位置在不同物种中既具有保守性,又具有差异性。

图2 侧根数目、总根长、根表面积及根体积随IAA浓度的变化Figure 2 Dynamic changes of lateral roots number,total root length,root surface area androot volumeof primary roots with the concentration gradient of IAA

图3 侧根数目、总根长、根表面积及根体积随TIBA浓度的变化Figure 3 Dynamic changes of lateral roots number,total root length,root surface area androot volumeof primary roots with the concentration gradient of TIBA
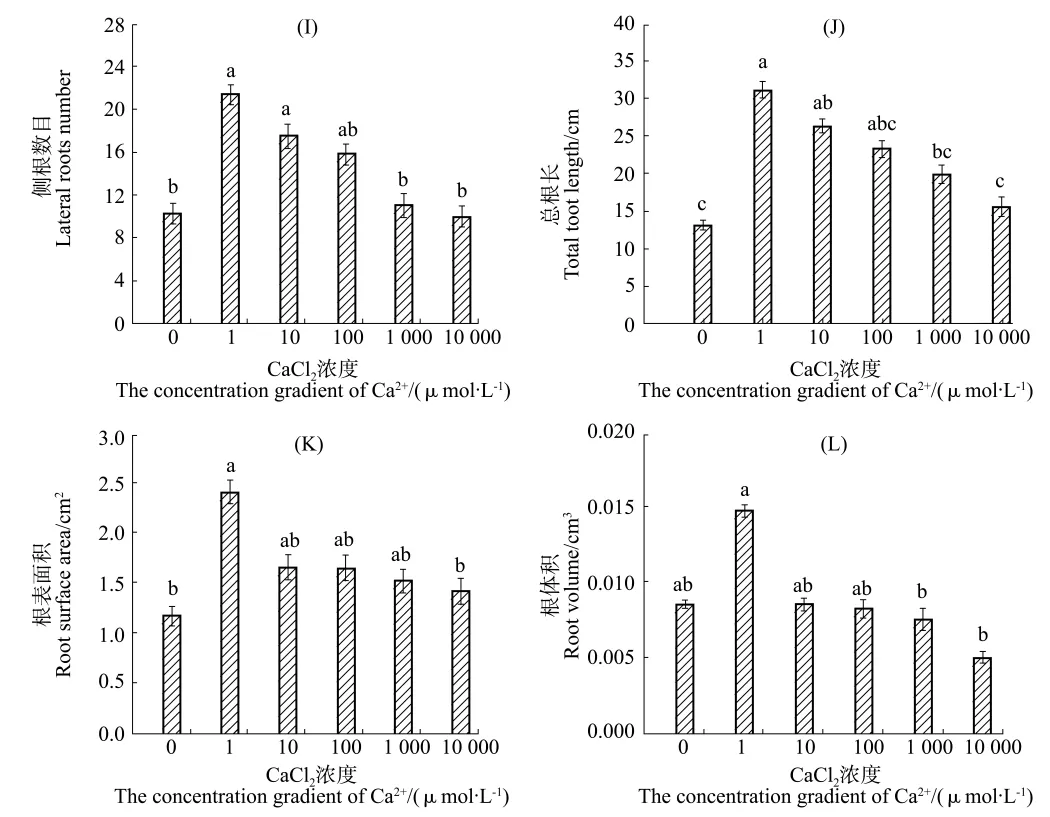
图4 侧根数目、总根长、根表面积及根体积随Ca2+浓度的变化Figure 4 Dynamic changes of lateral roots number,total root length,root surface area androot volumeof primary roots with the concentration gradient of Ca2+
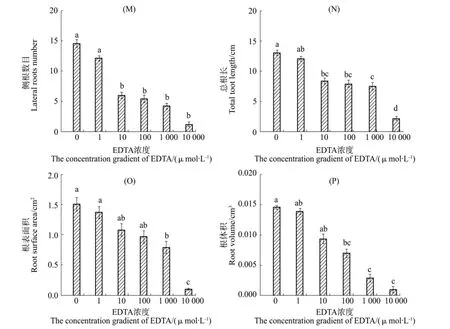
图5 侧根数目、总根长、根表面积及根体积随EDTA浓度的变化Figure 5 Dynamic changes of lateral roots number,total root length,root surface area androot volumeof primary roots with the concentration gradient of EDTA
柴胡以根入药,主要药效成分为柴胡皂苷。TanX.[14]等人研究发现多支根柴胡侧根数目较单支根柴胡多,且皂苷含量高,因此培育多支根柴胡尤为重要。欧阳立明等人[15-16]对黄瓜幼苗施加生长素发现,适宜浓度生长素显著促进黄瓜主根伸长,增大根系比表面积;周索等[17-18]也发现适当浓度生长素可抑制拟南芥主根生长,促进不定根的生长发育。本研究发现0.01 μmol/L IAA可显著促进川红柴1号侧根数目和根表面积增加,增大根系比表面积。Ca2+作为第二信使,几乎参与所有植物细胞对激素及环境刺激的响应过程[19-20]。江玲等[21]对莴苣幼苗施加CaCl2发现,4 mg/L的CaCl2浓度有利于诱导莴苣幼苗侧根原基的发生。本研究发现,1 μmol/L Ca2+浓度可显著促进川红柴1号侧根数目增加。TIBA作为生长素输出抑制剂,可以刺激或者抑制侧根原基的发生。本研究发现,0.1 μmol/L TIBA浓度极显著促进侧根发育,这与H.A.Abdelgadir等[22-23]人研究结果基本一致;浓度高于1 μmol/L TIBA完全抑制川红柴1号侧根发育,在棉花[24]、大豆[25]、香石竹[26]中也起同样抑制作用。可能因为TIBA阻止了生长素的极性运输,导致生长素在细胞和组织的积累,从而刺激或者抑制侧根发育。EDTA作为Ca2+螯合剂,阻止Ca2+在植物体内转运,间接影响植物体内IAA浓度,来影响植物侧根发育[27]。本研究中EDTA对侧根发生主要起抑制作用。
综上所述,0.01 μmol/L IAA,1 μmol/L Ca2+及0.1 μmol/L TIBA浓度均促进柴胡侧根发育,因此适宜培育多支根型柴胡。此外在柴胡实际生产种植中,可因地适宜添加适当浓度的外源生长调节物质,刺激侧根发育,从而培育出多支根型柴胡。此外,本研究方法可还应用到人参、当归等以根入药的药用植物中,对调控中药材商品性具重大意义。
参考文献:
[1]廖涛,杨玉平,程薇,等.苹果中多菌灵、噻菌灵和甲基托布津的高效液相色谱法分析[J].分析测试技术与仪器,2010,16(4):257-261.
[2]李华.高效液相色谱法测定葡萄及其制品中多菌灵残留量[J].福建分析测试,2012,21(3):33-35.
[3]时向东,孙军伟,谢晓波,等.烟草漂浮育苗基质研究进展[J].中国烟草科,2008,29(5):64-68.
[4]BEECKMAN T,BURSSENS S,INZÉD,et al.The peri-cell-cycle in Arabidopsis[J].Journal of Experimental Botany,2001,52(suppl):403-411.
[5]ZAŽÍMALOVÁE,MURPHY A S,YANG H,et al.Auxin Transporters-Why So Many[J].Cold Spring Harbor Perspectives in Biology,2010,2(3):a001552.
[6]VAN DOORN W G,DOLE I,?ELIKEL F G,et al.Opening of Iris flowers is regulated by endogenous auxins[J].Journal of Plant Physiology,2013,170(2):161-164.
[7]CONTRERAS SS,LANZA A M D,PAJARES M B,et al.Bioactive components of Bupleurumrigidum L.subsp.Rigidum[J].Studies in Natural Products Chemistry,2002,27:659-696.
[8]EBATA N,NAKAJIMA K,HAYASHI K,et al.Saponins from the root of Bupleurumfalcatum[J].Phytochemistry,1996,41(3):895-901.
[9]PISTELLI L,BILIA A R,MARSILI A,et al.Triterpenoidsaponins from Bupleurumfruticosum[J].Journal of natural products,1993,56(2):240-244.
[10]DING J,FUJINO H,KASAI R,et al.Chemical evaluation of BupleurumspeciescollectedinYunnan,China[J].Chemicalandpharmaceutical bulletin,1986,34(3):1158-1167.
[11]孟杰,陈兴福,杨文钰,等.柴胡主根与侧根中柴胡皂苷a及皂苷d含量测定[J].药物分析杂志,2013,33(7):1219-1222.
[12]石英,韩毅强,郑殿峰,等.赤霉素对拟南芥主根分生区和伸长区的调控[J].植物生理学报,2015,25(1):21-28.
[13]DE SMET I,VANNESTE,INZÉ D,et al.Lateral root initiation or the birth of a new meristem[J].Plant molecular biology,2006,60(6):871-887.
[14]TAN X,CALDERON-VILLALOBOS L I A,SHARON M,et al.Mechanism of auxin perception by the TIR1 ubiquitin ligase[J].Nature,2007,446(7136):640-645.
[15]欧阳立明,张舜杰,陈剑峰,等.不同植物生长物质对水培黄瓜幼苗生长和根系发育的影响[J].中国农学通报,2010,26(3):161-166.
[16]陈平芳,王连润,高飞,等.高山杜鹃RED JACK试管苗生根研究[J].现代农业科技,2012,24(2):171-177.
[17]周索,庞振凌,庞发虎,等.不同生长素诱导对对拟南芥根生长发育的影响[J].湖南农业科学,2006,34(9):1816-1818.
[18]李小方,何玉科,汤章城.生长素和模拟微重力效应对大白菜不定根形态发生的影响[J].实验生物学报,2000,33(2):179-186.
[19]KIM M C,CHUNG W S,YUN D J,et al.Calcium and calmodulin-mediated regulation of gene expression in plants[J].Molecular Plant,2009,2(1):13-21.
[20]TOYOTAM,FURUICHIT,TATSUMIH,etal.Cytoplasmiccalcium incerases in response to changes in the gravity vector in hypocotyls and petioles of Arabidopsis seedlings[J].Plant Physiology,2008,146(2):505-514.
[21]江玲,管晓春.Ca2+-CaM系统在生长素诱导莴苣侧根原基形成中的作用[J].南京农业大学学报,2003,26(1):6-9.
[22]彭琼.花生开花下针期生长素的极性运输及分布研究[D].长沙:湖南农业大学,2013.
[23]ABDELGADIR H A,JOHNSON S D,VAN STADEN J.Promoting branching of a potential biofuel crop Jatrophacurcas L.by foliar application of plant growth regulators[J].Plant Growth Regulation,2009,58(3):287-295.
[24]DJANAGUIRAMAN M,SHEEBA J A,DEVI D D,et al.Response of cotton to Atonik and TIBA for growth,enzymes and yield[J].Journal of Biological Sciences,2005,5(2):158-162.
[25]TANNER J W,AHMED S.Growth analysis of soybeans treated with TIBA[J].Crop Science,1974,14(3):371-374.
[26]马智宏,李艾君,刘振林,等.PP333、TIBA、Pix对盆栽香石竹矮化效应的研究[J].河北农业技术师范学院学报,1999,13(1):33-36.
[27]刘大同,荆彦平.水稻的侧根发育及其影响因素[J].作物学报,2014,40(8):1403-1411.
