胰腺癌二次立体定向放射治疗的危及器官剂量和不良反应
2018-05-07江林宫朱晓斐曹洋森居小萍汤寅余海燕张火俊
江林宫 朱晓斐 曹洋森 居小萍 汤寅 余海燕 张火俊
Fundprogram:China Health Promotion Foundation(THC2015001)
我国胰腺癌的发病率和致死率呈逐年增加趋势[1],只有15%~20%的患者有机会接受根治性的手术治疗[ 2-3 ],但术后局部复发率仍高达39%~62%[4-7]。放疗或化疗被认为是治疗不能手术或局部晚期胰腺癌的首选治疗方法。立体定向放射治疗(stereotactic body radiation therapy, SBRT)具有治疗精准度高、靶区外剂量跌落快、不良反应较小及实时在线验证和影像引导等独特的优势,被越来越广泛地应用于胰腺癌的放射治疗中。部分已接受过胰腺癌原发灶放疗的患者肿瘤局部复发,但因放疗后手术风险较高、化疗毒性反应较大,而不愿再接受手术或化疗[8-10]。此外,常规放疗在对胰腺癌实施2次放疗时,因无法有效控制危及器官的剂量限值而易导致严重的不良反应。鉴于SBRT的技术优势,它逐渐成为胰腺癌2次放疗的选择[11-12]。但目前缺乏2次SBRT对胰腺癌靶区和危及器官的累积剂量的研究。因此,本研究回顾性分析24例接受了2次SBRT治疗的胰腺癌患者临床资料,以期获得危及器官的累积剂量和体积剂量的物理参数。
资料与方法
一、一般资料
选择2012年1月至2016年12月间长海医院放疗科收治的胰腺癌患者,纳入其中在胰腺肿瘤区同一部位接受2次SBRT治疗、且放疗计划有部分或完全重叠的剂量分布的患者,共24例。其中男性17例,女性7例,年龄45~84岁,中位年龄67岁。首次SBRT前有3例接受了手术,1例接受了化疗。24例患者均因肿瘤局部复发而接受了再次姑息性SBRT以缓解疼痛和黄疸。2次SBRT间隔4~29个月,中位间隔时间11.5个月期,其中14例患者在2次SBRT间隔期间接受了化疗。
二、方法
1.靶区勾画:肿瘤靶区及危及器官的勾画参照本课题组前期的研究[13]。肿瘤靶区(gross tumor volume, GTV)均在CT上勾画。临床靶区(clinical target volume, CTV)的勾画包括潜在的亚临床病灶。大部分情况下SBRT计划中的CTV等同于GTV。CTV外扩2~5 mm形成计划靶区(planning target volume, PTV),且至少90%PTV被等剂量线包绕。其他危及器官的勾画在两次计划中保持一致。

第二次SBRT的处方剂量取决于首次SBRT中危及器官的受照剂量、受照体积和肿瘤的大小。当肿瘤与胃周或十二指肠或小肠的间距<3 mm时,处方剂量将进行相应的减少。此外,考虑到2次SBRT时累积剂量的不确定性,在制定严格的放疗计划时需将紧邻靶区器官的小体积内的超量也考虑在内。将2次计划的CT扫描影像、靶区和正常组织、剂量分布经Multiplan®(4.0.2版)系统传输至MIM®系统(6.6.8版)进行剂量叠加。参考在其他肿瘤治疗中的应用技术[15-17],先通过CT图像平移和旋转方法自动寻找骨性标志,将2次CT扫描图像进行刚性配准,接着对累积剂量行非刚性配准,非刚性配准完成后将首次治疗计划的剂量分布映射到二次治疗计划的剂量分布中。胃、十二指肠、小肠、脊髓、肝脏和肾脏等详细的剂量学参数均从已实施放疗的计划中直接提取,以此来研究各器官的可耐受剂量。最后利用所有接受了2次SBRT患者的累积剂量分布数值生成对应的剂量体积参数。
为了计算靶区重叠体积,第一次计划的剂量分布(包括等剂量线)完全投射到第二次计划中。在MIM系统中将两次计划合成总和计划后生成靶区剂量体积参数,并以此完成靶区重叠体积的重建。重叠体积的定义:以总和计划的累积剂量为处方剂量,归一至95%等剂量线,并被该等剂量线包绕的体积。
3.不良反应和疗效:详细记录所有完成治疗患者的不良反应,按照肿瘤放射治疗协作组的“急性放射反应评分标准”评估急性毒性反应,按照肿瘤放射治疗协作组/欧洲癌症治疗研究组织的“晚期放射反应评分表”评估晚期毒性反应[18]。记录患者治疗反应、疼痛评分及体重变化,评估2次SBRT的疗效。首次SBRT后随访8~33个月,中位随访时间为19个月。
结果
一、危及器官的累积剂量
胃、十二指肠、小肠、脊髓的首次和二次及累积剂量见表1、2。仅1例患者胃的Dmax>80Gy3,但未发生3级及以上的毒性反应,超量部分的胃体积为0.035cc。2例因接受了胰十二指肠切除术,未予计算十二指肠累积剂量。1例患者小肠的Dmax接近修订后的剂量限值。并联器官肝脏和双肾的首次、二次及累积剂量见表3、4,均无超过剂量限值的受照体积。
二、重叠部位的累积剂量
首次、二次照射野内的肿瘤靶区的中位累积剂量分别为49.58、42.79Gy3,中位体积分别为37.75、19.45cc。两次重叠照射野内的肿瘤靶区的中位累积剂量为93.38Gy3(79.85~126.98Gy3),重叠野的中位体积为25.07cc(0.83~79.60cc)。和首次照射野相比, 9例患者的二次照射野缩小。23例患者在设定的处方剂量水平上有显著的重叠。1例患者由于在首次SBRT后解剖结构发生改变,两次受照部位重叠体积较小(图1)。
表1胃、十二指肠、小肠的首次、二次受照剂量和累积剂量及10 Gy 剂量照射的体积[中位数(范围)]

器官计划Dmax(Gy3)D1cc(Gy3)V10(cc)胃 累积43.87(7.56~80.03)35.28(4.88~66)107.40(0~337.80)首次31.0623.6043.22二次18.2014.509.71十二指肠累积35.53(5.96~73.62)26.59(3.60~63.70)23.98(0~176.92)首次24.5817.967.90二次15.4911.581.68小肠累积45.08(29.70~92.47)36.18(20.99~74.75)169.29(49.85~1132.32)首次30.3123.9467.37二次21.4616.3223.88
表2脊髓的首次、二次受照剂量及累积剂量[中位数(范围)]

计划Dmax(Gy3)D0.35(Gy3)累积8.42(4.44~16.43)7.83(3.99~14.93)首次5.405.03二次3.282.93
表3肾脏的首次、二次受照剂量及累积剂量[中位数(范围)]
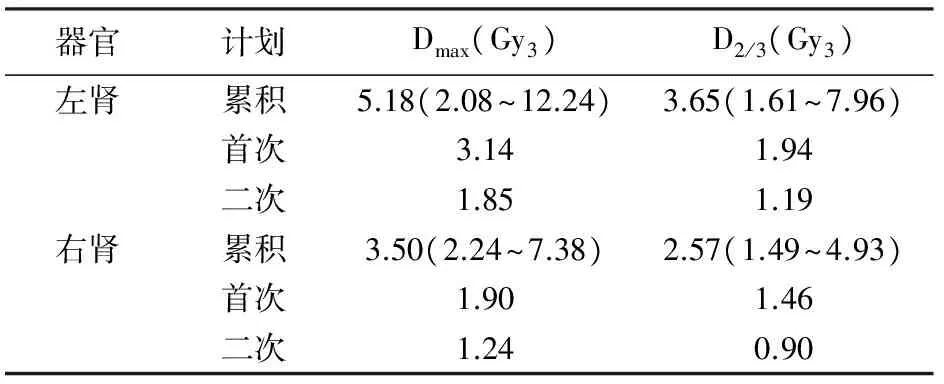
器官计划Dmax(Gy3)D2/3(Gy3)左肾累积5.18(2.08~12.24)3.65(1.61~7.96)首次3.141.94二次1.851.19右肾累积3.50(2.24~7.38)2.57(1.49~4.93)首次1.901.46二次1.240.90
表4肝脏的首次、二次受照剂量及累积剂量[中位数(范围)]

计划Dmean(Gy3)D1/2(Gy3)累积5.18(1.96~10.70)3.64(1.58~10.46)首次3.032.16二次1.660.12
三、不良反应
在两次放疗中及随访期内,未发生急性或晚期的3~5级不良反应。1例在放疗完成后的1个月出现了Ⅱ度骨髓抑制。2例因化疗(非放疗)发生2级胃肠道毒性反应。1例因胃肠出血、穿孔死亡,影像随访提示其在2次放疗后1年肿瘤进展,进而侵犯胃肠道所致。
四、生存和预后
2例在2次SBRT后肿瘤有所缩小,8例病灶稳定;4例疼痛明显缓解,5例仍述腹部或后背疼痛;3名患者体重有所增加。治疗后患者生存8~33个月,中位生存时间为17个月。14例死于肿瘤进展或相关并发症。

图1 同1例患者首次放疗(绝对)剂量(1A)、二次放疗(绝对)剂量(1B)及累积剂量(1C)分布图
讨 论
胰腺癌现阶段的主流治疗模式为多模式综合治疗[6-7]。虽然患者可能要面临远处转移的风险,但局部复发更为常见。在接受了根治性的放疗或手术后,出现复发或病灶残留的患者,几乎无其他可选的有效治疗手段。
由于再次手术的风险高、疗效欠佳,而化疗耐受性差、不良反应发生率高,故两者均会影响患者的治疗依从性和生存率,因此二次放疗被认为是胰腺癌孤立性局部复发患者较好的治疗手段。当然,如果受照剂量超量,特别是两次放疗中均离照射野较近的正常组织器官亦会出现显著的损伤。SBRT已成功地用于多种肿瘤的二次放疗,源于其可使PTV以外区域的受照剂量快速跌落,而使邻近器官免受高剂量射线的照射。在不考虑首次放疗应用了何种技术的前提下仅有3篇报道是关于胰腺癌二次放疗可行性的研究。Lominska等[12]报道了28例在前期接受过中位剂量为50.4Gy(41.40~70.20Gy)的外照射后再次行SBRT的研究,其中11例患者在完成了首次外照射后的2个月内接受了SBRT低分割大剂量的照射,其余17例则在肿瘤局部复发或进展时接受了挽救性的SBRT。SBRT的中位总剂量为22.5Gy(20~30Gy),中位单次剂量为7Gy(4~8Gy)。中位总生存期、1年总生存率和局部无进展生存率分别为5.9个月、18%和70%。3级胃肠道不良反应发生率仅7.1%。Dagoglu等[11]报道30例患者在第二次放疗时选择了SBRT,其中9例在首次放疗时也接受了SBRT。首次放疗和二次SBRT的时间间隔为4~31个月,中位间隔时间为18个月。5次分割的SBRT中位总剂量为25Gy(24~36Gy)。患者中位生存期为14个月,1、2年局部控制率均为78%。仅16.7%(5/30)患者出现了3级胃肠道不良反应。Wild等[19]报道18例胰腺癌患者在第二次放疗时选择了SBRT,其中15例接受了手术和辅助或新辅助放化疗,3例接受了常规放化疗。首次常规放疗的中位剂量为50.4Gy/28次,化疗方案为吉西他滨单药维持。对于出现局部复发或进展的患者给予5次分割、中位剂量为25Gy的SBRT。接受SBRT的患者中位生存期达8.8个月,且6、12个月的无局部进展率分别达78%、62%。57%的患者在SBRT后腹部或后背的疼痛明显缓解,且未发生3级以上的急性毒性反应。
本研究结果显示,胃、十二指肠和小肠的中位累积Dmax、D1cc和V10值,脊髓的中位累积Dmax和D0.35,肾脏的中位累积Dmean和D2/3以及肝脏的中位累积Dmean和D50%在可耐受的不良反应下是安全、准确的;行2次SBRT患者的总生存期不少于、甚至多于上述研究报道,而急性和晚期胃肠道毒性发生率要低于上述3篇报道。这是因为以往的研究尽管第二次放疗均为SBRT,但大多数患者首次放疗为常规放射治疗,可能令邻近正常器官受到了较大剂量的照射。本研究有关危及器官的累积剂量值,可作为今后前期已接受过胰腺癌SBRT后再行局部复发灶SBRT的参考危及器官的限量。考虑到在两次放疗间期可能出现的器官形变和解剖结构的改变,以及回顾性分析的局限性,本研究结果的应用也需谨慎。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016, 66(2):115-132. DOI:10.3322/caac.21338.
[2] Sener SF, Fremgen A, Menck HR, et al. Pancreatic cancer: a report of treatment and survival trends for 100313 patients diagnosed from 1985-1995 using the national cancer database[J]. J Am Coll Surg,1999, 189(1): 1-7. DOI:10.1016/S1072-7515 (99)00075-7.
[3] Myrehaug S, Sahgal A, Russo SM, et al. Stereotactic body radiotherapy for pancreatic cancer: recent progress and future directions[J]. Expert Rev Anticancer Ther, 2016, 16(5): 523-530. DOI: 10.1586/14737140.2016.1168698.
[4] Gastrointestinal Tumor Study Group. Further evidence of effective adjuvant combined radiation and chemotherapy following curative resection of pancreatic cancer[J]. Cancer, 1987, 59(12): 2006-2010. DOI: 10.1002/1097-0142(19870615).
[5] Neoptolemos JP, Stocken DD, Friess H, et al. A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer[J]. N Engl J Med, 2004, 350(12): 1200-1210. DOI: 10.1056/NEJMoa032295.
[6] Regine WF, Winter KA, Abrams RA, et al. Fluorouracil vs gemcitabine chemotherapy before and after fluorouracil-based chemoradiation following resection of pancreatic adenocarcinoma: a randomized controlled trial[J]. JAMA, 2008, 299(9): 1019-1026. DOI: 10.1001/jama.299.9.1019.
[7] Oettle H, Post S, Neuhaus P, et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial[J]. JAMA, 2007, 297(3): 267-277. DOI:10.1001/jama.297. 3.2 67.
[8] Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer[J]. N Engl J Med, 2011, 364(19): 1817-1825.DOI:10.1056/ NEJ Mo a1011923.
[9] Burris HA, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial[J]. J Clin Oncol, 1997, 15(6): 2403-2413. DOI:10.1200/JCO. 1997.1 5.6.2403.
[10] Lee MG, Lee SH, Lee SJ, et al. 5-fluorouracil/leucovorin combined with irinotecan and oxaliplatin (FOLFIRINOX) as second-line chemotherapy in patients with advanced pancreatic cancer who have progressed on gemcitabine-based therapy[J]. Chemotherapy, 2013, 59(4): 273-279. DOI: 10.1159/000356158.
[11] Dagoglu N, Callery M, Moser J, et al. Stereotactic body radiotherapy (SBRT) reirradiation for recurrent pancreas cancer[J]. J Cancer, 2016, 7(3): 283-288. DOI:10.71 50/ jca. 13295.
[12] Lominska CE, Unger K, Nasr NM, et al. Stereotactic body radiation therapy for reirradiation of localized adenocarcinoma of the pancreas[J]. Radiat Oncol, 2012, 7(1): 74. DOI:10.1186/1748-717X-7-74.
[13] Zhu X, Ju X, Cao F, et al. Safety and efficacy of stereotactic body radiation therapy combined with S-1 simultaneously followed by sequential S-1 as an initial treatment for locally advanced pancreatic cancer (SILAPANC) trial: study design and rationale of a phase II clinical trial[J]. BMJ Open, 2016, 6(12):e013220. DOI:10.113 6/bm jope n-2016-013220.
[14] Abusaris H, Storchi PR, Brandwijk RP, et al. Second re-irradiation: efficacy, dose and toxicity in patients who received three courses of radiotherapy with overlapping fields[J]. Radiother Oncol, 2011, 99(2): 235-239. DOI: 10.1016/j.radonc.2011.03.010.
[15] Bondar L, Hoogeman MS, Vasquez Osorio EM, et al. A symmetric nonrigid registration method to handle large organ deformations in cervical cancer patients[J]. Med Phys, 2010, 37(7): 3760-3772. DOI: 10.1118/1.3443436.
[16] Vasquez Osorio EM, Hoogeman MS, Bondar L, et al. A novel flexible framework with automatic feature correspondence optimization for nonrigid registration in radiotherapy[J]. Med Phys, 2009, 36(7): 2848-2859. DOI: 10.1118/1.3134242.
[17] Vasquez Osorio EM, Hoogeman MS, Teguh DN, et al. Three-dimensional dose addition of external beam radiotherapy and brachytherapy for oropharyngeal patients using nonrigid registration[J]. Int J Radiat Oncol Biol Phys, 2011, 80(4): 1268-1277. DOI: 10.1016/j.ijrobp.2010.10.006.
[18] Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. DOI:10.1016/0360- 3016(95)00060-C.
[19] Wild AT, Hiniker SM, Chang DT, et al. Re-irradiation with stereotactic body radiation therapy as a novel treatment option for isolated local recurrence of pancreatic cancer after multimodality therapy: experience from two institutions[J]. J Gastrointest Oncol, 2013, 4(4): 343-351. DOI: 10.3978/j.issn.2078-6891.2013.044.
