苯甲酸和磷酸共修饰TiO2降解罗丹明B的研究
2018-05-05郑凤英1余惠武李跃海李顺兴
林 帆, 郑凤英1,, 余惠武, 李跃海, 李顺兴*1,
(1.福建省现代分离分析科学与技术重点实验室,福建漳州 363000;2.闽南师范大学化学与环境学院,福建漳州 363000)
绿色高效的光(电)催化氧化技术是复杂样品前处理方法与技术研究的前沿领域。目前,纳米TiO2光催化已应用于化学需氧量(COD)[1 - 2]、总有机碳(TOC)[3]和总氮[4]、总磷[5]测定的样品前处理过程,在改善分析性能和环境友好两方面优势明显,但亦存在一些缺点,如:受制于禁带宽度(3.2 eV),只对紫外光响应;长时间光照,能耗高,不仅损伤仪器,还需进行紫外线防护;光激发产生的电子与空穴的复合率高,致使光量子产率不高[6];对持久性有机污染物降解不完全[7 - 9],影响测定的准确度;表面带有大量亲水性羟基,有机物在表层覆盖率极低,影响光降解性能[10];催化剂与水界面溶解O2交换速率低,表面羟基数量减少,催化活性下降。因此,直接使用TiO2处理复杂样品效果不理想,多借助改性提高其光催化能力。主要有:与半导体材料复合[11]、表面沉积贵金属[12]、离子掺杂[13 - 14]、表面修饰[15]。其中,表面修饰法具有操作简便、成本低、材料利用率高等优点。TiO2表面可用卟啉铁[16]、抗坏血酸[17]、精氨酸[18]、叶酸[19]、异氰酸[20]等修饰,但均属于物理吸附,导致修饰量少,且自身易被氧化降解。
本文利用苯甲酸与磷酸作为表面修饰剂,在常温常压下,对直径100 nm TiO2锐钛矿进行改性,苯甲酸和磷酸表面共修饰可显著提升TiO2纳米粒子的光催化降解能力,可较好降解芳香族污染物(罗丹明B,20 mg/L,模拟物),达到样品前处理要求。
1 实验部分
1.1 仪器和试剂
Spectrum One傅里叶变换红外光谱仪(美国,PE公司);U-3900紫外-可见分光光度计(日本,日立公司);UV-5800PC紫外-可见分光光度计(上海元析仪器有限公司);ROTINA 420R高速冷冻离心机(德国,Hettich);PL-X3000氙灯光源(北京普林赛斯科技有限公司);多头磁力恒温搅拌器(常州国华电器有限公司);电热鼓风干燥箱(上海一恒科学仪器有限公司)。
纳米TiO2(锐钛型,100 nm;阿拉丁试剂有限公司);苯甲酸(BA)(分析纯,西陇化工股份有限公司);磷酸(PA)(分析纯,西陇化工股份有限公司)。实验用水均为超纯水(18.2 MΩ·cm)。
1.2 TiO2-苯甲酸、TiO2-磷酸和TiO2-苯甲酸/磷酸的制备
1.2.1TiO2-苯甲酸、TiO2-磷酸的制备在5个烧杯中分别加入100 mL水和0.2 g TiO2,再分别加入不同质量的苯甲酸(10、30、50、70、90 mg),或者不同体积的磷酸(10、30、50、70、90 μL),覆上保鲜膜,磁力搅拌8 h后,离心,用水洗涤3次,洗去未键合的苯甲酸或磷酸,再于温度60 ℃条件下,真空干燥12 h,根据TiO2表面修饰苯甲酸或磷酸量的不同,分别标记为B10、B30、B50、B70、B90,或者P10、P30、P50、P70、P90。
1.2.2TiO2-苯甲酸/磷酸的制备在5个烧杯中分别加入100 mL水,0.2 g TiO2和10 mg苯甲酸,再分别加入10、30、50、70、90 μL磷酸,覆上保鲜膜,磁力搅拌8 h,离心,用水洗涤3次,洗去未键合的磷酸和苯甲酸,于60 ℃条件下,真空干燥12 h,产品分别用B10P10、B10P30、B10P50、B10P70、B10P90标记。参照上述方法,制备其他的TiO2-苯甲酸/磷酸,并按TiO2表面修饰磷酸和苯甲酸量的不同,加以标记。
1.3 红外光谱表征
取100~200 mg干燥完全的KBr,分别称取1~2 mg TiO2、TiO2-苯甲酸、TiO2-磷酸、TiO2-苯甲酸/磷酸,混匀,压片,用红外光谱仪进行测定。
1.4 紫外-可见吸收光谱测定
取TiO2、TiO2-苯甲酸、TiO2-磷酸、TiO2-苯甲酸/磷酸样品,置于积分球中,用U-3900型紫外-可见分光光度计进行测定。
1.5 光催化降解罗丹明B
室温(25 ℃)下,吸取20 mg/L罗丹明B溶液100 mL于烧杯中,加入TiO2(或TiO2-苯甲酸、TiO2-磷酸、TiO2-苯甲酸/磷酸)50 mg(即浓度0.5 g/L),覆上保鲜膜,避光吸附20 min,测定吸附量;然后在氙灯照射下进行光催化降解,间隔20 min取样。用UV-5800PC紫外-可见分光光度计,在波长552 nm处测定罗丹明B的吸光度,计算降解率。
2 结果与讨论
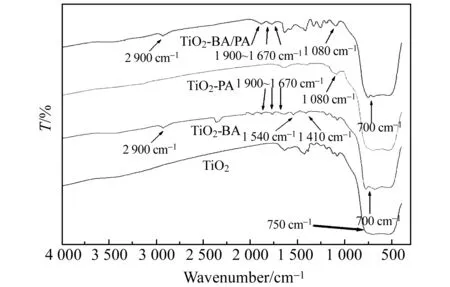
图1 TiO2修饰前后的红外(IR)光谱图Fig.1 IR spectra of unmodified and modified TiO2
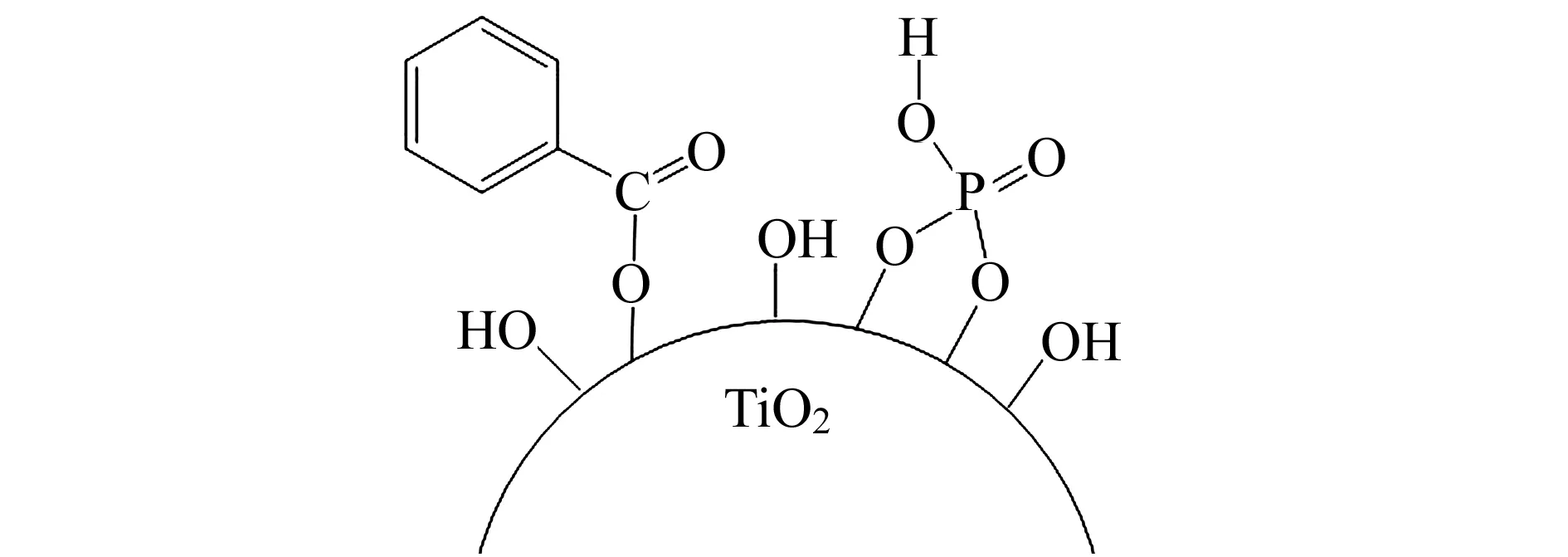
图2 苯甲酸与磷酸共修饰TiO2机制示意图Fig.2 Surface modification mechanism of TiO2 with benzoic acid and phosphoric acid
2.1 TiO2表面修饰机制
TiO2及其用苯甲酸、磷酸、苯甲酸与磷酸表面修饰产物红外光谱如图1所示。TiO2在750 cm-1处强烈吸收峰为TiO2晶体中Ti-O-Ti的伸缩振动吸收峰[21]。TiO2修饰苯甲酸后,在1 900~1 670 cm-1处出现 C-H 的外弯曲振动的泛频峰,表明存在苯的衍生物;在900~600 cm-1处出现有别于Ti-O-Ti的伸缩振动吸收峰,表明苯的衍生物为苯的一元取代物;在 2 900 cm-1附近的吸收峰说明羧基的存在[22];在1 540、1 410 cm-1附近的吸收峰为羧酸酯特征峰,说明苯甲酸与TiO2表面羟基发生类似醇和酸生成酯的反应[23]。上述结果表明,苯甲酸通过化学吸附成功修饰到TiO2表面。TiO2修饰磷酸后,在1 080 cm-1附近出现宽吸收峰,该峰为磷酸基团特征吸收峰[24],即磷酸已修饰至TiO2表面。苯甲酸与磷酸共修饰TiO2表面基团吸收峰与两者单独修饰产物的特征峰位置基本保持不变,说明苯甲酸、磷酸单独或共存均是与TiO2表面羟基键合,两者互不影响。修饰机制如图2所示。
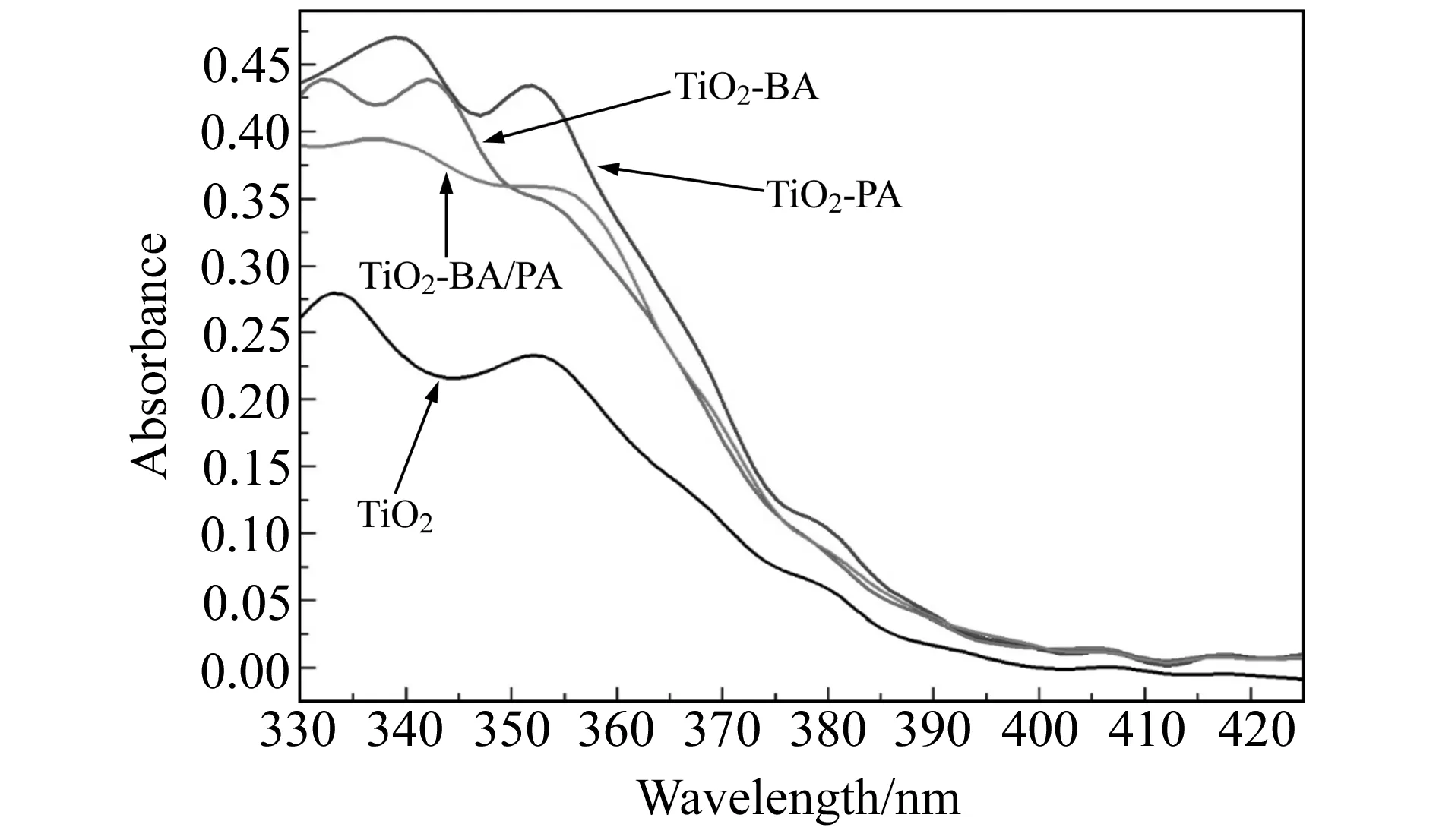
图3 TiO2修饰前后紫外-可见(UV-Vis)吸收光谱图Fig.3 UV-Vis absorption spectra of unmodified and modified TiO2
2.2 TiO2表面修饰后对紫外-可见吸收光谱的影响
由图3可知,TiO2分别经苯甲酸、磷酸、苯甲酸与磷酸修饰后,对可见光的吸收稍有增加,而对紫外光的吸收则增加明显,这有利于TiO2光催化氧化能力的提高。
2.2.1表面修饰苯甲酸对TiO2性能的影响TiO2表面修饰一定量的苯甲酸后,对罗丹明B亲合力增强,吸附能力得到提高,有机污染物在光催化剂表面覆盖率提高,TiO2降解污染物速率控制步骤[25]得到改善。苯环具有π-π共轭体系,有利于TiO2光生电子传导到苯环上,增加了空穴存在时间,而光生空穴具有很强的氧化性,使吸附到TiO2表面的有机污染物直接氧化分解,或与吸附到TiO2的H2O反应,产生强氧化性的羟基自由基(·OH),直接分解有机污染物,因此经氙灯照射2 h,TiO2表面修饰苯甲酸对罗丹明B的降解速率较TiO2有明显提高。实验表明在一定的修饰剂量内,降解率随苯甲酸修饰量的增加而增加,当苯甲酸的修饰量为70 mg(700 mg/L)时催化能力最佳,对罗丹明B降解率为71.5%,较TiO2提高了30.2%。因为苯甲酸表面修饰会减少TiO2光催化的活性基团(表面羟基),当苯甲酸修饰量大于70 mg时,降解率反而下降,结果见图4。
2.2.2表面修饰磷酸对TiO2性能的影响表面修饰磷酸前后,TiO2吸附及光催化罗丹明B性能情况如图5所示。表面修饰后,TiO2对罗丹明B吸附能力增强,因为TiO2表面磷酸基团带负电,对带正电的阳离子染料罗丹明B产生电性吸引。
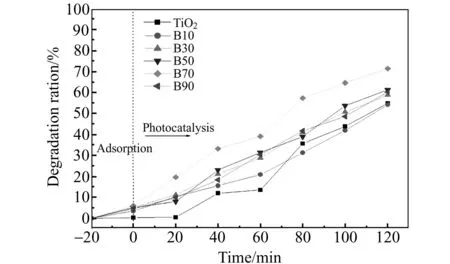
图4 苯甲酸表面修饰量对 TiO2吸附率及降解速率的影响Fig.4 Effect of surface modification dose of benzoic acid on the adsorption and degradation ratio of TiO2
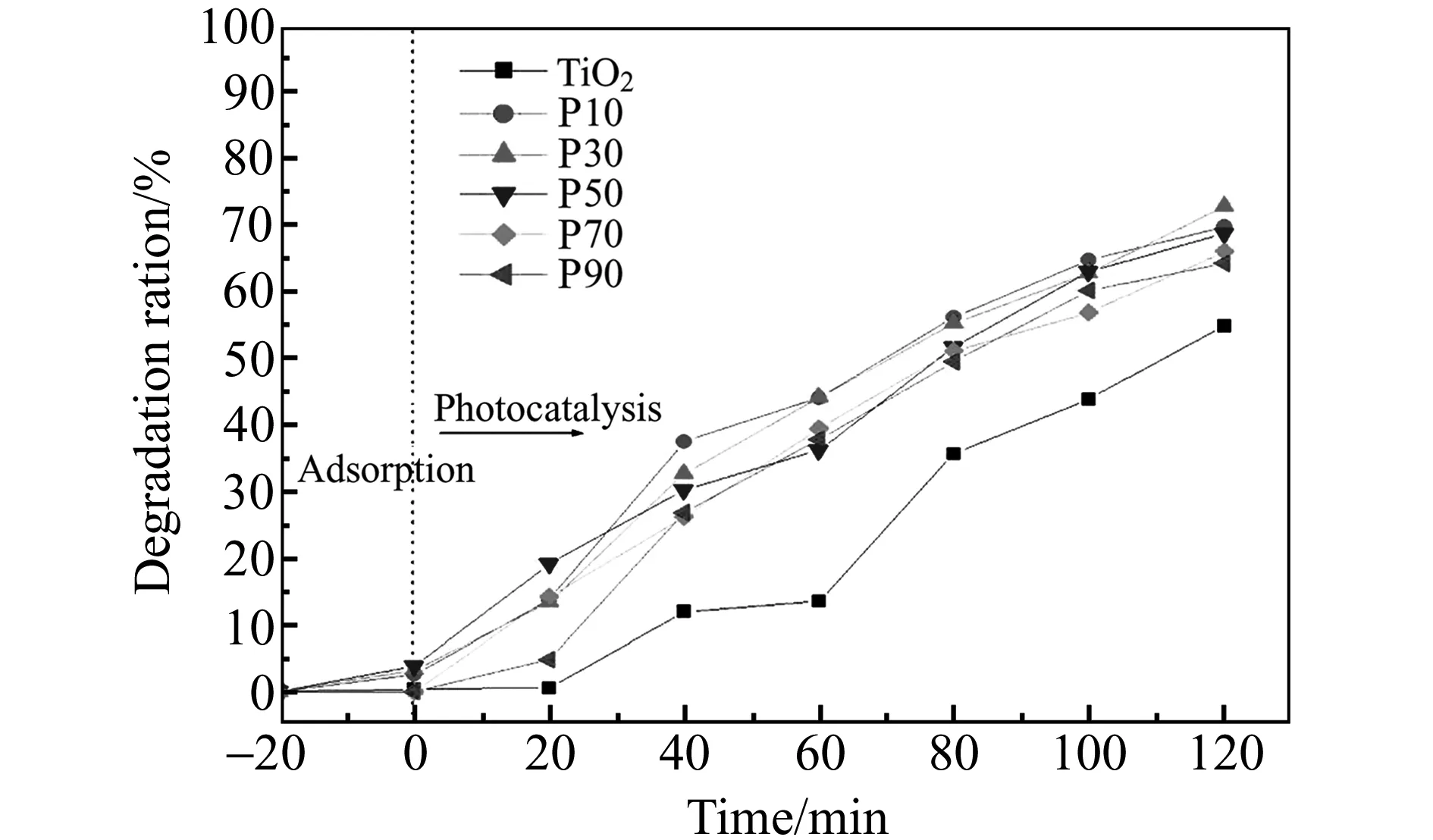
图5 磷酸表面修饰量对TiO2吸附率及降解速率的影响Fig.5 Effect of surface modification dose of phosphoric acid on the adsorption and degradation ratio of TiO2
Cao等[26]通过热吸附-脱附法证实TiO2表面磷酸基团对O2具有更强的吸附能力,O2与TiO2表面的光生电子结合是光催化过程中的控速步骤[27],催化剂-水界面O2浓度会影响电子与空穴的复合,延长空穴存在时间,空穴能直接氧化有机污染物,或间接产生强氧化性的·OH氧化分解有机污染物。但磷酸表面修饰会减少TiO2表面羟基,从而减少光催化活性基团数量,因此当磷酸修饰量由10 μL增至30 μL时,降解率随之提高,但当修饰量大于30 μL降解率反而下降。采用最佳修饰量30 μL(300 μL/L),TiO2对罗丹明B降解率为72.8%,较未改性TiO2降解率提高了32.6%。
2.2.3苯甲酸和磷酸表面共修饰对TiO2性能的影响由图4、图5和图6对比可知,在各自最佳表面修饰量条件下,光催化降解2 h,TiO2、苯甲酸修饰TiO2、磷酸修饰TiO2、苯甲酸和磷酸共修饰TiO2对罗丹明B的降解率分别为54.9%、71.5%、72.8%和91.2%,即TiO2经苯甲酸和磷酸表面共修饰后,比未修饰或单独修饰的TiO2的降解能力均有显著提高。
苯甲酸和磷酸表面共修饰后TiO2纳米粒子表面极性减弱,在极性溶剂和非极性溶剂中均有较好分散性,表面苯环和表面负电性均提高了对带正电的阳离子染料罗丹明B亲和力,提高了罗丹明B向非均相光催化剂的扩散速度(光催化降解速率控制性步骤[25]),苯环共轭体系有利于催化过程中电子转移,延长电子-空穴存留时间。同时TiO2表面磷酸基团能提高光催化剂从水体吸附降解所需O2[26],而水界面O2扩散速率也是光催化降解速率控制步骤[27]。因此,共修饰能同时克服异相光催化降解上述两个瓶颈问题,使光催化性能得到提高,达到复杂样品前处理的要求。但苯甲酸和磷酸表面共修饰均键合TiO2表面的羟基,消耗光催化活性基团,因此同样存在最佳的表面修饰量,即苯甲酸和磷酸共修饰最佳用量分别为10 mg和30 μL。磷酸用量与单独修饰时一致,而苯甲酸最佳修饰剂量较单独修饰时剂量有所下降,这说明有机物与O2的扩散速度虽均是异相光催化速率决定步骤,但O2扩散速度影响更显著。
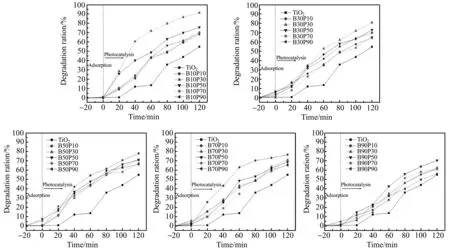
图6 苯甲酸-磷酸表面共修饰对TiO2吸附率及降解速率的影响Fig.6 Effect of surface modification dose of phosphoric acid and benzoic acid on the adsorption and degradation ratio of TiO2
3 结论
通过简单化学吸附法,将苯甲酸和磷酸同时修饰到TiO2表面,适当控制修饰量用量,催化剂表面兼具羟基、苯基、磷酸等活性基团,改造纳米TiO2表面结构与功能,达到亲水性、亲氧性、疏水性、负电性,实现对阳离子有机污染物充分光催化降解,满足COD和TOC测定所需的样品前处理要求。
参考文献:
[1] LI S X,ZHENG F Y,CAI S J,et al.Sensors and Actuators B:Chemical,2013,188:280.
[2] ZHENG Q,ZHOU B,BAI J,et al.Advanced Materials,2008,20(5):1044.
[3] MATTHWEU R W,ABDULLAH M,Low G K C.Analytica Chimica Acta,1990,233:171.
[5] PANTHER J G,TEASDALE P R,BENNETT W W,et al.Environmental Science & Technology,2010,44(24):9419.
[6] CHEN X,MAO S S.Chemical Reviews,2007,107(7):2891.
[7] LI S X,ZHENG F Y,CAI W L,et al.Journal of Hazardous Materials,2006,135(1):431.
[8] LI S X,ZHENG F Y,LIU X,et al.Chemosphere,2005,61(4):589.
[9] LI S X,CAI S J,ZHENG F Y.Dyes and Pigments,2012,95(2):188.
[10] CHEN D,RAY A K.Applied Catalysis B:Environmental,1999,23(2):143.
[11] CAI J B,WU X Q,LI S X,et al.ACS Applied Materials & Interfaces,2015,7(6):3764.
[12] LI S X,CAI J B,WU X Q,et al.Applied Catalysis B:Environmental,2014,160:279.
[13] SHI J W,CHEN S H,WANG S M,et al.Chemical Industry and Engineering Progress(石建稳,陈少华,王淑梅,等.化工进展),2009,2:251.
[14] CONG Y,XIAO L,CHEN F,et al.Photographic Science and Photochemistry(丛野,肖玲,陈锋,等.感光科学与光化学),2007,2:147.
[15] LI P F,YUAN F G,LI T T,et al.Applied Chemical Industry(李鹏飞,袁福根,李婷婷,等.应用化工),2010,10:1582.
[16] MOLINARI A,AMADELLI R,ANTOLINI L,et al.Journal of Molecular Catalysis A:Chemical,2000,158(2):521.
[17] XAGAS A P,BERNARD M C,HUGOT-LE G A,et al.Journal of Photochemistry and Photobiology A:Chemistry,2000,132(1):115.
[18] AHN W Y,SHEELEY S A,RAJH T,et al.Applied Catalysis B:Environmental,2007,74(1):103.
[19] LAI T Y,LEE W C.Journal of Photochemistry and Photobiology A:Chemistry,2009,204(2):148.
[20] JIANG D,XU Y,WU D,et al.Applied Catalysis B:Environmental,2009,88(1):165.
[21] ZHU J,YANG J,BIAN Z F,et al.Applied Catalysis B:Environmental,2007,76(1):82.
[22] Central China Normal University,Shaanxi Normal University,Northeast Normal University.Analytical Chemistry(Volume Two).Beijing:Higher Education Press(华中师范大学,陕西师范大学,东北师范大学.分析化学下册.北京:高等教育出版社),2001:40.
[23] LI Z W,ZHU Y F.Acta Chimica Sinica(李宗威,朱永法.化学学报),2003,9:1484.
[24] ZHAO D,CHEN C,WANG Y,et al.The Journal of Physical Chemistry C,2008,112(15):5993.
[25] BENDICHO C,PENA F,COSTAS M,et al.TrAC Trends in Analytical Chemistry,2010,29(7):681.
[26] CAO Y,JING L,SHI X,et al.Physical Chemistry Chemical Physics,2012,14(24):8530.
[27] LI Z,LUAN Y,QU Y,et al.ACS Applied Materials & Interfaces,2015,7(41):22727.
