高效液相色谱法测定野生和人工种植库鲁木提草中柚皮苷和木犀草素的含量
2018-05-05木合塔尔吐尔洪楚刚辉尹学博木尼热阿布都克力木
木合塔尔·吐尔洪, 楚刚辉, 尹学博,木尼热·阿布都克力木
(新疆特色药食用植物资源化学重点实验室,喀什大学化学与环境科学学院,新疆喀什 844006)
库鲁木提草,又称矮膜苞芹(Hymenolymanana),主要产于塔什库尔干和叶城等帕米尔高原的高海拔地区,属于维族地区传统民族药物中的珍稀药材,可用于防治糖尿病[1 - 2]。近年来研究发现,库鲁木提草不仅具有明显的降血糖的作用,而且能使糖尿病多饮多食的症状逐渐缓解并存在一定的剂量依赖关系[3]。柚皮苷又名柚苷、柑橘苷或异橙皮苷,全称为柚皮素-7-O-新橙皮糖苷,属于双氢黄酮类化合物[4]。现代药理研究表明,柚皮苷具有多种药理作用,在降血脂、抗氧化、抗肿瘤和抗菌等方面显示较强的生物活性[5 - 6]。木犀草素化学名称为3,4,5,7-四羟基黄酮,具有抗炎、抗氧化和保护神经系统的作用。研究表明木犀草素还能够保护肝脏和心血管系统,预防和减少骨质疏松,同时具有良好的抗肿瘤作用,能有效促进机体抑制胃癌、肝癌、前列腺癌和乳腺癌等恶性肿瘤细胞的增殖[7 - 8]。鉴于柚皮苷及木犀草素的重要药理作用,已有相关植物药及成药中柚皮苷及木犀草素的高效液相色谱(HPLC)测定方法的报道[9 - 12]。
中药及成药中多种成分同时测定比单组分的测定更能够反映出它们的总体质量,因而近年来得到广泛关注[13 - 22]。目前,有关新疆库鲁木提草的研究报道较少。本文以新疆南疆民族药物中的珍稀药材库鲁木提草为研究对象,通过HPLC法检测其中的两种活性成分柚皮苷和木犀草素的含量,希望为库鲁木提草的质量评价及开发应用提供重要的理论依据。
1 实验部分
1.1 仪器、试剂与材料
LC-20AT型高效液相色谱仪(日本,岛津公司),附SPD-M20A二极管阵列检测器、DGU-20A5在线脱气机、LC-20AT高压泵、LC-solution工作站;KQ3200DE型超声波清洗器(昆山市超声仪器有限公司);WJS-100型高速多功能粉碎机(上海缘沃工贸有限公司)。
柚皮苷和木犀草素对照品(纯度均≥98%,上海阿拉丁生化科技股份有限公司),甲醇(色谱纯,天津光复),冰乙酸(分析纯,天津赛孚瑞科技),其他试剂为国产分析纯。水为超纯水,并经0.22 μm微孔滤膜过滤。
选择新疆南疆产野生和人工种植的库鲁木提草,并经由叶尔羌绿洲生态与生物资源重点实验室司马义教授鉴定。将两种库鲁木提草样品于60 ℃烘干,粉碎并过40目筛后,在样品瓶中储存备用。
1.2 溶液的配制
1.2.1混合对照品溶液精确称取柚皮苷和木犀草素对照品,加甲醇溶解并定容至100 mL,制成柚皮苷和木犀草素浓度分别为2 400 mg/L、350 mg/L的标准储备溶液。
1.2.2供试品溶液准确称取1.000 g库鲁木提草,置于具塞锥形瓶中,精确加入50.00 mL 80%甲醇水溶液,密塞,精密称量,浸泡过夜,超声20 min,放冷至室温。用上述甲醇溶液补足减失的质量,摇匀,过滤,得到库鲁木提草供试品溶液。
1.3 色谱条件
色谱柱:Agilent HC-C18柱(250×4.6 mm,5 μm);以甲醇为流动相A,以0.2%乙酸水溶液为流动相B;流动相流速为1.0 mL/min;梯度洗脱条件:0~40 min,35%~100%A。柱温为室温;进样量为10 μL;检测波长为254 nm。
2 结果与讨论
2.1 色谱条件的选择
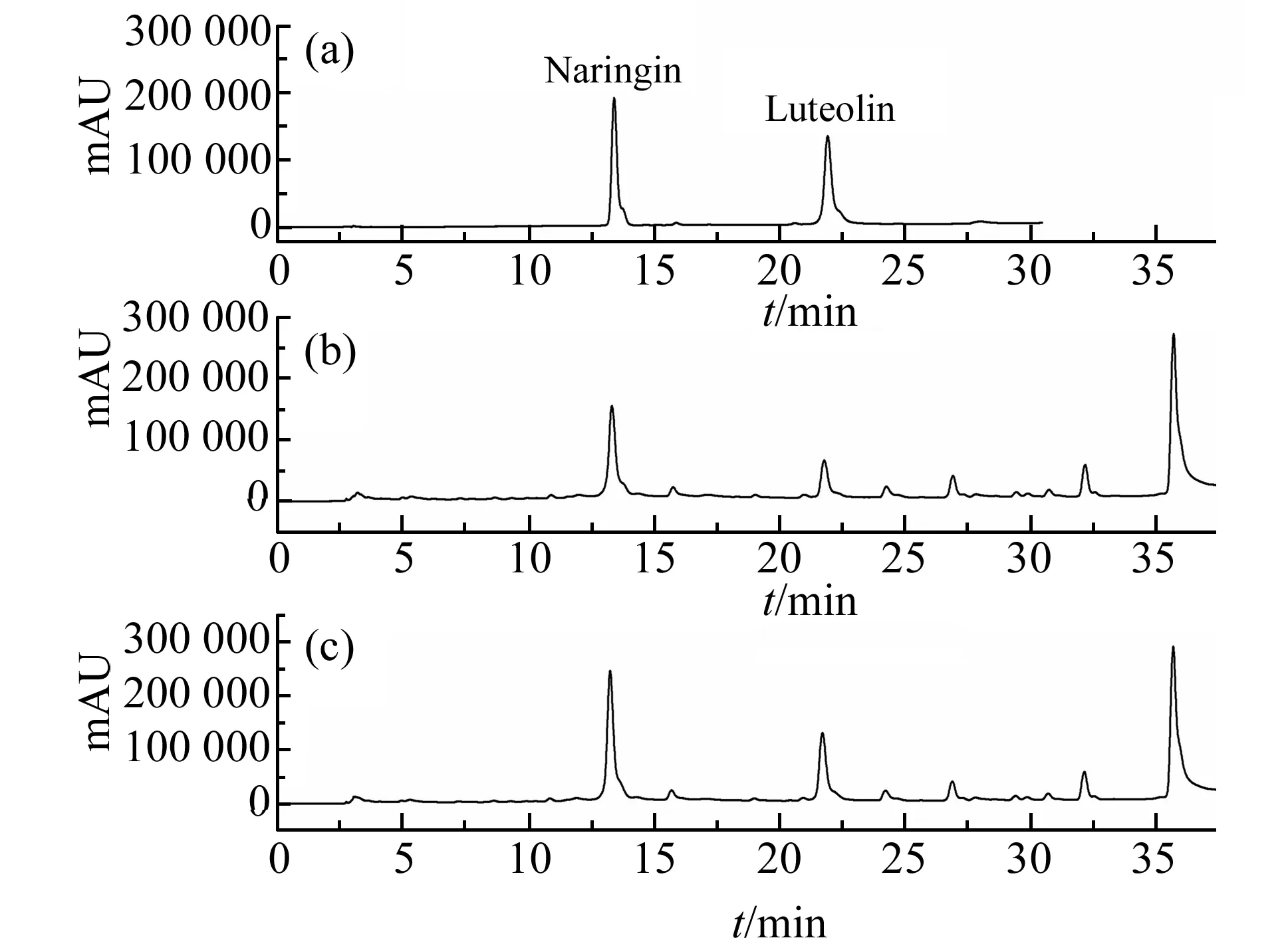
图1 混合对照品(a)、供试品(b)和加标样(c)的色谱图Fig.1 Chromatograms of mixed reference substance (a),sample (b) and spiked sample (c)
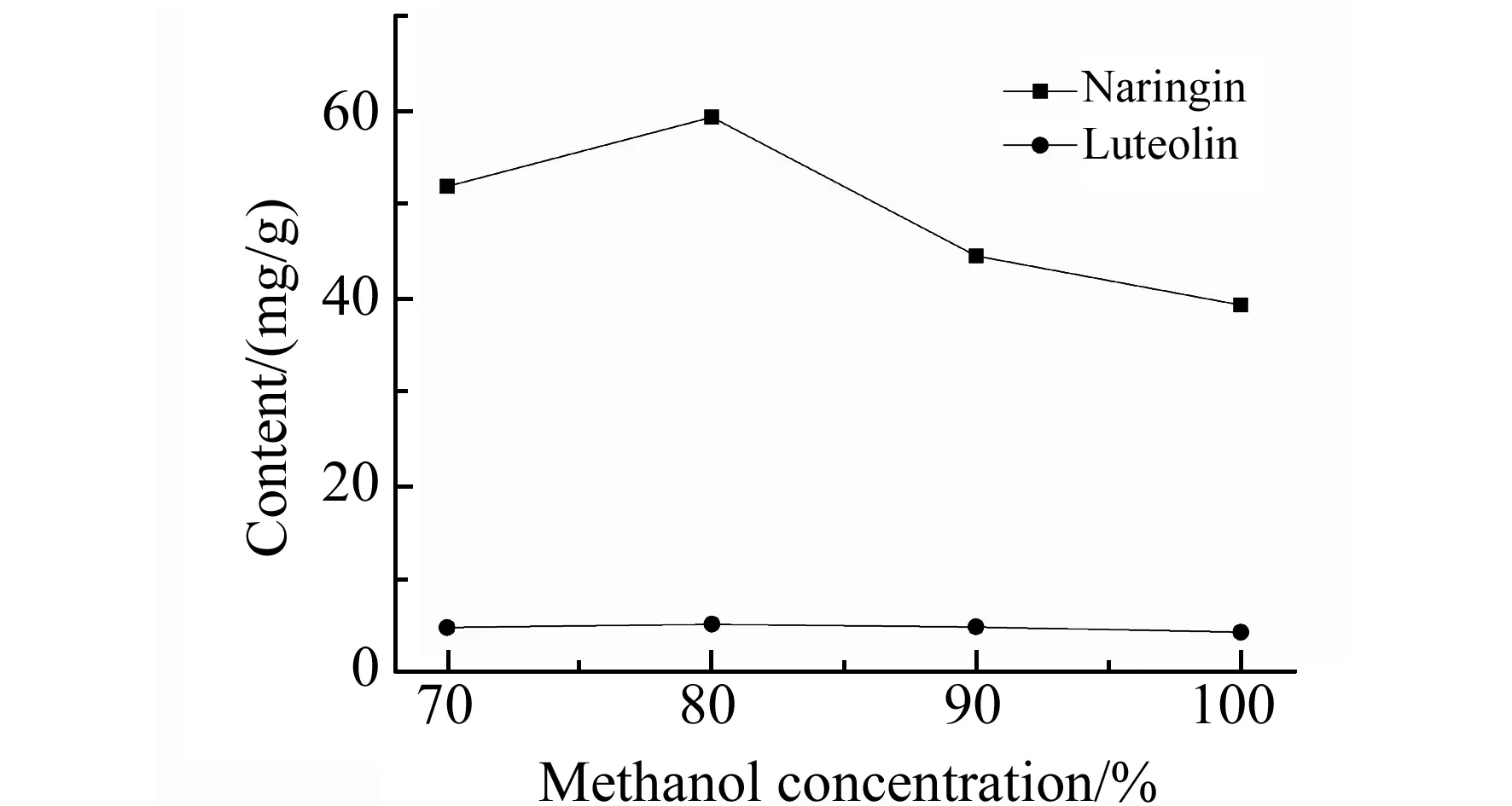
图2 甲醇浓度对组分含量的影响 Fig.2 Effects of methanol concentration on the component contents
为了获得库鲁木提草提取液良好的色谱分离效果,分别试验了甲醇-水和甲醇-0.2%乙酸水溶液为流动相对分离效果的影响。结果发现,使用甲醇-水作为流动相,两种被测组分色谱峰拖尾现象较严重。而以甲醇-0.2%乙酸水溶液为流动相,可以得到较为满意的分离效果。采用二极管阵列检测器选择检测波长,发现库鲁木提草提取液中两种活性组分在254 nm均有较高的响应信号,而且色谱峰峰形良好,并与其他组分有较好的分离效果,故选择254 nm作为本实验的检测波长。混合标样、样品和加标样品的色谱图见图1。从图1可以看出,样品中的两种活性成分柚皮苷和木犀草素相互之间以及它们与其他组分之间均实现了良好的色谱分离。
2.2样品提取方法考察
为了得到被测组分良好的提取率,称取1.0 g野生库鲁木提草样品,分别以70%、80%和90%的甲醇水溶液以及纯甲醇对其中的两种目标物进行提取并测定,测得的含量见图2。由图可以看出,甲醇比例对木犀草素的提取影响较小,而对柚皮苷的提取影响较大;纯甲醇对柚皮苷的提取效果欠佳,随着提取溶剂中适当增加纯水比例可以有效提高柚皮苷组分的提取量,但当用70%甲醇水溶液提取时,提取量有所降低,而且提取液较难通过微孔滤膜过滤,这可能是由于样品溶出多糖的影响。综上所述,80%(V/V)的甲醇水溶液对于两种组分的提取效果良好,而且易于过滤膜。因此,选择80%(V/V)的甲醇水溶液用于库鲁木提草样品中两种有效成分的提取。为了保证样品中有效成分的充分溶出,干燥粉碎的样品经浸泡过夜后再超声,超声时间为20 min。
2.3 色谱峰的确定
在标准品和样品提取液的色谱图(图1)中,混合标准溶液中柚皮苷、木犀草素的保留时间分别为13.415、21.924 min,样品提取液中柚皮苷、木犀草素的保留时间分别为 13.326、21.786 min。经过保留时间比对和加标样品分析可初步确认两个色谱峰组分的归属。为了进一步验证两个色谱组分,通过样品提取液的二极管阵列3D图得到两个组分的吸收光谱图。再将两个组分对应色谱峰的光谱图与标准品的紫外吸收光谱图比对,两个吸收光谱的主要吸收峰峰位基本吻合(图3)。两种光谱图的差异可能是由于溶剂影响与杂质组分干扰,以及二极管阵列检测器本身光谱采集精度问题引起的。因此,通过混合标准样和样品提取液中两个组分色谱峰的保留时间,以及它们吸收光谱主要峰位的吻合程度,可以确认样品色谱图中这两个组分的归属。
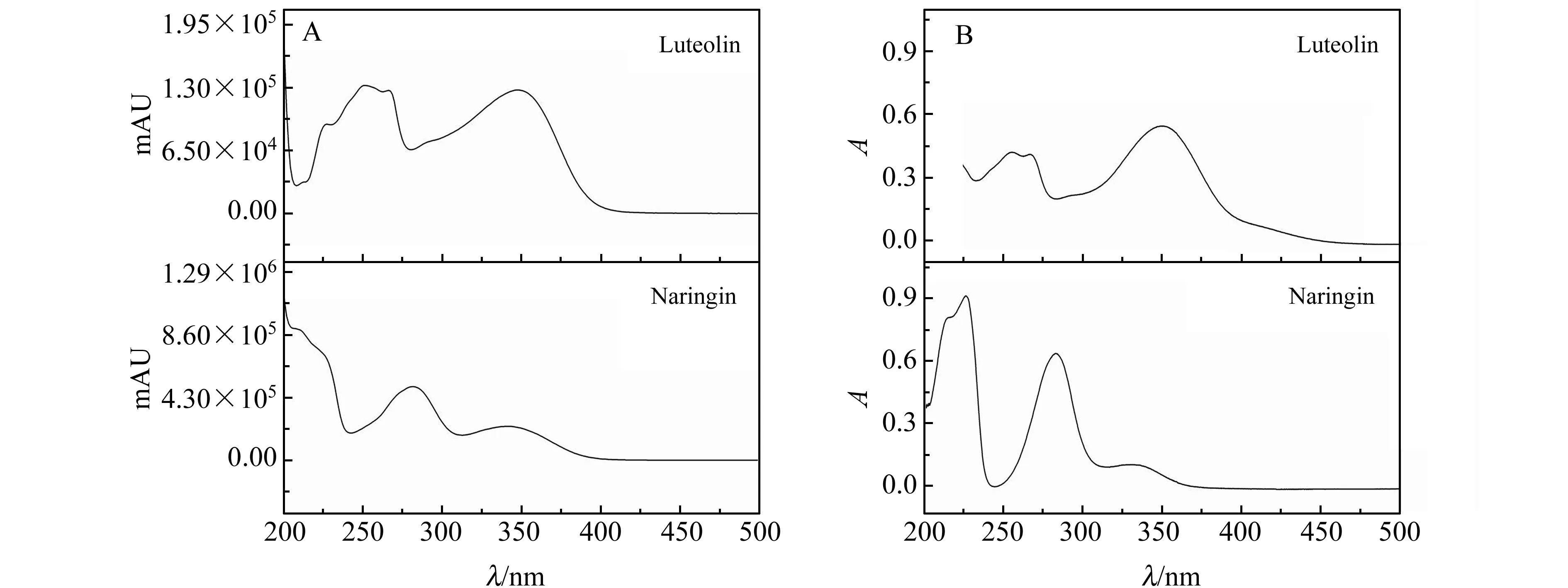
图3 提取色谱峰(A)和对照品(B)的紫外-可见(UV-Vis)吸收光谱图Fig.3 UV-Vis absorption spectra of chromatographic peaks(A) and standard sample(B)
2.4 线性关系
准确吸取适量混合标准储备溶液,分别置于10 mL容量瓶中,配制浓度分别为120、240、360、480、720、1 200 和1 440 mg/L的柚皮苷,以及浓度分别为17.5、35、52.5、70、105、175和210 mg/L的木犀草素混合标准系列溶液,按优化的色谱条件进行检测。两组分分别以峰面积(A)为纵坐标,对照品质量浓度(c,mg/L)为横坐标绘制标准曲线,其回归方程、相关系数和线性范围见表1。结果表明柚皮苷和木犀草素均具有良好的线性关系。

表1 两种组分的回归方程、相关系数、线性范围
2.5 精密度和重复性试验
取混合对照品溶液(720 mg/L柚皮苷和105 mg/L木犀草素),在优化的色谱条件下连续进样5次,测定柚皮苷和木犀草素峰面积的相对标准偏差(RSD),结果分别为1.06%和0.31%,精密度良好。准确称取同一种库鲁木提草样品5份,每份约1.0 g,按优化的提取方法制备库鲁木提草供试品溶液,按上述色谱条件进行测定,计算库鲁木提草提取液中的柚皮苷和木犀草素质量分数的RSD分别为1.64%和0.54%,实验结果表明提取方法和测定重复性良好。
2.6 稳定性和回收率试验
将同一种库鲁木提草样品溶液,分别放置0、2、4、6、8、12、24 h后,按优化的色谱分离条件进样检测。计算柚皮苷和木犀草素峰面积的RSD,结果分别为1.86%和0.73%,表明样品提取溶液在24 h内稳定性良好。
准确称取野生库鲁木提草样品粉末9份,每份0.5 g,分别按低、中、高量精密加入柚皮苷和木犀草素的标准品溶液,每种加入量重复3次,按实验部分制备加标样品溶液并在优化的色谱条件检测,通过标准曲线法计算回收率。结果表明柚皮苷和木犀草素回收率较稳定,分别在93.8%~100.2%和98.3%~100.6%以内,RSD分别在1.8%~2.7%和1.3%~2.9%,回收率结果如表2所示。
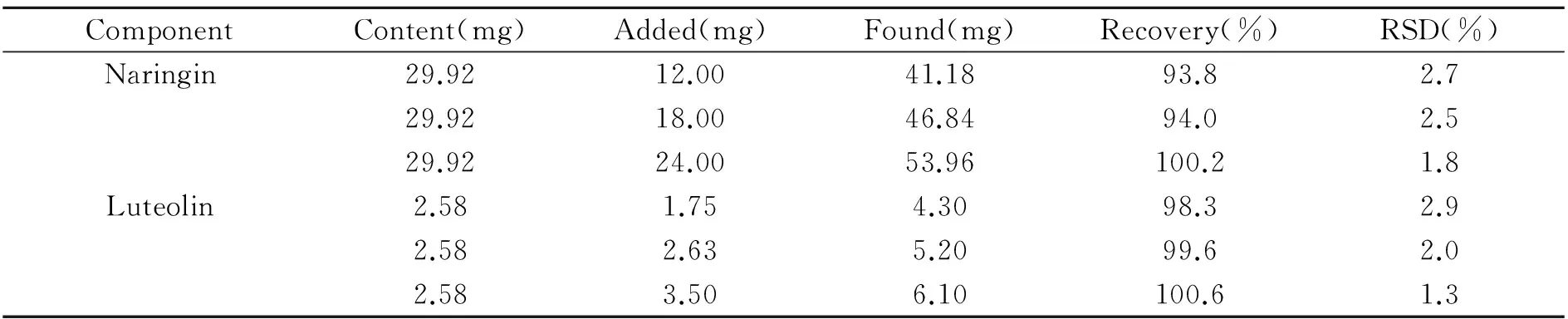
表2 库鲁木提草样品的加标回收率(n=3)
2.7 样品测定
准确吸取按实验部分萃取方法制备的野生和人工栽培库鲁木提草供试品溶液10 μL进样,按优化的色谱条件分离测定,平行测定5次。记录柚皮苷和木犀草素的峰面积并计算含量,分析结果见表3。可以看出野生库鲁木提草中柚皮苷为人工栽培样品含量的1.75倍,木犀草素含量是人工栽培样品的2.97倍。两种被测物含量结果表明野生库鲁木提草的品质高于人工栽培库鲁木提草。

表3 样品中柚皮苷和木犀草素的测定结果(n=5)
3 结论
本文建立了库鲁木提草中柚皮苷和木犀草素两种活性成分的提取和检测方法。选择新疆南疆野生及人工栽培库鲁木提草,以80%甲醇水溶液为提取剂,通过浸泡、超声处理实现高效提取。同时,优化了柚皮苷和木犀草素的高效液相色谱检测条件,两种活性成分在40 min内实现良好的基线分离。建立的分析方法简便、重现性好、准确度较高,能够同时用于库鲁木提草中柚皮苷和木犀草素含量的测定,实验结果发现这两种活性成分在野生库鲁木提草中比在人工栽培库鲁木提草中的含量更高,说明野生库鲁木提草的药用价值更高。本工作为库鲁木提草的质量评价提供了可靠的依据,并为库鲁木提草资源的深度开发利用及药用研究提供一定的数据支持。建立的方法对其他民族药物分析和检测具有一定的借鉴意义。
参考文献:
[1] FEI Y,XIA Y,WU Y H.Chinese Wild Plant Resources(费勇,夏榆,吴玉虎.中国野生植物资源),1990,7(2):26.
[2] WU S G,FEI Y,XIA Y,et al.Journal of Natural Resources(武素功,费勇,夏榆,等.自然资源学报),1990,5(4):376.
[3] ZHU G H,ZHANG L,NIU X M,et al.Journal of Xinjiang Agricultural University(朱光辉,张磊,牛新民,等.新疆农业大学学报),2015,38(3):237.
[4] WANG H Y,LIANG L X,LI J,et al.China Pharmacy(王海燕,梁利香,李娟,等.中国药房),2015,26(34):4856.
[5] CHEN J H,OU S J,YANG Z P,et al.Applied Chemical Industry(陈锦杭,区硕俊,杨展鹏,等.应用化工),2016,45(3):508.
[6] XU F C,PAN S Y.Science and Technology of Food Industry(许方驰,潘思轶.食品工业科技),2016,37(11):238.
[7] WANG Y H,LI A F,FU C L,et al.Lishizhen Medicine and Materia Medica Research(王月华,李爱峰,付崇罗,等.时珍国医国药),2016,27(7):1587.
[8] WANG J S,HE Y,ZHANG W J,et al.Chinese Bulletin of Life Sciences(王继双,何焱,张文静,等.生命科学),2013,25(6):560.
[9] ZHU K,WU L C,ZHOU L N.Chinese Traditional and Herbal Drugs(朱克,吴立成,周玲娜.中草药),2010,41(6):914.
[10] GUON,YAN H,PENG J,et al.Chinese Journal of Experimental Traditional Medical Formulae(郭娜,闫寒,彭娟,等.中国实验方剂学杂志),2013,19(18):143.
[11] HU R,YAO M,LI Y Y,et al.Traditional Chinese Drug Research and Clinical Pharmacology(胡蓉,姚闽,李玉云,等.中药新药与临床药理),2009,20(3):271.
[12] LI Y X,LU Y H,FENG W,et al.Chinese Journal of Experimental Traditional Medical Formulae (李英霞,陆永辉,冯文,等.中国实验方剂学杂志),2011,17(1):56.
[13] SHI S M.Chinese Pharmaceutical Journal(石上梅.中国药学杂志),2015,50(20):1752.
[14] NIU X X,CUI X S,SU H,et al.Chinese Journal of Chromatography(牛晓雪,崔旭盛,苏贺,等.色谱),2012,30(2):211.
[15] MUHETAER T,RESALAT Y,CHU G H,et al.Chinese Journal of Chromatography(木合塔尔·吐尔洪,热萨莱提·伊敏,楚刚辉,等.色谱),2015,33(12):1269.
[16] YE X L,SONG F Y,FAN G R,et al.Chinese Journal of Chromatography(叶晓岚,宋粉云,范国荣,等.色谱),2015,33(4):423.
[17] ZHANG M Y,XU Y,SONG G S,et al.Chinese Journal of Chromatography(张梦雨,徐洋,宋冠杉,等.色谱),2016,34(8):773.
[18] Thiesen L C,Block L C,Zonta S L,Bittencourt C M D S,Ferreira R A,Filho V C,Couto A G,Bresolin T M B.Revista Brasileira de Farmacognosia,2016,26(2):168.
[19] Yang H J,Yim N H,Lee K J,Gu M J,Lee B,Hwang Y H,Ma J Y.Integrative Medicine Research,2016,5(2):140.
[20] Liu Z,Wu H L,Li Y,Gu H W,Yin X L,Xie L X,Yu R Q.Journal of Chromatography B,2016,1026(15):114.
[21] Wang S Q,Zhang J J,Liu J,Qian G S,Fu C M.Journal of Pharmaceutical Analysis,2016,6(4):249.
[22] Cui H R,Xu G H,Wu M Q,Jiang W Y,Han J J,Wang J B,Bai Z F,Cai G M,Xiao X H.Chinese Herbal Medicines,2016,8(4):331.
