改进QuEChERS-气相色谱/质谱法测定食源性植物中烟碱及次要生物碱
2018-05-05张洪非罗彦波李翔宇姜兴益朱风鹏庞永强陈韩书磊付亚宁侯宏卫
张洪非, 罗彦波, 李翔宇, 姜兴益, 朱风鹏, 庞永强陈 欢, 韩书磊, 付亚宁, 刘 彤, 侯宏卫
(国家烟草质量监督检验中心,河南郑州 450001)
生物碱是植物的次生代谢产物,约四分之一的植物都会产生生物碱[1]。据文献报道在马铃薯,西红柿、茄子和辣椒中能检测到低水平的烟碱含量(10 μg/kg以下)[2 - 9]。除了烟碱外的其它生物碱叫做次要生物碱,如降烟碱、新烟草碱、假木贼碱、麦斯明、可替宁、2,3′-二吡啶、3,3′-二吡啶、二烯烟碱、N-甲基假木贼碱、二烯降烟碱等。其中,降烟碱、新烟草碱和假木贼碱的含量相对较高,研究也最多[6]。次要生物碱在烟草中广泛分布,但在西红柿、土豆等食物中未检出烟碱之外的其他生物碱[7]。
烟草中主要生物碱的测定大多采用气相色谱法(GC)[8-9]、气相色谱-质谱法(GC/MS)[10 - 11],应用高效液相色谱(HPLC)分离测定烟草中生物碱的报道较少[12 - 13],毛细管电泳分析的方法也有报道[14]。目前未见食源性植物中次要生物碱的检测方法报道。《烟草及烟草制品 烟碱、降烟碱、新烟碱、麦斯明和假木贼碱的测定 气相色谱-质谱联用法》(YC/T383-2010)针对烟草产品开发了检测方法,由于烟碱在烟草中的含量达到3%,因此对于生物碱含量较低的西红柿和茄子等不能检测。同时由于茶叶、牛肝菌等样品基质较为复杂,含有色素较多,因此需要优化净化步骤。
QuEChERS的样品前处理技术[15]在植物检测中广泛应用,但当其应用于沸点低的萃取溶剂时易导致发热量太大从而影响目标物的测定结果。为了验证食源性植物(牛肝菌、茶叶、马铃薯,番茄,茄子和甜辣椒等)中烟碱及次要生物碱是否由污染产生,以及评估从膳食暴露摄入烟碱及次要生物碱的潜在风险,本研究采用改进QuEChERS-气相色谱/串联质谱法(GC/MS),测定上述食源性植物中烟碱和次要生物碱及其含量分布。
1 实验部分
1.1 仪器与试剂
6890N气相色谱/5975B质谱联用仪(美国,Agilent公司);PAS净化试剂包(美国,Agilent公司)。
烟碱、降烟碱与可替宁储备溶液:分别准确称取约15.0 mg烟碱及可替宁、降烟碱,置于3个25 mL的棕色容量瓶中,用0.01%三乙胺-甲基叔丁基醚溶液稀释定容至刻度。麦斯明储备溶液:准确称取约10.0 mg麦斯明,置于25 mL的棕色容量瓶中,用0.01%三乙胺-甲基叔丁基醚溶液稀释定容至刻度。假木贼碱和新烟碱混标储备溶液:准确称取约15.0 mg假木贼碱、10.0 mg新烟碱,置于25 mL的棕色容量瓶中,加入约10 mL萃取溶液完全溶解后,用0.01%三乙胺-甲基叔丁基醚溶液稀释定容至刻度。麦斯明、可替宁、假木贼碱和新烟碱的混和标准溶液:分别移取0.02、0.05、0.10、0.25、0.50、1.0 mL的麦斯明、可替宁、假木贼碱和新烟碱混标储备液于不同的10 mL棕色容量瓶中,再准确加入200 μL内标储备液,用0.01%三乙胺-甲基叔丁基醚溶液稀释定容至刻度。内标2-甲基喹啉溶液:800 μg/mL。烟碱、降烟碱标准溶液:分别移取0.02、0.05、0.10、0.25、0.50 mL的各标准储备溶液于10 mL棕色容量瓶中,再准确加入200 μL内标储备液,用0.01%三乙胺-甲基叔丁基醚溶液稀释定容至刻度。6种目标物和内标2-甲基喹啉均购自德国Dr.Ehrenstorfer公司。甲基叔丁基醚、乙腈、三氯甲烷(色谱纯,韩国德山化工有限公司)。所用水由Milli-Q系统(Milford,MA,USA)制得。
1.2 仪器条件
GC/MS条件:色谱柱为DB-35 ms柱(30 m×0.25 mm×0.25 μm);柱温箱程序:初始温度100 ℃,保持3.0 min,再以8 ℃/min升至260 ℃,保持10 min,总运行时间:33 min。进样量3 μL;分流进样,分流比为:5∶1;高纯He为载气;接口和离子源温度为300 ℃和200 ℃;电离源为EI源;电离能量70 eV;溶剂延迟时间8 min;目标物及内标的选择离子监测(SIM)模式参数如表1所示。
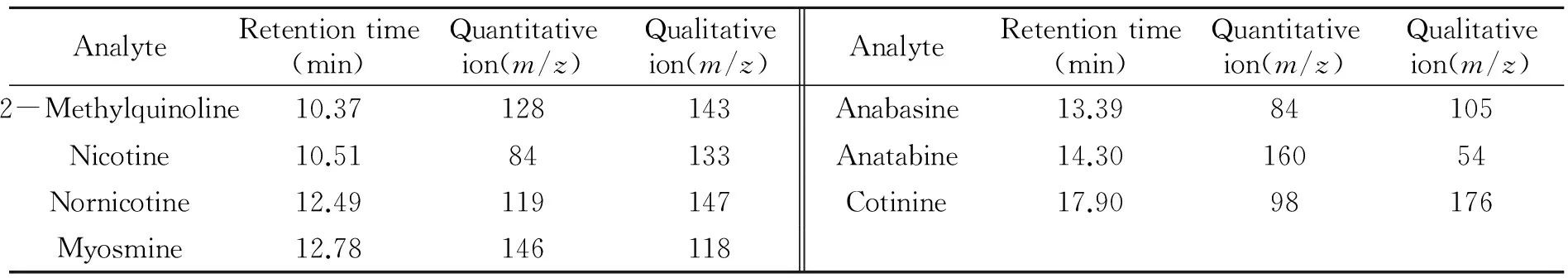
表1 目标物和内标的SIM参数和保留时间
1.3 样品制备
称取2.0 g已粉碎的样品,置于50 mL具塞离心管中,加入2.0 mL 10%的NaOH溶液浸润样品,静置10 min。取10 mL 0.01%三乙胺-甲基叔丁基醚到离心管中,加入200 μL 2-甲基喹啉内标溶液,于旋涡混合器上以2 000 r/min振荡1 min。移取1.0 mL上清液于2 mL净化离心管中(内含150 mg无水MgSO4,25 mg PSA吸附剂,7.5 mg GCB吸附剂),于旋涡混合器上以2 000 r/min振荡2 min,以5 000 r/min离心3 min。取上清液过0.22 μm有机相滤膜后,进行GC-MS检测。
2 结果与讨论
2.1 萃取方式的选择
本研究考察了QuEChERS技术的高速涡旋振荡提取及超声提取,结果显示采用涡旋振荡提取结果均高于超声提取(图1),因此最终选择涡旋振荡的萃取方式。
2.2 萃取溶剂的选择
本研究优化了萃取溶剂。当使用正己烷等非极性溶剂做萃取剂时,样品提取液中的极性共萃取基质较少,但对烟碱等目标物的萃取效率较差。常用的溶剂中,丙酮萃取的杂质较多,而且对MgSO4具有一定的溶解性,溶液中含盐对色谱柱不利;乙酸乙酯对部分极性目标物萃取效率不高;乙腈作为QuEChERS前处理方法中的一种通用极性溶剂,可同时萃取极性和非极性目标物,而且有利于下一步的净化。同时还考察了三氯甲烷及甲基叔丁基醚的萃取效率。结果表明,甲基叔丁基醚与三氯甲烷的萃取效率比较接近,乙腈稍低,实验选择甲基叔丁基醚作为萃取溶剂。
2.3 缓冲体系的选择
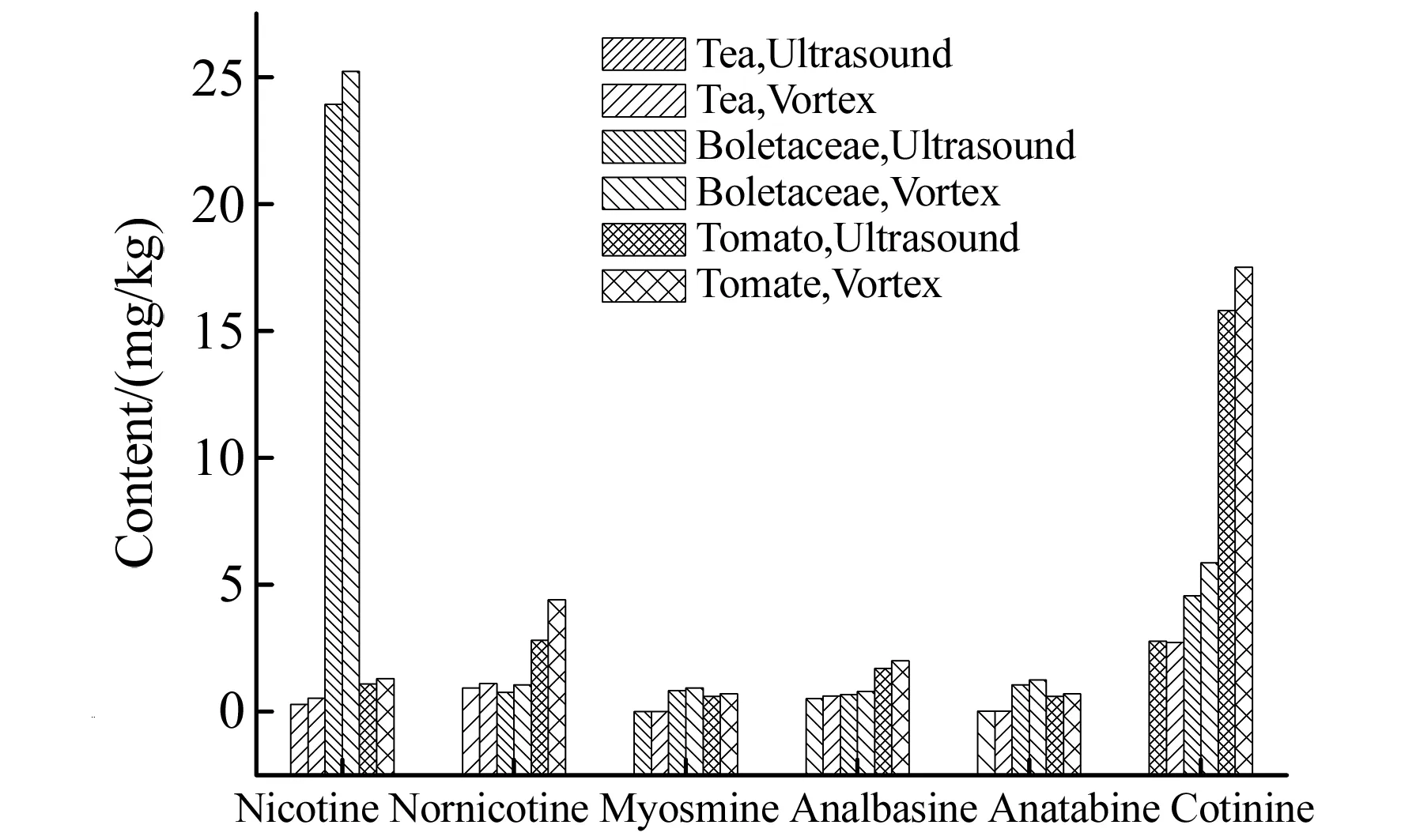
图1 不同提取方式的提取效果Fig.1 Extraction efficiency of different extraction modes
Anastassiades等[15]提出了适用于水果和蔬菜的多残留分析方法,该方法发展迅速,并不断改进以适用于不同的目标物,但原方法对碱敏感的目标物会受基质影响而使回收率变差。Anastassiades等后来采用加入柠檬酸盐的方法以获得稳定的pH,该方法被欧盟认可为标准方法(EN 15662)[16]。本研究考察了柠檬酸缓冲盐体系在食源性样品基质中的提取效率。柠檬酸缓冲盐体系为:4 g无水MgSO4+1 g NaCl+1 g Na3Cit·2H2O+0.5 g Na2HCit·1.5H2O。这个体系样品基质的pH值为5.0~5.5,而本研究的目标物为烟碱类物质,需要在碱性条件下才能游离出来;同时测定了样品不加缓冲盐试剂包的pH为9.0,加入缓冲盐试剂包的pH在7.0左右,不利于目标物的游离。另外,由于缓冲盐试剂包中含有4 g MgSO4,在吸水的同时释放了大量的热量,使溶剂温度达到55 ℃,由于甲基叔丁基醚的沸点为55.2 ℃,因此可以明显观察到溶液的沸腾,这样会使溶剂和目标物造成了损失,实验结果也验证了这个现象。如图2所示,以未加缓冲盐体系的样品中目标物结果进行归一化,发现加入缓冲盐试剂包的结果偏低,尤其对于麦斯明,结果偏低50%左右。因此,本方法对QuEChERS法进行改进,采用不加缓冲盐试剂包而采用涡旋振荡的萃取方法。
2.4 净化吸附剂的选择
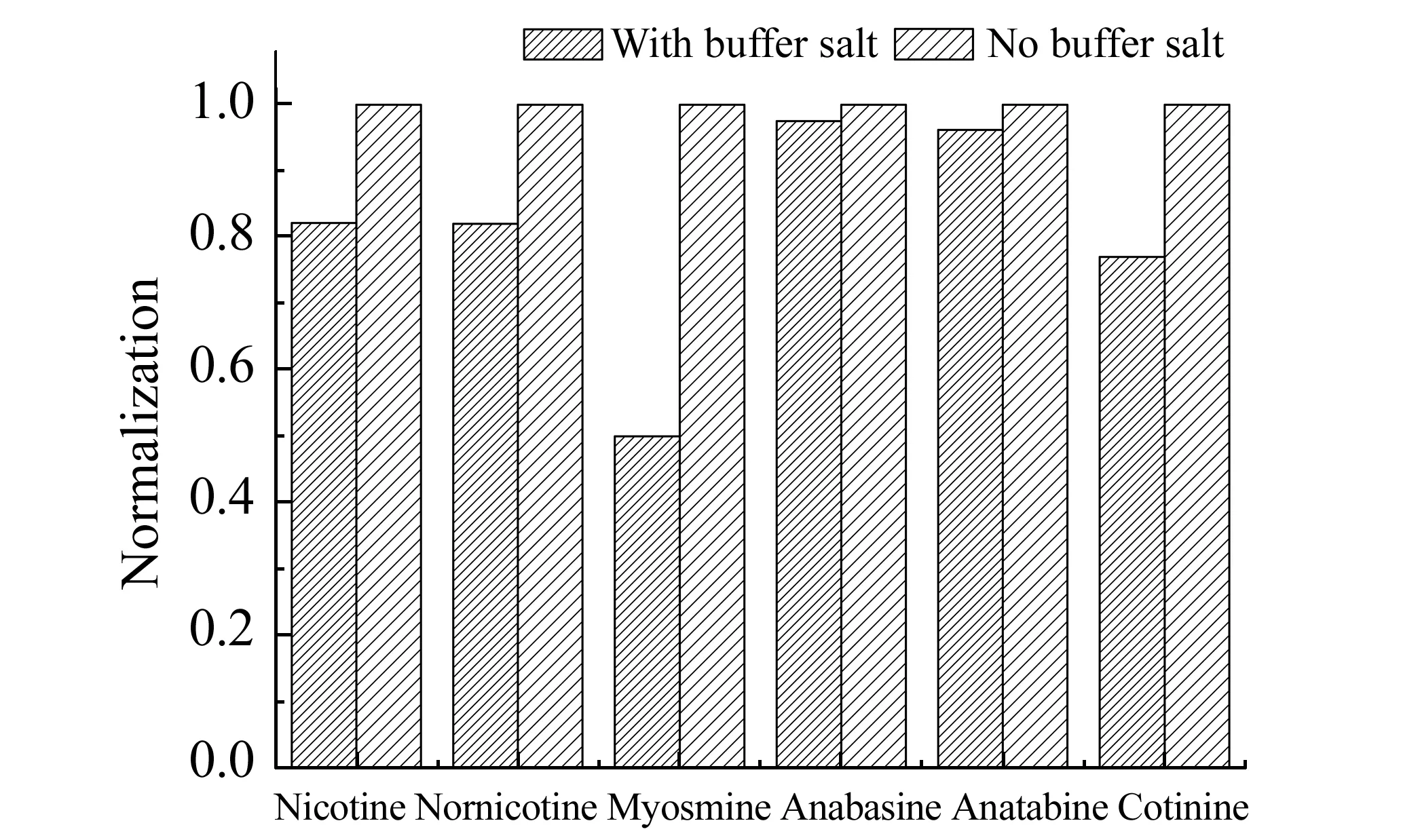
图2 目标分析物在缓冲体系中的回收率Fig.2 Recovery of the analyte in buffer system
在QuEChERS前处理方法中,常用的净化剂有PSA、C18、GCB等。其中,PSA可除去提取液中的碳水化合物、脂肪酸、有机酸、酚类和少量的色素;C18可去除脂肪和酚类化合物;GCB主要用于除色素。基质中的主要干扰物为脂肪酸、有机酸、碳水化合物、甾醇等极性干扰物,而PSA作为弱阴离子交换吸附剂,对于上述极性干扰物的吸附提供最好的净化效果。水分含量对PSA的净化效果有着至关重要的作用,水分含量越低,PSA的净化效果越好。并且无水MgSO4的除水效果要好于Na2SO4。因此在PSA中添加C18和/或GCB,考察不同净化剂组合对提取液的净化效率及对目标物的吸附效应,目标物在不同净化剂作用下的回收率见图3。从结果来看,最终选择High pigment(25 mg PSA+7.5 mg GCB+150 mg MgSO4(每mL提取液))作为净化剂。
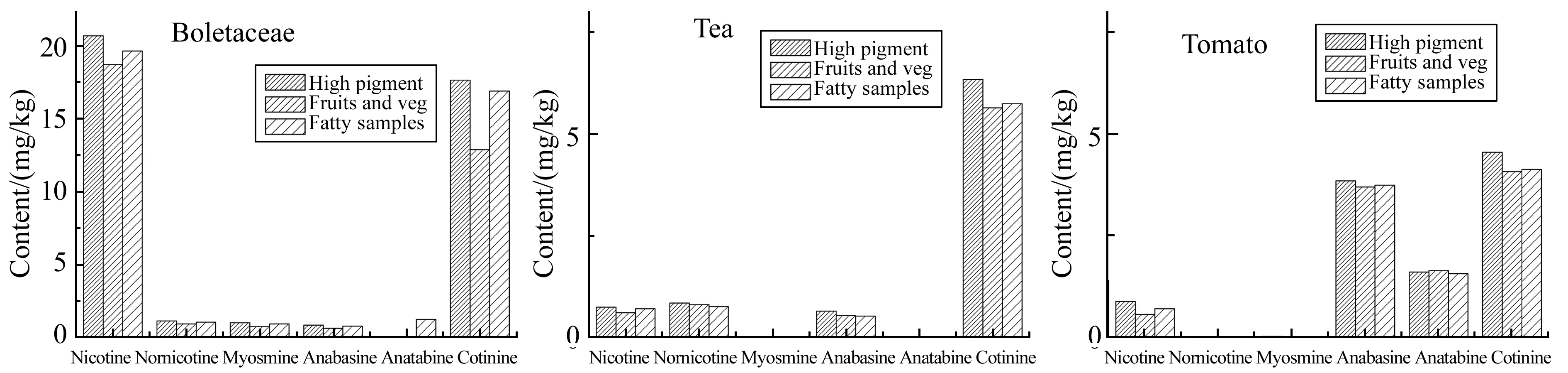
图3 三种PSA的净化效果Fig.3 Clean-up effect of 3 PSA
2.5 基质效应
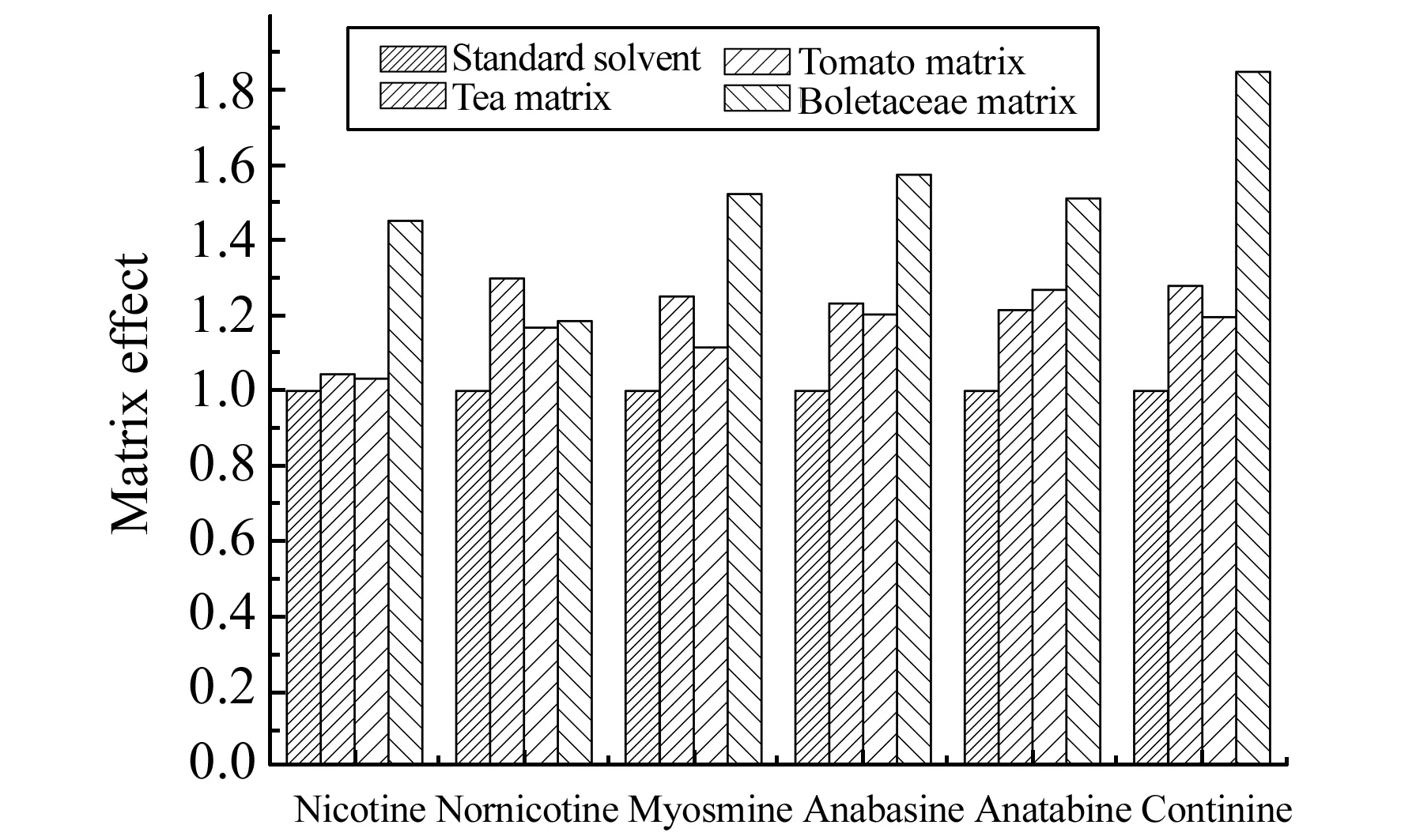
图4 6种目标物在3种不同提取液中的基质效应Fig.4 Matrix effects of 6 analytes in three different extracts
与液相色谱/串联质谱的基质效应主要来自于离子源不同,气相色谱/串联质谱的基质效应主要来自气相部分,而且以基质增强效应为主。减小基质效应应用最多的是用基质匹配标准溶液建立标准工作曲线,对基质效应进行校正。三个样品基质匹配标准溶液按实验方法进行配制,通过对比标准溶液和基质匹配标准溶液的信号差异来考察三种不同的前处理方法得到的萃取液中目标物的基质效应。6种目标物的基质效应见图4。由图4可知,大部分目标物在提取液中均呈现显著的基质增强效应。三种基质中,牛肝菌提取液的基质效应最强(对几种不同种类的目标物都是如此),表明其基质含量最大;而西红柿萃取液基质效应相对较弱。因此,本研究采用加入和目标物结构类似的2-甲基喹啉作为内标对基质效应进行校正。
2.6 方法确认
在优化条件下,考察了方法的检出限(S/N=3)、定量限(S/N=10)、线性范围和重现性。分别以目标物浓度及其峰面积与内标峰面积之比为横、纵坐标绘制工作曲线。如表2所示,6种目标物的检出限在0.06~0.18 mg/kg之间,定量限在0.07~0.60 mg/kg之间,线性相关系数R2≥0.993。
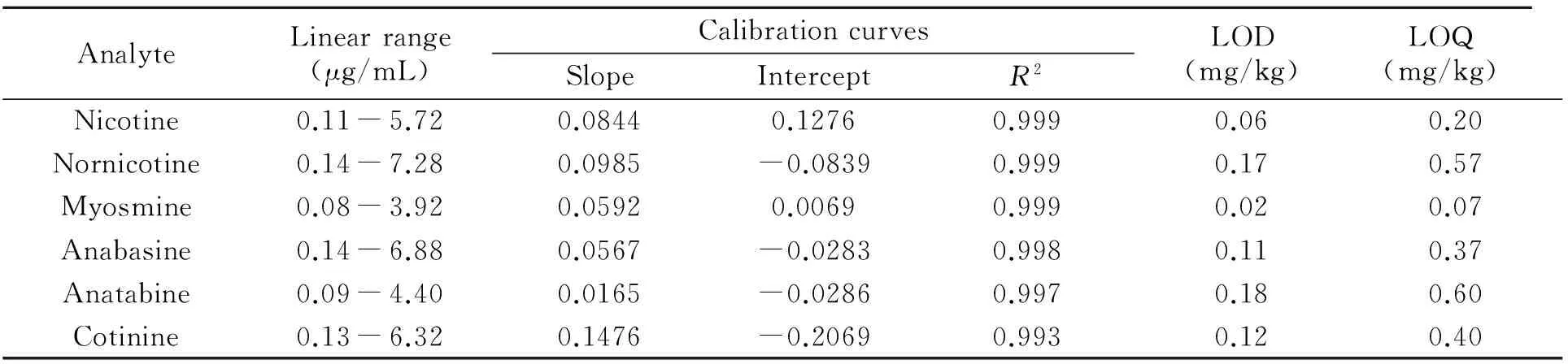
表2 目标物的线性范围、工作曲线、检出限和定量限
将牛肝菌、茶叶和西红柿3种样品加标后用本方法测定,如表3所示,目标物的平均回收率在84.1%~109.1%之间。为了考察本方法的重现性,对3种浓度的样品,以1 d内5次平行测定,及连续3 d测定,计算日内和日间相对标准偏差(RSD)。如表4所示,目标物的日内及日间精密度分别小于9.4%和8.2%,其中目标物在中浓度和高浓度下的日内及日间精密度数值不高于8.4%,低浓度下的日内及日间精密度数值略高。
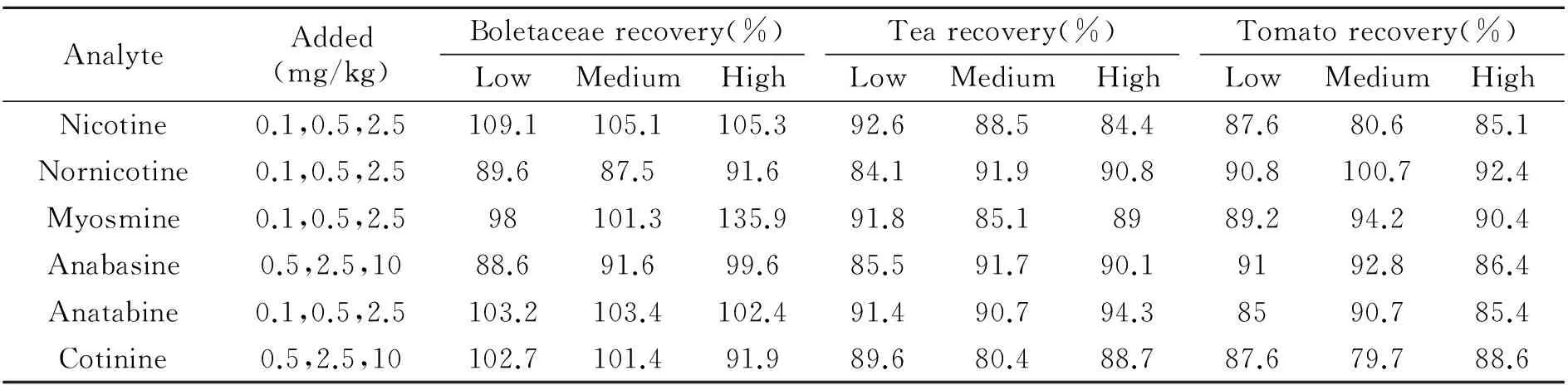
表3 实际样品中目标物的回收率
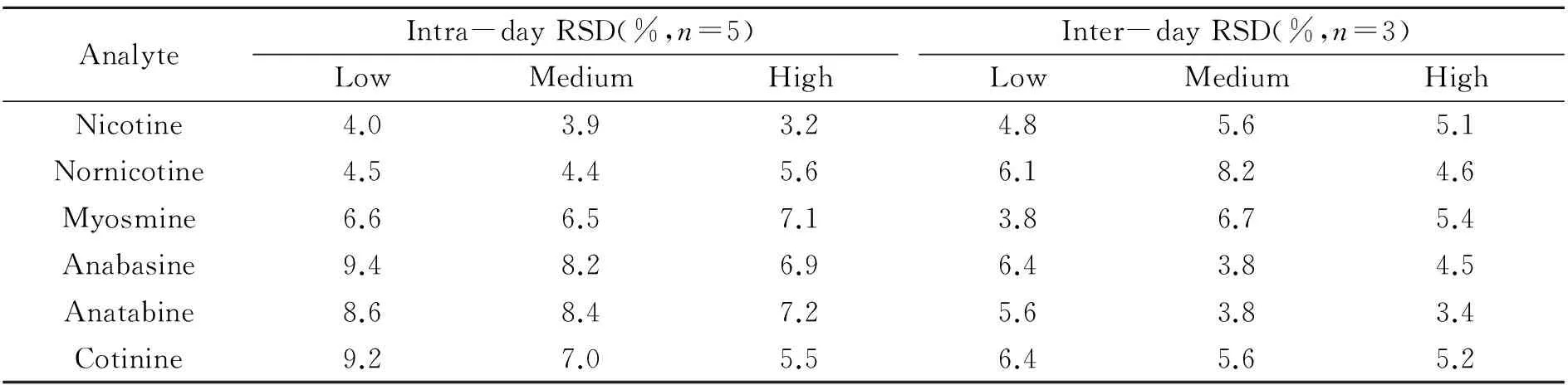
表4 目标物在不同浓度下的精密度
2.7 实际样品分析
为了验证本方法在实际样品中的应用效果,采用本方法处理16个茶叶样品、6个牛肝菌样品、3个西红柿样品、1个土豆样品、1个茄子样品和1个辣椒样品并进行测定。6个牛肝菌样品中烟碱、降烟碱、假木贼碱和可替宁均有检出,麦斯明检出率16.7%;新烟碱均未检出,见表5。16个茶叶样品中烟碱、降烟碱、假木贼碱和可替宁均有检出;麦斯明检出率25%;新烟碱均未检出。3个西红柿样品中烟碱均有检出;同样降烟碱、假木贼碱、麦斯明、新烟碱和可替宁也全部有检出,含量略有不同,其中可替宁含量最高,新烟碱含量最低。土豆和茄子样品中烟碱均有检出,含量分布在1.20~1.60 mg/kg之间;同样降烟碱、假木贼碱和麦斯明也全部有检出,含量略有不同,新烟碱和可替宁均未检出。辣椒样品烟碱、降烟碱、假木贼碱、麦斯明和新烟碱也有检出,含量和土豆、茄子一致;可替宁未检出。
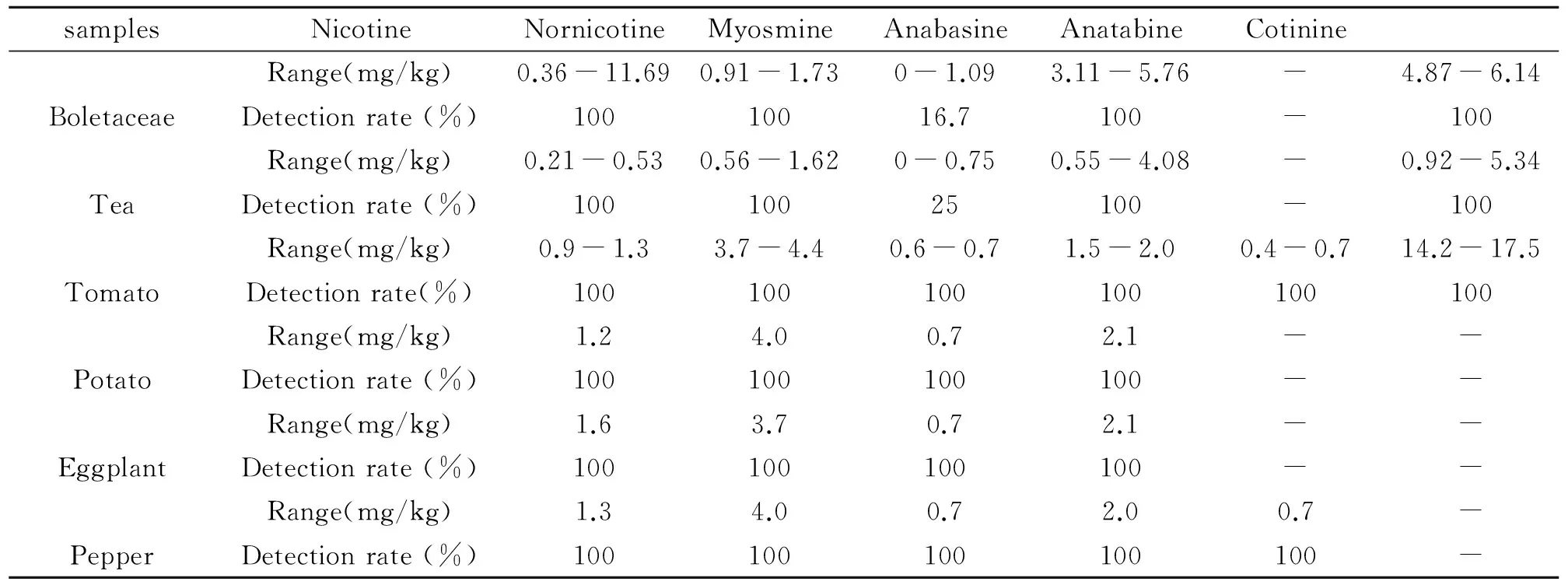
表5 检测样品目标物含量(mg/kg)
"-" not detected.
通过与文献方法[17 - 19]比较,发现牛肝菌和茶叶中烟碱的数据以前未见报道。西红柿等茄科植物中的烟碱含量报道较多,由于前期研究集中在20世纪90年代,那时的检测条件和现在差异较大,同时由于所测定的样品种属的不一致,以及样品成熟度的不一致(含水率不同),也导致数据存在一定的差异性。
3 结论
采用改进QuEChERS方法,以0.01%三乙胺-甲基叔丁基醚溶液对样品中的生物碱进行涡旋提取,用High pigment PSA对提取物进行净化,结合气相色谱-质谱联用仪,建立了食源性植物(牛肝菌、茶叶和西红柿)中烟碱和5种次要生物碱的检测方法。本方法具有样品前处理简单、净化能力强和灵敏度高的优点。采用本方法处理16个茶叶样品、6个牛肝菌样品、3个西红柿样品、1个土豆样品、1个茄子样品和1个辣椒样品并进行测定,结果发现烟碱在所有样品中均有不同程度的检出,降烟碱、新烟碱、麦斯明、假木贼碱和可替宁在部分样品中有检出。
参考文献:
[1] Lewis D A,York B M Jr.Biochemical Systematics and Ecology,1978,6:61.
[2] Andersson C,Wennström P,Gry J.Tema Nord,2003,531.
[3] Griffin W J.Pharmacy International,1985,6:305.
[4] Halim A F,Collins R P,Berigari M S.Planta Medica,1971,20:44.
[5] Saitoh F,Noma M,Kawashima N.Phytochemistry,1985,24(3):477.
[6] Bindler G,Van H R,Gunduz I.Theoretical and Applied Genetics,2007,114(2):341.
[7] Williams J G,Kubelic A R,Livak K J,et al.Nucleic Acids Research,1990,18:6513.
[8] LIU B Z.Multidimensional Gas Chromatography/mass Spectrometry Analysis of the Chiral Composition of Alkaloids in Tobacco and Cigarette Smoke.Hefei:University of Science and Technology of China(刘百战.烟草和卷烟烟气中生物碱手性组成的多维气相色谱/质谱分析.合肥:中国科学技术大学),2009:3.
[9] DING L,SHENG L Q,TONG H W,et al.Chinese Journal of Analytical Chemistry(丁丽,盛良全,童红武,等.分析化学),2004,32(09):1161.
[10] Wu W J,Ashley D L,Watson C H.Analytical Chemistry,2002,74:4878.
[11] SU M L.Study on the Composition and Migration of Alkaloids in Tobacco and Cigarettes.Zhengzhou:Zhengzhou Tobacco Research Institute of China National Tobacco Company(苏明亮.烟叶与卷烟中生物碱组成及其迁移规律研究.郑州:中国烟草总公司郑州烟草研究院),2004:10.
[12] Plade J J,Hoffmann D J.Liquid Chromatography,1980,3(10):1505.
[13] Saunders J A,Blume D E.Journal of Chromatography A,1981,205:147.
[14] Yang S S,Smetena I.Journal of Chromatographia,1995,40(7-8):375.
[15] Anastassiades M,Lehotay S J,Stajnbaher D,Schenck F J.Journal of AOAC International,2003,86(2):412.
[16] BS EN 15662:2008 Foods of Plant Origin-Determination of Pesticide Residues Using GC-MS and/or LC-MS/MS Following Acetonitrile Extraction/Partitioning and Clean-up by Dispersive SPE-QuEChERS.
[17] Castro A,Monji N.Biomedical Research,1986,2:91.
[18] Sheen S J.Journal of Food Science,1988,53:1572.
[19] Davis R A,Stiles M F,Debethizy J D,Reynolds J H.Food and Chemical Toxicology,199129:821.
