微小RNA在糖尿病肾病发生发展中的作用
2018-05-05胡奕芳综述刘章锁审校
胡奕芳 郭 佳 综述 刘章锁 审校
糖尿病肾病(DN)是糖尿病主要的微血管并发症,在2015年,我国糖尿病相关的慢性肾脏病患者占总住院人口的1.10%,超过了原发性肾小球肾炎相关的慢性肾脏病患者(0.75%),成为我国慢性肾脏病的主要病因之一[1]。在西方国家,DN是导致终末期肾病(ESRD)的首要因素。随着糖尿病发病率的剧增,DN导致的个人及社会经济负担十分沉重。但是,目前尚缺乏有效的早期诊断及治疗手段,深入了解DN的发病机制,寻找新的诊断及治疗靶点至关重要。
DN的发病机制是多因素的,在高糖环境下,多种糖依赖途径被激活,包括氧化应激、肾脏多元醇的形成及晚期糖化终产物的累积等,通过血流动力学因子、代谢因子及炎症因子等,激活下游多种分子信号途径[2]。微小RNA(microRNA,miRNA)是一类普遍存在的内源性非编码小分子RNA,长度约21~24个核苷酸,通过结合目的mRNA 3’端非编码区(3’-UTR),阻滞蛋白翻译或者诱导mRNA裂解,起到转录后调控基因表达的作用[3]。1/3基因受miRNA调控[2]。miRNA在正常细胞的发展和代谢的重要性近些年才得以证实,其表达异常与一些重要的临床疾病密切相关,从心肌梗死到肿瘤,以及DN等[4],是近年来研究的热点。本文将结合miRNA在DN中的最新研究成果,简述其在DN发生发展进程中的作用,阐明miRNA作为DN诊断及治疗靶向的前景,为后续研究拓展思路。
miRNA的生物合成
miRNA由基因组中某个基因座位作为独立的非编码基因,或者包含在编码蛋白的内含子中转录。经典的合成途径是在核内被RNA聚合酶II转录为长链的原始miRNA,称为pri-miRNA。pri-miRNA具有特殊的发夹结构,长短不一,可达几千个碱基对。在RNA酶Ⅲ家族成员Drosha及其辅助蛋白DGCR8参与下,pri-miRNA 成为大约70~100个核苷酸长度的miRNA前体,即pre-miRNA。pre-miRNA被Ran-GTP 依赖的双链RNA结合蛋白——输出蛋白 5(exportin 5)识别,从核内转运到细胞质,与RNA酶Ⅲ家族另一成员Dicer结合,被裂解为一个成熟的22个核苷酸的miRNA与miRNA*组成的双链体,来自该双链的成熟的miRNA掺入RNA诱导沉默复合物(RNA Induced silencing complex,RISC)发挥作用,miRNA*则被降解[3,5]。
在经典途径以外,Ruby等[5]在果蝇和线虫中验证了另一种miRNA生物合成的途径,在这一旁路途径中某些内含子模仿pre-miRNA的结构特点,进入没有Drosha介导的miRNA加工途径,并将这些内含子称之为“mirtrons”。除mirtrons外,人类simtrons等不依赖经典途径中某些复合体的非经典途径逐渐被发现并证实[6]。
miRNA参与DN的发病机制
肾脏病理生理改变DN的肾脏病理学改变主要包括肾小球肥大、基膜增厚、细胞外基质堆积、系膜增生、足细胞损伤、巨噬细胞浸润、蛋白质渗透性增加等,最终导致蛋白尿、肾小球硬化等肾脏损伤。这一部分我们从肾组织纤维化、炎症反应和足细胞凋亡这三个主要的研究方向出发,总结miRNA在DN转归中的最新发现。
肾组织纤维化 肾组织纤维化在慢性肾脏病导致ESRD中起主导作用,阻断纤维化的进展是现今控制DN生发展的重要环节。
高糖能够诱导miR-27a的高表达,并通过结合过氧化物酶体增殖激活受体γ(PPARγ)mRNA的3’-UTR,直接抑制PPARγ的表达,从而减少了PPARγ对纤维化的抑制作用,加快纤维化进程[7]。McClelland等[8]在糖尿病小鼠及DN患者肾脏中发现miR-21表达上调,且在病情进展快的和纤维化程度高的DN患者肾穿刺活检组织中miR-21的表达上调更为显著。在阻断近端肾小管上皮细胞(PTCs)SMAD3和Akt通路的情况下,转化生长因子β1( TGF-β1)和miR-21处理条件下的PTCs胶原蛋白等表达减少, 说明miR-21参与了TGF-β1介导的SMAD3和Akt信号通路对胶原蛋白及纤维连接蛋白等促硬化作用的调控。
上皮间质转化(EMT)在纤维化的发生发展过程中具有重要作用,是指上皮细胞在特定的生理或病理条件下转化为具有高迁移性和侵袭性的间质细胞状态。
我们的研究发现,在高糖诱导的小鼠足细胞中,EMT的发生发展依赖于糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK3β)的活动及磷酸化,而在此过程中,miR-346通过抑制GSK3β的合成,抑制EMT[9]。Bai等[10]发现miR-130b在DN患者肾穿刺活检组织中表达减少,miR-130b在大鼠肾小管上皮细胞(NRK-52E细胞)中通过抑制snail表达减轻EMT介导的纤维化。miR-23b在高糖诱导的人类PTCs和db/db小鼠肾组织中表达也降低,其直接作用于高迁移率蛋白A(HMGA)来抑制磷脂酰肌醇3激酶(PI3K)-Akt信号途径的激活,从而抑制高糖诱导下DN中的EMT[11]。
炎症反应 炎症机制在DN的发病机制中处于中心地位,其在DN中的作用解释了代谢及血流动力学的异常如何转化为了肾脏功能及组织结构的损伤,其中包含了复杂的分子网络,包括炎症细胞、促炎因子、趋化因子及其受体和转化因子等[12]。
在已有的报道中,miR-217在高糖培养的大鼠肾小球系膜细胞中通过沉默信息调节因子2相关酶类1(Sirt1)/缺氧诱导因子1α(HIF-1α)信号途径促进炎症及纤维化进程[13];miR-451能够通过抑制大多功能蛋白酶7(LMP7)/核因子κB(NF-κB)活动,从而下调促炎因子的表达,其表达增多还可减少db/db糖尿病小鼠微量白蛋白的排泄,降低血糖水平及肾小球损伤[14]。
而miR-146a却具有抗炎及保护肾脏的独特作用。miR-146a在STZ诱导的早期糖尿病小鼠肾脏及腹膜巨噬细胞中显著高表达。miR-146a基因敲除的糖尿病小鼠白细胞介素1b(IL-1b)、MCP-1、CD11b等促炎因子表达增加,足细胞相关蛋白nephrin表达减少,肾脏巨噬细胞浸润,抗炎型巨噬细胞表型(M2)与促炎型巨噬细胞表型(M1)比值减少,肾小球肥大,尿蛋白增多。miR-146a缺乏导致白介素1受体相关激酶1(Interleukin 1 receptor associated kinase 1,Irak1)和肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,Traf6)表达增加,激活下游NF-κB和Toll样受体(TLR)介导的信号传导通路,参与DN的进展过程中的促炎作用[15]。该研究中还发现,STZ诱导的1型糖尿病小鼠建模16周时miR-146a的表达水平低于建模7周时,暗示着miR-146a随着DN进展,其保护作用是逐渐降低的,这就与Lee等[16]发现的T2DN患者及糖尿病小鼠模型中miR-146a表达水平降低相一致。
足细胞凋亡 足细胞是肾小球血液滤过屏障的重要组成部分,DN患者早期就表现出肾小球足细胞数目及其密度的减少,并随着病变进展愈发明显,是DN发生发展的重要标志,足细胞病变不仅导致大量蛋白尿,而且还与肾小球硬化和肾功能损伤密切相关。
miR-218在高糖处理的足细胞中表达增加,通过直接下调血红素氧合酶1(HO-1)及促进p38丝裂原活化蛋白激酶(p38-MAPK)的激活引发足细胞凋亡[17]。Liu等[18]发现高糖处理的足细胞中miR-34c的表达减少,其对Notch1/Jagged1信号通路的直接调节作用除了介导肾脏细胞的EMT外,miR-34c的过表达能够通过抑制Notch1/Jaggged1信号途径,遏制高糖诱导下足细胞的凋亡。除此以外,Liu等[19]发现异黏蛋白(MTDH)可加强p38-MAPK介导的足细胞凋亡,荧光素酶报告分析显示miR-30家族为其上游直接调控者,miR-30家族通过减少MTDH的表达,起到抑制高糖诱导下足细胞凋亡的作用。
miRNA通过多种信号途径介导了DN的发生发展,糖尿病环境下其表达水平及功能各异。如前文所述,miR-27a、miR-21、miR-217等miRNA在高糖环境下表达上调,促进了DN的肾脏损害;而miR-130b、miR-146a等随病情进展表达下调,过表达这部分miRNA则会起到保护肾脏的作用。这些miRNA就很有可能成为潜在的生物标志物及治疗靶点。
miRNA的单核苷酸多态性与DN 遗传因素在糖尿病及DN的发生发展中有着举足轻重的地位。miRNA基因中的单核苷酸多态性会影响成熟miRNA的表达水平及对靶mRNA的选择,进而干扰miRNA的正常功能,在一定程度上影响了DN的遗传易感性。
let-7a-2基因调控区rs1143770的出现与DN的发生密切相关[20]。Li等[21]募集282例DN患者及312例糖尿病不伴肾病患者,结果显示,存在于pre-miR-125a基因中rs12976445的出现在DN患者及糖尿病不伴肾病患者中存在明显差异(OR 1.45,95%CI 1.02~2.08,P<0.05),miR-125a在DN患者中的表达下调在一定程度上归因于rs12976445基因多态性的出现。最近Kaidonis等[22]研究发现,miR-146a中的rs2910164与1型糖尿病组中DN有显著关联(OR 1.93,95%CI 1.23~3.03,P=0.004),而与2型糖尿病组中DN的关联不具统计学意义(OR 1.05,95%CI 0.83~1.32,P=0.691)。
DN中miRNA表观遗传修饰另一层面上,在DNA描绘的遗传背景下,不改变基因序列的表观遗传调节造成的染色质的修饰也有微小RNA的参与。
研究发现,2型糖尿病患者miR-375启动子高甲基化可能参与miR-375表达调节和2型糖尿病的发病机制[23]。Peng等[24]通过研究发现let-7a成员中仅let-7a-3的启动子调节区域包含CpG岛,DN患者中let-7a-3表达下调,启动子区域甲基化水平升高,作用于泛素样含PHD和环指域1及DNA甲基转移酶1,参与DN的自然进程。小管细胞中miR-184表达水平受DNA去甲基化及组蛋白赖氨酸乙酰化的表观调节,白蛋白超负荷能够促进组蛋白赖氨酸乙酰化水平,同时增加miR-184的启动子区域对NF-κB的亲和力,这些都导致miR-184的表达上调[25]。上述研究均暗示检测及干预miRNA甲基化水平介导DN发生发展的可行性。
表观遗传修饰除了对miRNA本身表达水平的调节外,还可直接或者间接调节其他蛋白甲基化、乙酰化等过程。Siddiqi等[26]发现在高糖刺激的足细胞及糖尿病小鼠中,抑制miR-101可上调甲基化酶增强体(enhancer of zestehomolog 2,EZH2)的表达,减少内源性抗氧化抑制物硫氧还原蛋白结合蛋白(thioredoxin interacting protein,TxnIP),减轻氧化应激作用。高血糖还可以通过降低miR-29a的表达加强去乙酰酶(histone deacetylase,HDAC)的活动,使足细胞标记蛋白去乙酰化,导致肾功能损害;反之,HDAC4通过去乙酰化赖氨酸9的组蛋白H3(histone H3 at lysine 9,H3K9),降低miR-29a表达[27](表1)。
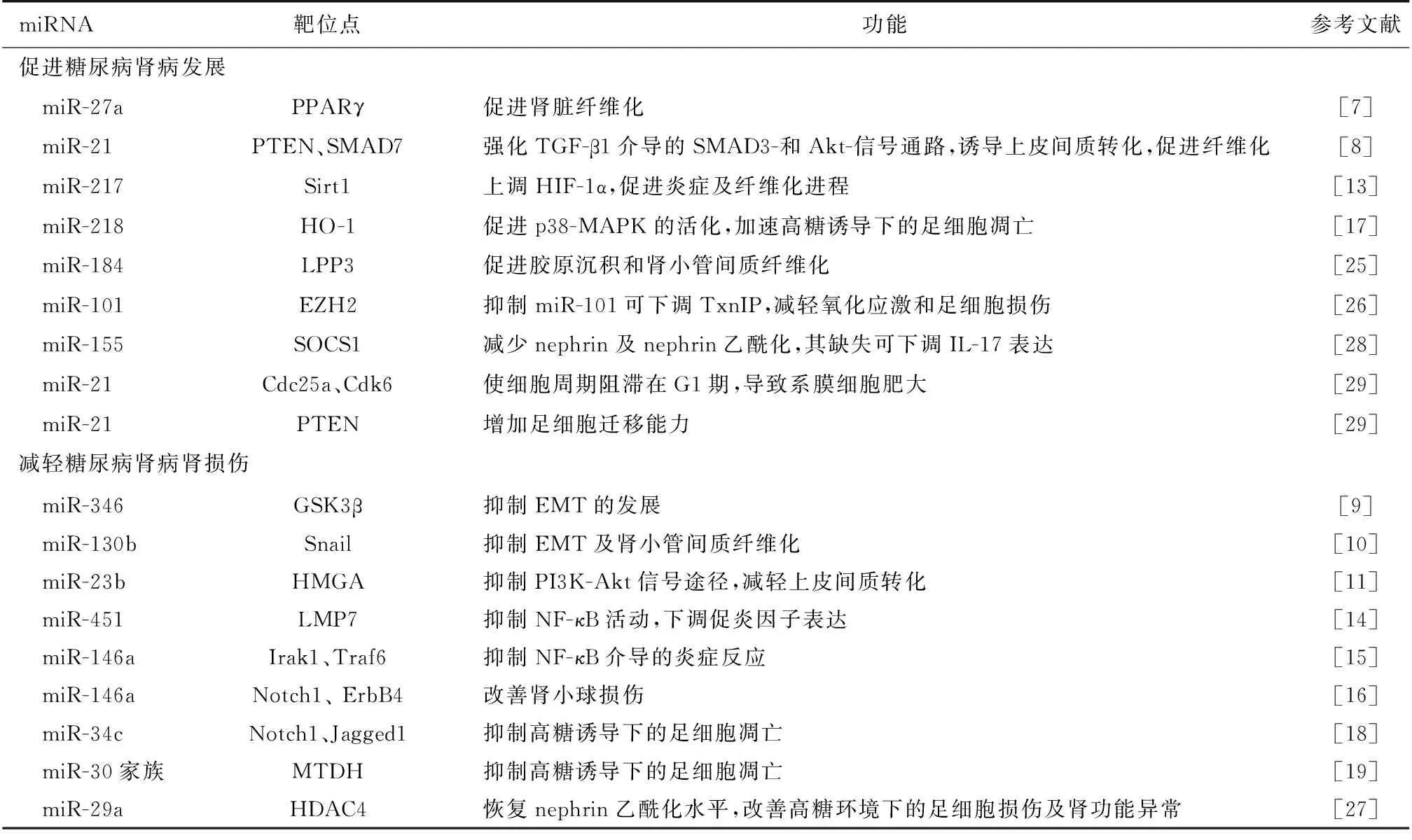
表1 微小RNA(miRNA)参与糖尿病肾病的发病机制
PPARγ:过氧化物酶体增殖激活受体γ;PTEN:磷酸酶及张力蛋白同源体;Sirt1: 沉默信息调节因子2相关酶类1; HIF-1α:缺氧诱导因子1α;HO-1: 血红素氧合酶1; p38-MAPK:p38丝裂原活化蛋白激酶;LPP3;磷酸酯磷酸酶3;SOCS1:细胞因子信号转导抑制剂;Cdc25a:细胞分裂周期蛋白25a;Cdk6:细胞周期蛋白依赖性激酶6;GSK3β:糖原合成酶激酶3β;HMGA:高迁移率蛋白A;PI3K:磷脂酰肌醇3激酶; LMP7:大多功能蛋白酶7; NF-κB:核因子κB;Irak1:白细胞介素1受体相关激酶1;Traf6:肿瘤坏死因子受体相关因子6;ErbB4:表皮生长因子4; MTDH:异黏蛋白; EZH2:甲基化酶增强体;TxnIP:硫氧还原蛋白结合蛋白;HDAC4:去乙酰酶4
循环miRNA与DN早期诊断
DN起病隐匿,进展缓慢,肾活检率低。非侵袭性检查可连续性监测DN的疾病进程,但是基于蛋白尿、糖尿病视网膜病变、糖尿病的罹病时间等对其的初步诊断存在局限性,很难区分是否为DN,导致错过早期正确干预肾脏疾病的最佳时机,亟待无创或半无创前提下早期更有效诊断DN的方法。
miRNA的可探测性和稳定性为其成为生物学检测新指标的可能提供了依据。miRNA在多种体液中均可测出,通过与体液中高分子复合物结合或者存在于外泌体中等方式,保持其高度稳定性。有报道将尿液置于例如高RNA酶、过高或过低pH、长时间室温储存或者反复冻融多达10次的极端条件下,miRNA水平保持稳定或者仅一定程度降解[30]。
外泌体是由多种细胞分泌的纳米级膜性小泡,运载mRNA、miRNA、蛋白质等参与细胞与细胞间的交流,为肾脏病的研究带来了极大的发展前景。近来一项包含156例T2DN患者的生物信息学及临床验证分析发现,尿液外泌体中miR-133b、miR-342和miR-30a在T2DN患者中表达水平相较于正常人显著增高(P<0.001),且与尿蛋白排泄率、血清肌酐及eGFR高度相关,探测DN敏感度及特异度较高[31]。miR-133b、miR-342和miR-30a在糖尿病肾病正常蛋白尿组(UACR<30 mg/g)的阳性检测率分别是39.3%、19.6% 和17.9% ,表明在这些患者中分子水平的改变要先于蛋白尿的发生,这组微小RNA在DN早期诊断、预后及治疗方面具有潜在价值。Mohan等[32]发现在糖尿病大鼠模型的尿外泌体中miR-451-5p、miR-16表达水平显著增高,早期尿蛋白量及肾小管纤维化指数、肾小球硬化指数均无明显变化时,尿外泌体中特别是miR-451-5p的表达上调已具有统计学意义,且可预示后期尿蛋白量的上升和肾组织病理学改变,具有监测DN进展的潜在价值。但miR-451-5p、miR-16在糖尿病大鼠肾脏组织中表达却是显著减少的,暗示其或许对肾脏组织起保护作用。从另一角度看,外泌体与肾组织中miRNA表达水平的不一致,为后续研究带来了新的思路。尿液外泌体在DN循环miRNA的研究中是一大热点。
但是,当前外泌体的研究存在很多局限性,包括外泌体的分离纯化、鉴别及其包含成分的定量和校正等存在争议,亟待新技术及新思路的突破。
与此同时,血清中miRNA的差异表达也颇受关注。欧洲一项纳入455例1型糖尿病患者的前瞻性研究发现,血清miR-126与1型糖尿病血管并发症呈负相关,尤其能降低增殖性肾脏疾病的风险[33]。Higuchi等[34]在糖尿病小鼠及T2DN患者血清中发现了miR-101、miR-375和miR-802等miRNA水平显著升高,与肾功能、糖化血红蛋白等指标密切相关,需进一步研究其机制及生物标记价值。T2DN患者血清中miR-130b表达水平明显降低,伴随着蛋白尿、空腹血糖、糖化血红蛋白、三酰甘油、血清肌酐等临床指标的相关改变[35]。
循环miRNA在DN患者中的研究仅限于发现问题阶段,其主要机制、干扰因素、表达水平处于何种范围内具有诊断及预测意义等尚无法得知,亟待进一步研究分析。
miRNA的研究前景
近年来,关于miRNA的研究逐渐增多,其在病理生理等方面的重要作用及主要机制逐渐被揭露。与DN相关的miRNA数目繁多,涉及的信号通路更是错综复杂,miRNA之间的内在联系有待明确。此外,miRNA在DN进展的不同时期其作用和表达水平存在动态性变化,表达谱具有组织特异性。
将miRNA的表达水平与临床指标相互关联对我们寻找新的诊疗靶点有很好的启示作用。已有报道中,研究者抑制或者上调miRNA的表达,或者作用于miRNA作用通路的任一环节,对DN的转归产生了显著影响,这提供了大量基于miRNA的精准治疗靶点。但是,组织的纤维化、炎症等病理生理改变参与很多疾病的发生发展,这就导致涉及这些过程的miRNA诊断及治疗疾病的特异度降低,有必要进一步研究筛查。
小结:miRNA在DN的发生发展中占据重要地位,其不仅能参与和促进疾病的进展,也能对肾脏起到保护作用,为进一步研究提供了新的依据,也为临床诊断、治疗及预后评估提供了新的生物标志物。不可否认,miRNA在DN中的研究及临床应用仍面临极大的挑战。
1 Zhang L,Long J,Jiang W,et al.Trends in Chronic Kidney Disease in China.N Engl J Med,2016,375(9):905-906.
2 Badal SS,Danesh FR.New insights into molecular mechanisms of diabetic kidney disease.Am J Kidney Dis,2014,63(2 Suppl 2):S63-83.
3 Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function.Cell,2004,116(2):281-297
4 Soifer HS,Rossi JJ,Saetrom P.MicroRNAs in disease and potential therapeutic applications.Mol Ther,2007,15(12):2070-2079.
5 Ruby JG,Jan CH,Bartel DP.Intronic microRNA precursors that bypass Drosha processing.Nature,2007,448(7149):83-86.
6 Havens MA,Reich AA,Duelli DM,et al.Biogenesis of mammalian microRNAs by a non-canonical processing pathway.Nucleic Acids Res,2012,40(10):4626-4640.
7 Hou X,Tian J,Geng J,et al.MicroRNA-27a promotes renal tubulointerstitial fibrosis via suppressing PPARγ pathway in diabetic nephropathy.Oncotarget,2016,7(30):47760-47776.
8 McClelland AD,Herman-Edelstein M,Komers R,et al.miR-21 promotes renal fibrosis in diabetic nephropathy by targeting PTEN and SMAD7.Clin Sci(Lond),2015,129(12):1237-1249.
9 Xiao J,Liu D,Jiao W,et al.Effects of microRNA-346 on epithelial-mesenchymal transition in mouse podocytes.Gene,2015,560(2):195-199.
10 Bai X,Geng J,Zhou Z,et al.MicroRNA-130b improves renal tubulointerstitial fibrosis via repression of Snail-induced epithelial-mesenchymal transition in diabetic nephropathy.Sci Rep,2016,6:20475.
11 Liu H,Wang X,Liu S,et al.Effects and mechanism of miR-23b on glucose-mediated epithelial-to-mesenchymal transition in diabetic nephropathy.Int J Biochem Cell Biol,2016,70:149-160.
12 Navarro-González JF,Mora-Fernández C,de Fuentes MM,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy.Nat Rev Nephrol,2011,7(6):327-340.
13 Shao Y,Lv C,Wu C,et al.Mir-217 promotes inflammation and fibrosis in high glucose cultured rat glomerular mesangial cells via Sirt1/HIF-1α signaling pathway.Diabetes Metab Res Rev,2016,32(6):534-543.
14 Sun Y,Peng R,Peng H,et al.miR-451 suppresses the NF-kappaB-mediated proinflammatory molecules expression through inhibiting LMP7 in diabetic nephropathy.Mol Cell Endocrinol,2016,433:75-86.
15 Bhatt K,Lanting LL,Jia Y,et al.Anti-Inflammatory Role of MicroRNA-146a in the Pathogenesis of Diabetic Nephropathy.J Am Soc Nephrol,2016,27(8):2277-2288.
16 Lee HW,Khan SQ,Khaliqdina S,et al.Absence of miR-146a in Podocytes Increases Risk of Diabetic Glomerulopathy via Up-regulation of ErbB4 and Notch-1.J Biol Chem,2017,292(2):732-747.
17 Yang H,Wang Q,Li S.MicroRNA-218 promotes high glucose-induced apoptosis in podocytes by targeting heme oxygenase-1.Biochem Biophys Res Commun,2016,471(4):582-588.
18 Liu XD,Zhang LY,Zhu TC,et al.Overexpression of miR-34c inhibits high glucose-induced apoptosis in podocytes by targeting Notch signaling pathways.Int J Clin Exp Pathol,2015,8(5):4525-4534.
19 Liu WT,Peng FF,Li HY,et al.Metadherin facilitates podocyte apoptosis in diabetic nephropathy.Cell Death Dis,2016,7(11):e2477.
20 Zhou J,Peng R,Li T,et al.A potentially functional polymorphism in the regulatory region of let-7a-2 is associated with an increased risk for diabetic nephropathy.Gene,2013,527(2):456-461.
21 Li C,Lei T.Rs12976445 Polymorphism is Associated with Risk of Diabetic Nephropathy Through Modulating Expression of MicroRNA-125 and Interleukin-6R.Med Sci Monit,2015,21:3490-3497.
22 Kaidonis G,Gillies MC,Abhary S,et al.A single-nucleotide polymorphism in the MicroRNA-146a gene is associated with diabetic nephropathy and sight-threatening diabetic retinopathy in Caucasian patients.Acta Diabetol,2016,53(4):643-650.
23 Sun K,Chang X,Yin L,et al.Expression and DNA methylation status of microRNA-375 in patients with type 2 diabetes mellitus.Mol Med Rep,2014,9(3):967-972.
24 Peng R,Liu H,Peng H,et al.Promoter hypermethylation of let-7a-3 is relevant to its down-expression in diabetic nephropathy by targeting UHRF1.Gene,2015,570(1):57-63.
25 Zanchi C,Macconi D,Trionfini P,et al.MicroRNA-184 is a downstream effector of albuminuria driving renal fibrosis in rats with diabetic nephropathy.Diabetologia,2017,60(6):1114-1125.
26 Siddiqi FS,Majumder S,Thai K,et al.The Histone Methyltransferase Enzyme Enhancer of Zeste Homolog 2 Protects against Podocyte Oxidative Stress and Renal Injury in Diabetes.J Am Soc Nephrol,2016,27(7):2021-2034.
27 Lin CL,Lee PH,Hsu YC,et al.MicroRNA-29a promotion of nephrin acetylation ameliorates hyperglycemia-induced podocyte dysfunction.J Am Soc Nephrol,2014,25(8):1698-1709.
28 Lin X,You Y,Wang J,et al.MicroRNA-155 deficiency promotes nephrin acetylation and attenuates renal damage in hyperglycemia-induced nephropathy.Inflammation,2015,38(2):546-554.
29 Kölling M,Kaucsar T,Schauerte C,et al.Therapeutic miR-21 Silencing Ameliorates Diabetic Kidney Disease in Mice.Mol Ther,2017,25(1):165-180.
30 Mlcochova H,Hezova R,Meli AC,et al.Urinary microRNAs as a new class of noninvasive biomarkers in oncology,nephrology,and cardiology.Methods Mol Biol,2015,1218:439-463.
31 Eissa S,Matboli M,Bekhet MM.Clinical verification of a novel urinary microRNA panal:133b,-342 and -30 as biomarkers for diabetic nephropathy identified by bioinformatics analysis.Biomed Pharmacother,2016,83:92-99.
32 Mohan A,Singh RS,Kumari M,et al.Urinary Exosomal microRNA-451-5p Is a Potential Early Biomarker of Diabetic Nephropathy in Rats.PLoS One,2016,11(4):e0154055.
33 Barutta F,Bruno G,Matullo G,et al.MicroRNA-126 and micro-/macrovascular complications of type 1 diabetes in the EURODIAB Prospective Complications Study.Acta Diabetol,2017,54(2):133-139.
34 Higuchi C,Nakatsuka A,Eguchi J,et al.Identification of circulating miR-101,miR-375 and miR-802 as biomarkers for type 2 diabetes.Metabolism,2015,64(4):489-497.
35 Lv C,Zhou YH,Wu C,et al.The changes in miR-130b levels in human serum and the correlation with the severity of diabetic nephropathy.Diabetes Metab Res Rev,2015,31(7):717-724.
