基于硝基还原酶/甲硝唑系统构建斑马鱼急性肾损伤模型
2018-05-05张利文朱小东秦卫松曾彩虹刘志红陈朝红
侯 庆 汪 玲 张利文 朱小东 秦卫松 曾彩虹 刘志红 陈朝红
斑马鱼前肾结构简单,胚胎透明,发育迅速,与哺乳动物肾脏高度同源和保守,是研究肾脏疾病的理想模型[1],包括急性肾损伤(AKI )[2]。AKI是临床上常见的一种综合征,表现为肾功能下降或丧失,肾小管上皮细胞脱落等。庆大霉素可诱导斑马鱼幼鱼和成鱼AKI[3],肾小管标志物slc20a1a表达会随之消失或减弱,损伤或丢失,肾小管重吸收功能下降或丧失;利用激光同样可选择性损伤斑马鱼肾小管,荧光染料或转基因鱼标记斑马鱼肾小管损伤程度。上述方法均需要通过心脏注射庆大霉素或者荧光染料,达到斑马鱼肾小管损伤或标记定位并使用激光消融损伤的目的,这两种方法操作繁琐、损伤时间和剂量不均一,且损伤数量有限,耗时耗力,不是理想的斑马鱼AKI模型,所以建立一个新的斑马鱼AKI模型很有必要。
本研究基于硝基还原酶/甲硝唑(NTR/MTZ)损伤原理[4],分别构建了转基因斑马鱼Tg(enpep:Gal4)和Tg(UAS:NTR-mCherry),在双转基因Tg(enpep:Gal4;UAS:NTR-mCherry)胚胎中使用MTZ 诱导肾小管上皮细胞损伤以模拟AKI。
材料和方法
实验对象野生型斑马鱼(AB品系),转基因斑马鱼Tg(enpep:Gal4)和Tg(UAS:NTR-mCherry),饲养系统(PENTAIR),饲养温度28.5℃,14h/10h交替照明。斑马鱼胚胎在28.5℃培养箱中饲养。实验过程中对动物的处置符合南京总医院动物伦理学标准。
主要试剂BSA、DIG RNA Labeling Mix、AP-anti-DIG antibody、NBT/NCIP ready-to-use tablets(Roche),MAXIscript T7 Kit、mMESSAGE mMACHINE T3 Kit、MEGAclear Kit(Ambion),DNA clean and concentrator、RNA clean and concentrator、plasmid miniprep kit、RNA miniprep Kit(ZYMO Research),Trizol(Invitrogen),10KD FITC-Dextran(Molecular Probe),反转录试剂盒(Thermo Fisher),tricaine、MTZ、多聚甲醛、Tween-20、蛋白酶K、20×SSC、、tRNA、(SIGMA),(Jackson Immuno Research),去离子甲酰胺(Amresco),pEASY-T5 Zero cloning kit、DH5α感受态细胞、2×SuperMix Taq PCR酶(Transgene),Phusion高保证PCR酶、限制性内切酶(NEB)。
转基因斑马鱼质粒enpep启动子序列[5]通过PCR从斑马鱼基因组中扩增所得,克隆入pTol2-podocin:Gal4质粒中将podocin启动子替换(双酶切位点为XhoI和BamHI),构建成pTol2-enpep:Gal4载体,并经测序验证序列。UAS:NTR-mCherry转基因鱼表达质粒由美国密西根大学Weibin Zhou惠赠[6]。
RNA体外合成和显微注射Capped Tol2转座酶mRNA体外转录模板是用限制性内切酶XbaI将pT3TS-tol2(Pdb600)线性化,纯化回收线性化质粒,作为模板,用mMESSAGE mMACHINE T3 kit体外转录成转座酶mRNA,用MEGAclear Kit回收体外转录的mRNA。将转座酶mRNA(25 ng/μl)和转基因鱼表达质粒(20 ng/μl)共同显微注射入野生型AB斑马鱼胚胎单细胞,置于胚胎培养水中,28.5℃培养箱饲养。通过基因分析PCR,逐代筛选F0和F1。
原位杂交探针合成斑马鱼slc20a1amRNA反义链探针模板通过PCR从斑马鱼cDNA模板扩增获取,克隆入pEASY-T5 Zero cloning载体,提取质粒后送测序鉴定。利用M13上下游引物扩增出slc20a1探针模板,纯化回收PCR产物,以PCR产物作为模板, MAXIscript T7 RNA转录酶体外转录slc20a1反义链RNA探针,60℃水解RNA探针至100nt,纯化回收水解后的反义链RNA探针。
全胚胎原位杂交斑马鱼胚胎固定于4%多聚甲醛4℃过夜,次日用无水甲醇清洗,置于-20℃脱水过夜后用于后续原位杂交。第一天:60%甲醇/PBS,30%甲醇/PBS依次水化标本,PBST(含0.1% Tween-20)清洗2次,PBST/蛋白酶K室温消化组织,4%多聚甲醛再固定标本,65℃预杂交(不含探针),65℃杂交过夜(含探针);第二天:65℃下,50%去离子甲酰胺/2×SSC清洗2次×30 min,2×SSCT清洗1次×15 min,0.2×SSCT清洗2次×30 min,PBST室温清洗1次×5 min,PBST-SB(5% sheep serum+2 mg/ml BSA)孵育2h以上,地高辛抗体4℃孵育过夜(用PBST-SB稀释4 000倍);第三天:PBST室温清洗5次×5 min,加入NBT/BCIP显色液避光显色。显色结束后,PBS清洗显色液,多聚甲醛再固定,封片,拍照。
肾小管重吸收功能用0.02% tricaine (sigma A5040) 麻醉MTZ处理48h后的胚胎,将麻醉后的胚胎置于1.5%琼脂糖显微注射模具中,20 ng/μl的 10KD FITC-Dextran经心脏注射,4h后在荧光显微镜下观察肾小管重吸收功能。
电镜斑马鱼胚胎于3.75%戊二醛固定,乙醇、丙酮脱水,丙酮、树脂置换和浸透,包埋和切片,透射电子显微镜下观察。
统计学方法应用SPSS 17.0统计软件进行数据分析。以上实验均重复3次,数据以均数±标准差表示。两组间比较采用Student’st检验进行分析。P<0.05为差异有统计学意义。
结 果
转基因鱼构建Huang等[7]利用MTZ/NTR系统构建了足细胞特异性损伤模型。在足细胞中特异性高表达硝基还原酶 ,利用MTZ对转基因鱼处理,本无毒性的MTZ被NTR还原为细胞毒性的代谢物,特异性致死表达NTR的足细胞,而对其他未表达NTR的细胞并无任何损伤。基于上述原理,我们分别构建了转基因鱼Tg(enpep:Gal4)和Tg(UAS:NTR-mCherry),将上述两种转基因鱼杂交后可获得双转基因鱼Tg(enpep:Gal4;UAS:NTR-mCherry),光显微镜下可观察到在斑马鱼肾小管特异性表达红色荧光mCherry(图1)

图1 转基因鱼Tg(enpep:Gal4;UAS:NTR-mCherry)在前肾小管中表达NTR-mCherryA:Tg(enpep:Gal4)和Tg(UAS:NTR-mCherry)转基因鱼载体模式图;NTR/MTZ损伤原理模式图,NTR和荧光蛋白(FP)融合蛋白在组织特异性启动子的驱动下表达,当加入MTZ时,NTR+细胞被,而毗邻NTR-细胞不受任何影响;B:酵母转录激活蛋白基因Gal4在肾小管enpep启动子的驱动下,NTR-mCherry融合基因在上游激活序列UAS启动子的驱动下,Gal4可以识别并激活UAS启动子序列,NTR-mCherry表达部位取决于enpep启动子。48hpf Tg(enpep:Gal4;UAS:NTR-mCherry),红色荧光表示肾小管(含近端小管,远端小管和集合管);NTR:硝基还原酶/甲硝唑
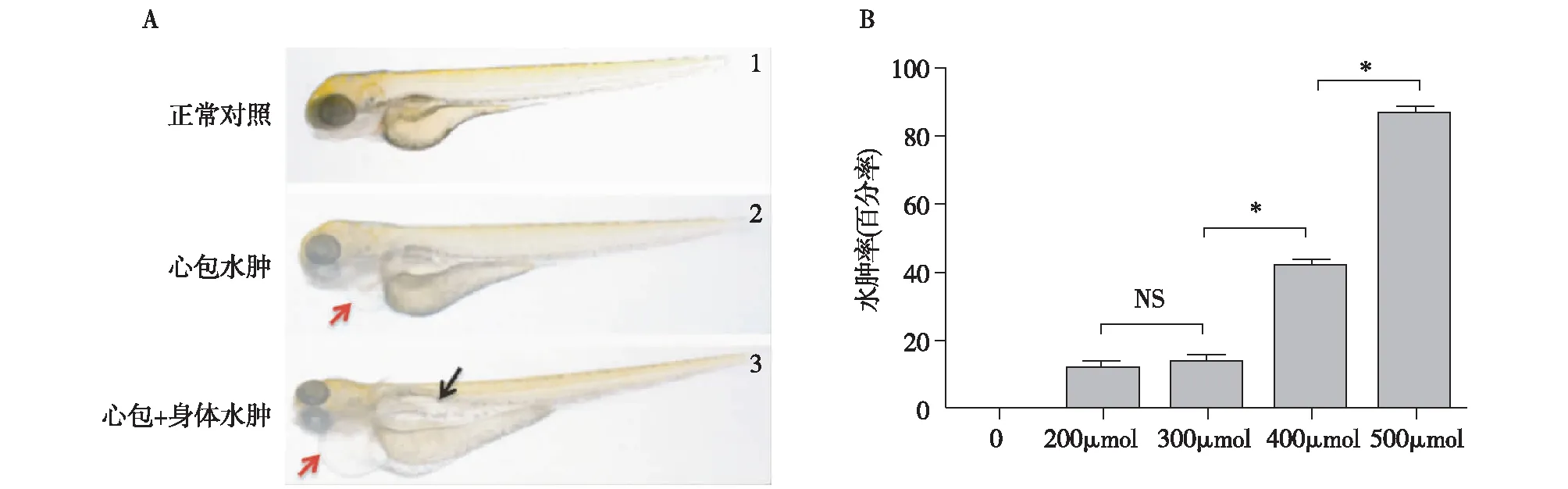
图2 甲哨唑(MTZ)诱导肾小管上皮细胞损伤A:MTZ诱导转基因幼鱼Tg(enpep:Gal4;UAS:NTR-mCherry)肾小管上皮细胞损伤后出现心包水肿(↑)和身体水肿(↑);B:MTZ诱导Tg(enpep:Gal4;UAS:NTR-mCherry)肾小管上皮细胞损伤,呈剂量依赖性。*:P<0.05
MTZ剂量依赖性的肾小管损伤斑马鱼前肾肾小管在28hpf(hours post fertilization,hpf)时发育成熟,具有重吸收功能。我们选择在48 hpf对Tg(enpep:Gal4;UAS:NTR-mCherry)胚胎加入MTZ,处理的剂量浓度依次为DMSO对照组、200 μmol/L、300 μmol/L、400 μmol/L、500 μmol/L,处理24h后撤除MTZ并实时观察,结果显示,在处理24h仅有高浓度500 μmol/L组出现轻微的心包水肿,48h 300 μmol/L和400 μmol/L组均出现明显心包水肿,500 μmol/L组心包水肿率明显增加且出现身体水肿(图2A)。随着MTZ的处理剂量的增加,胚胎的水肿率显著增加(依次为0、10%、15%、40%、85%)(图2B)。96h后,400 μmol/L和500 μmol/L组胚胎均死亡。为了观察后续药物处理对AKI损伤后修复的结果,我们选择500 μmol/L MTZ处理48h作为后续实验剂量和时间。
MTZ诱导肾小管损伤对slc20a1a表达的影响slc20a1a是斑马鱼近端小管的标志物,近端小管损伤会导致slc20a1a表达消失或下降[8]。MTZ诱导损伤24h,全胚胎原位杂交结果显示slc20a1a表达消失,表明近端肾小管损伤严重(图3)。电镜结果显示,MTZ诱导肾小管损伤后,近端小管上皮细胞丢失且损伤,正常细胞形态丧失,管腔扩大且管腔中可见急性脱落的刷状缘和微管结构(图4)。
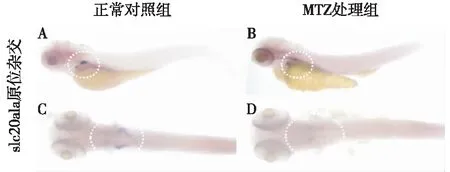
图3 斑马鱼全胚胎slc20a1a原位杂交A(侧面)和C(背面)为正常对照组slc20a1a mRNA表达情况,B(侧面)和D(背面)为甲硝唑(MTZ)处理组slc20a1a mRNA表达情况,白色虚线框内为slc20a1a原位杂交信号
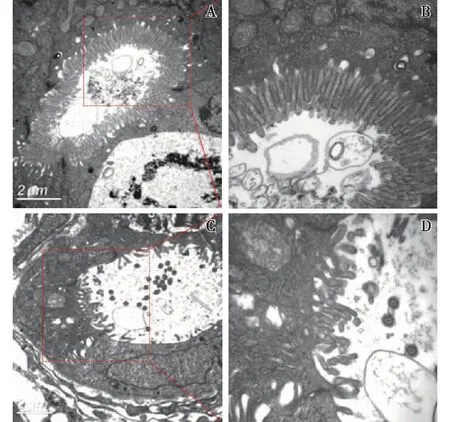
图4 甲硝唑(MTZ)诱导肾小管损伤(EM)A、B:正常对照组肾小管上皮细胞形态完整,管腔完好,刷状缘密集(图B为局部放大图);C、D:MTZ处理组肾小管上皮脱落,管腔扩大,刷状缘脱落至管腔中
MTZ诱导肾小管损伤导致肾小管重吸收功能丧失肾小管损伤会导致重吸收功能丧失或下降,为了检测MTZ诱导肾小管损伤是否能够导致肾小管重吸收功能丧失或下降,在MTZ诱导损伤后48h经过心脏显微注射低分子量的10 kD FITC-Dextran,4h后在荧光显微镜下观测近端小管绿色荧光表达强度。结果显示,未损伤组中胚胎近端小管绿色荧光高度聚集,而损伤组中未见明显绿色荧光,结果表明MTZ诱导肾小管损伤会导致肾小管重吸收功能丧失(图5)。
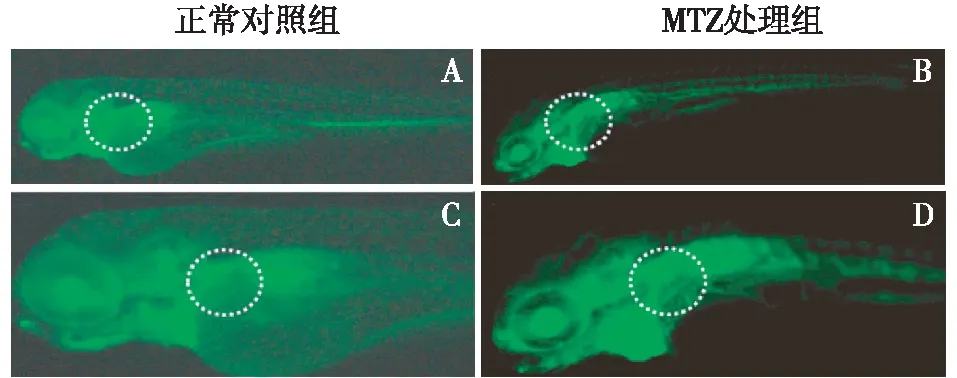
图5 近端小管重吸收功能评估A(5倍)和B(10倍)为正常对照组,C(5倍)和D(10倍)为甲哨唑(MTZ)处理组。正常对照组近端小管可见明显绿色荧光染料聚集(白色虚线框内),表明近端小管重吸收功能完好;而MTZ处理组未见明显绿色荧光染料聚焦,表明近端小管重吸收功能丧失
讨 论
AKI是常见的临床综合征,肾小管上皮细胞损伤和脱落,肾功能急剧下降,肾小管扩张且重吸收功能丧失[9]。本研究基于NTR/MTZ原理[4],构建了斑马鱼肾小管上皮细胞损伤模型以模拟AKI,结果显示MTZ可成功诱导斑马鱼近端小管上皮细胞特异性标志物slc20a1a表达降低;电镜结果显示近端小管上皮细胞损伤和脱落,管腔扩张,刷状缘脱落值管腔中;经心脏注射低分子量10 kD FITC-Dextran,发现近端小管重吸收功能丧失。其表型与人及动物实验表型相似,表明此斑马鱼AKI模型构建成功。
Hentschel等[10]建立的庆大霉素诱导斑马鱼AKI模型和Johnson等[3]建立的激光消融法斑马鱼AKI模型各有优势,然而操作相对繁琐,耗时耗力。庆大霉素诱导斑马鱼AKI模型需要通过72 hpf的斑马鱼胚胎心脏显微注射庆大霉素,既不能保证每个胚胎注射剂量的一致性,又不能避免庆大霉素的副作用;激光消融虽然可以选择性损伤部分近端小管保留大部分完好的肾单位,却也需要通过心脏注射荧光染料对近端小管进行标记,并且还需要单独对每个胚胎进行激光消融。
Huang等[7]利用MTZ/NTR系统构建了足细胞特异性损伤模型。在足细胞中特异性高表达NTR,利用MTZ对转基因鱼处理,本无毒性的MTZ被NTR还原为细胞毒性的代谢物,特异性致死表达NTR的足细胞,而对其他未表达NTR的细胞并无任何损伤。基于上述原理,我们构建了肾小管上皮细胞特异性损伤模型,该损伤模型只需要在胚胎中加入固定剂量的MTZ即可诱导损伤,既保证了每个胚胎损伤剂量和时间的一致性,同时还不会损伤肾小管上皮细胞以外的任何细胞,并且可以满足高通量小分子药物筛选的数量需求。
肾脏损伤分子1(KIM-1)是的早期分子标志物,其在急性和慢性肾损伤的和哺乳动物近端小管中高表达[11-12],近期发现在斑马鱼条件下,kim-1同样会在斑马鱼近端小管高表达。在斑马鱼肾小管中持续性高表达kim-1会导致刷状缘脱落,肾小球率过滤下降,心包水肿和逐渐升高的死亡率。kim-1导致的肾脏损伤与哺乳动物的西罗莫司靶分子(mTOR)信号通路激活相关,抑制mTOR信号通路可明显改善kim-1诱导的肾脏损伤和死亡率[13]。利用斑马鱼胚胎进行高通量小分子药物筛选发现,组蛋白去乙酰化酶抑制剂可明显增加斑马鱼肾脏祖细胞(progenitor cells)表达范围和细胞数量[14]。组蛋白去乙酰化酶抑制剂还可以促进斑马鱼后恢复[15],在小鼠缺血再损伤模型中同样也证实了组蛋白去乙酰化酶抑制剂可通过促进后再生和修复,在小鼠单侧输尿管结扎模型中发现组蛋白去乙酰化酶抑制剂还可以逆转肾脏纤维化[16]。上述研究表明,斑马鱼和哺乳动物之间的AKI分子机制,治疗靶点以及肾脏再生相似且保守。
综上所述,本研究基于NTR/MTZ原理成功建立了斑马鱼模型,可用于分子机制和肾脏再生研究,并有望用于寻找新的潜在治疗药物和靶点。
1 陈朝红,刘志红.模式动物斑马鱼在肾脏疾病研究中的应用.肾脏病与透析肾移植杂志,2016,25(2):159-163.
2 董建华,李世军.急性肾损伤修复与治疗干预.肾脏病与透析肾移植杂志,2017,26(3):268-272.
3 Johnson CS,Holzemer NF,Wingert RA.Laser ablation of the zebrafish pronephros to study renal epithelial regeneration.J Vis Exp,2011,(54).pii: 2845.
4 Curado S,Stainier DY,Anderson RM.Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies.Nat Protoc,2008,3(6):948-954.
5 Seiler C,Pack M.Transgenic labeling of the zebrafish pronephric duct and tubules using a promoter from the enpep gene.Gene Expr Patterns,2011,11(1-2):118-121.
6 Chen Z,Wan X,Hou Q,et al.GADD45B mediates podocyte injury in zebrafish by activating the ROS-GADD45B-p38 pathway.Cell Death Dis,2016,7:e2068.
7 Huang J,McKee M,Huang HD,et al.A zebrafish model of conditional targeted podocyte ablation and regeneration.Kidney Int,2013,83(6):1193-1200.
8 Diep CQ,Ma D,Deo RC,et al.Identification of adult nephron progenitors capable of kidney regeneration in zebrafish.Nature,2011,470(7332):95-100.
9 Thadhani R,Pascual M,Bonventre JV.Acute renal failure.N Engl J Med,1996,334(22):1448-1460.
10 Hentschel DM,Park KM,Cilenti L,et al.Acute renal failure in zebrafish: a novel system to study a complex disease.Am J Physiol Renal Physiol,2005,288(5):F923-929.
11 Ichimura T,Bonventre JV,Bailly V,et al.Kidney injury molecule-1 (KIM-1),a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain,is up-regulated in renal cells after injury.J Biol Chem,1998,273(7):4135-4142.
12 van Timmeren MM,Bakker SJ,Vaidya VS,et al.Tubular kidney injury molecule-1 in protein-overload nephropathy.Am J Physiol Renal Physiol,2006,291(2):F456-464.
13 Yin W,Naini SM,Chen G,et al.Mammalian Target of Rapamycin Mediates Kidney Injury Molecule 1-Dependent Tubule Injury in a Surrogate Model.J Am Soc Nephrol,2016,27(7):1943-1957.
14 de Groh ED,Swanhart LM,Cosentino CC,et al.Inhibition of histone deacetylase expands the renal progenitor cell population.J Am Soc Nephrol,2010,21(5):794-802.
15 Cianciolo CC,Skrypnyk NI,Brilli LL,et al.Histone deacetylase inhibitor enhances recovery after AKI.J Am Soc Nephrol,2013,24(6):943-953.
16 Pang M,Kothapally J,Mao H,et al.Inhibition of histone deacetylase activity attenuates renal fibroblast activation and interstitialfibrosis in obstructive nephropathy.Am J Physiol Renal Physiol,2009 Oct;297(4):F996-F1005.
