轻微型肝性脑病患者楔前叶VBM-MRI研究
2018-05-04周鹭郭大静周治明
周鹭, 郭大静, 周治明
轻微型肝性脑病(minimal hepatic encephalopathy,MHE)属于肝性脑病的一个亚型,临床上这类患者并不会表现出意识错乱、肝昏迷等明显的症状或者体征,通常仅表现为轻度注意力障碍、空间记忆减退、视觉感知运动功能及精细运动能力下降等相关神经认知方面的障碍,由于目前对于MHE的诊断没有金标准,国际共识推荐采用肝性脑病心理测试评分法(psychometric hepatic encephalopathy score,PHES)来筛查MHE[1],但是这些量表评估方法易受到被试者受教育程度、年龄等多种因素的影响,结果缺乏客观性。近年来,功能磁功能成像(functional magnetic resonance imaging,fMRI)研究发现,MHE患者楔前叶脑区神经元活动及脑功能连接异常存在异常,并且与其认知功能异常具有相关性[2-5]。因此,本研究将在我们既往对MHE全脑结构功能研究的基础上[6],采用更为精确配准的DARTEL算法[7],针对楔前叶亚区的灰白质体积进行精细观察,旨在精准分析MHE患者楔前叶亚区结构的变化情况。
材料与方法
1.研究对象
搜集2016年1月-2016年7月来我院就诊的15例MHE患者的临床和影像资料,其中男8例、女7例,年龄41~67岁,受教育年限6~16年。对临床诊断为乙型肝炎合并肝硬化的患者行数字连接试验(number connection test A,NCT-A)和数字符号试验(digit symbol test,DST),并将至少一项评分在正常组均值2个标准差以外的患者拟诊为MHE。所有测试均在进行MRI扫描前完成。排除标准:①严重HE患者;②急性肝功能衰竭患者;③酒精性肝硬化及任何其它可能导致脑功能改变的躯体或精神疾患的患者。
招募15例健康志愿者作为正常对照组,其中男8例、女7例,年龄40~70岁,受教育年限6~16年。对照组中受试者均无肝硬化、认知功能损伤和脑外伤等病史。
所有受试者无MRI检查禁忌证,对本研究的目的和方法知情同意。
2.图像采集和处理
采用Philips Achieva 3.0T MR扫描仪和8通道标准头线圈,采用磁化准备快速梯度回波(three dimensional magnetization prepared rapid gradient echo,3D-MPRAGE)序列T1WI进行矢状面扫描,扫描参数:TR 2000 ms,TE 30 ms,视野240 mm×240 mm,矩阵232×227,层厚1.0 mm,扫描层数150。
对所有采集的图像在Metlab的运行环境下采用DPARS fMRI(data processing assistant for resting-state fMRI)软件里的VBM-DARTEL分析方法进行后处理。DARTEL方法利用了6×106个参数的流场理论对图像进行配准,而之前的算法通常只采用了1000个参数进行配准,所以相较于之前的算法,DARTEL算法的配准更加精确[8]。具体操作处理流程如下[9]:①图像分割。首先应用VBM方法对原始的脑结构MR图像做统一化分割,得到具体的灰、白质图像。②配准。利用DARTEL算法进行配准,具体步骤则是将分割后的灰白质图像不断地平均,得到模板,重复进行配准和平均的过程,从而得到最优模板[10]。③利用Fan等[11]于2016年提出的最新脑网络图谱,根据图谱所提供的最大概率图,提取楔前叶4个亚区的模板,并将获得的亚区模板作用于配准的参数。④调制。将MNI空间进行标准化,并对配准后的亚区图像进行调制。⑤平滑。选定高斯平滑核对获得的亚区灰、白质图像进行处理;⑥统计分析。建立统计模型,对数据进行统计分析。
3.统计学分析
使用SPSS 19.0软件进行统计分析。采用χ2检验比较MHE组与对照组患者性别构成的差异,采用独立样本t检验比较患者的年龄、文化程度和神经心理测试结果间的差异,以P<0.05为差异有统计学意义。使用REST软件对MHE组及对照组中楔前叶及其亚区的体积进行两样本t检验,采用AlphaSim校正后P<0.05且体素阈值>54个为结果具有统计学意义,并将此体素叠加于三维T1WI上生成伪彩图。
结 果
1. 临床资料
两组被试的临床资料及统计分析结果见表1。两组间性别构成比、年龄及受教育年限的差异均无统计学意义。与对照组比较,MHE组DST量表评分明显降低,完成NCT-A的时间明显增加,组间差异均具有统计学意义(P<0.001)。
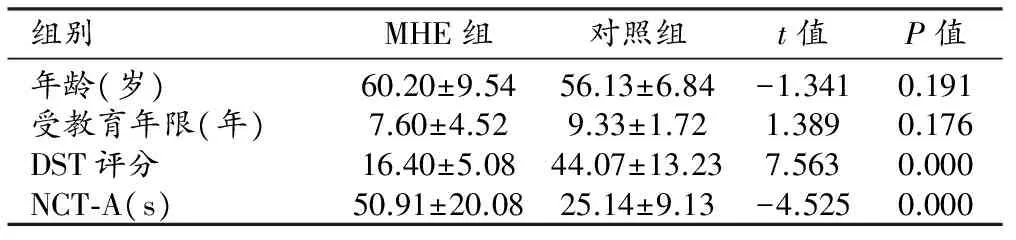
表1 MHE组和对照组临床资料及统计分析结果
2. MRI平扫表现
与对照组相比,MHE组平扫T1WI上双侧基底节区可见对称性高信号改变(图1)。
3. MHE组脑灰质改变
VBM分析结果显示,MHE组患者左侧楔前叶的灰质体积减少;就亚区而言,左侧4个亚区的灰质体积均以减少为主,同时伴有相应增加,其中前部和中央楔前叶的体积仅轻度减少、后部和腹侧楔前叶的体积明显减少;右侧楔前叶4个亚区灰质体积的变化规律与左侧基本一致,但体积减少的程度更加显著(图2、表2)。
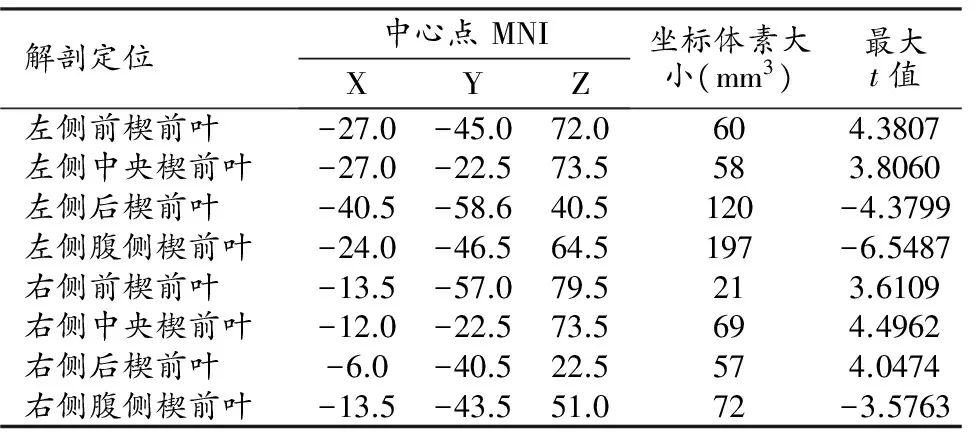
表2 MHE组与对照组楔前叶灰质体积有显著差异的脑区
注:与对照组相比,经AlphaSim校正后,取P<0.05、体素阈值>54。
4.MHE组脑白质改变
与对照组比较,MHE组患者左侧楔前叶白质体积增加;就亚区而言,左侧楔前叶4个亚区的白质体积以增加为主,同时伴有相应减少,但前部和中央楔前叶的体积仅轻度增加,后部和腹侧楔前叶的体积明显增加;右侧楔前叶4个亚区的白质体积增加程度均较左侧明显(图3、表3)。
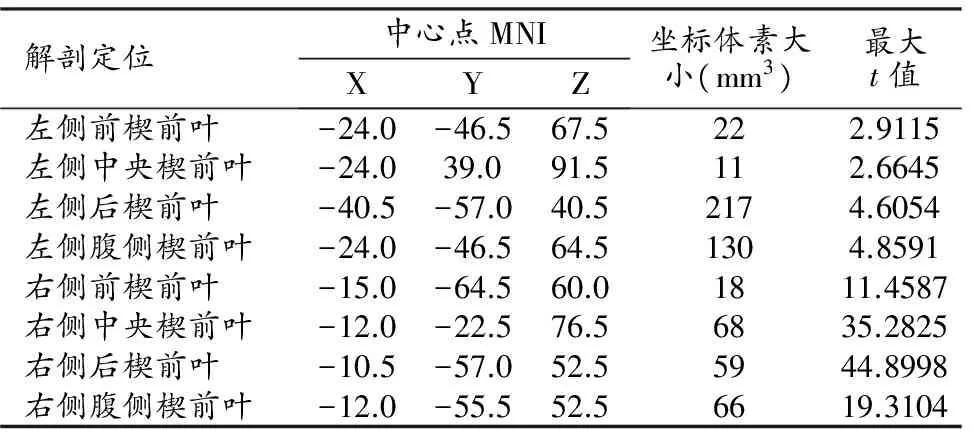
表3 MHE组与对照组楔前叶白质体积有显著差异的脑区
注:与对照组相比,经AlphaSim校正后、取P<0.05,体素阈值>54个体素。
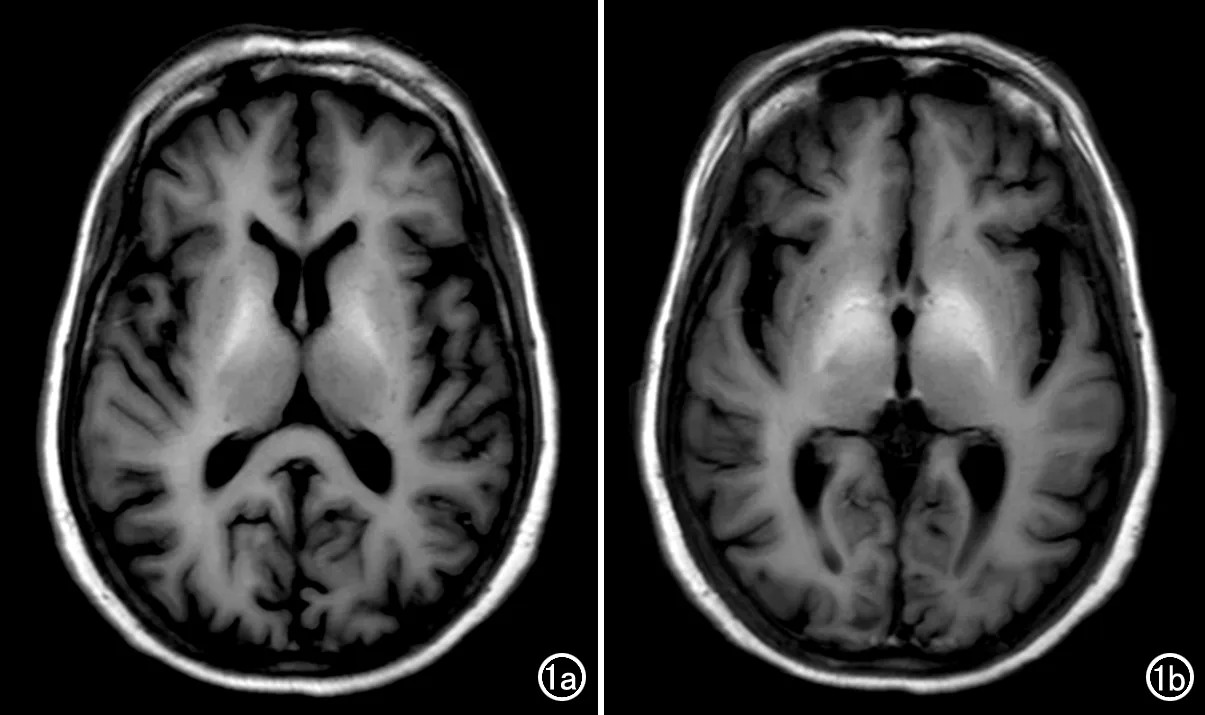
图1 MHE患者,男,50岁。T1WI显示双侧基底节区对称性高信号改变。a) 基底节层面; b) 丘脑层面。
楔前叶位于后内侧顶叶的背侧区,前方为中央旁小叶,后方为楔叶,下方为后扣带回和胼胝体压部,虽然所处位置较深,但是其与高级皮层及皮层下多个结构连接,且可能作为DMN中较为重要的节点,体现其功能的复杂性。具体而言,楔前叶与后扣带回、丘脑、中央前额叶皮层及海马等结构均有连接,由于所处位置较深,所以相关研究相对较少,但是它可能是大脑静息态默认网络的重要节点[12],参与多种功能(包括认知功能、视觉空间想象、情景记忆及自我信息)的相关调控和处理等。姜晓萍等[13]发现MHE和明显肝性脑病(overt hepatic encephalopathy,OHE)患者的脑默认网络低频振荡幅度(amplitude of low-frequency fluctuation,ALFF)值较正常组显著降低。既往的研究也显示MHE患者楔前叶的脑神经元活动、皮层厚度以及与其它脑区之间的功能连接可出现不同程度的改变[2-5]。因此,本研究中选取楔前叶作为研究对象,且进一步观察其各个亚区的体积变化特点。最近,Fan等[11]在研究脑网络图谱时,利用非侵入式多通道神经成像技术,包括结构MRI、fMRI及DWI,并设计了一种以功能连接为基础的分割框架来细分整个大脑,最后将整个大脑分成了210个皮层和36个皮层下的亚区,这为临床诊断和研究提供了新的方向。有学者提出,左右楔前叶可分为各4个亚区,包括前、中、后及腹侧楔前叶[8]。前楔前叶主要参与感觉运动,后楔前叶主要是视觉、情景记忆恢复的功能,中央楔前叶则是前、后楔前叶的桥梁,起到相关认知整合的作用,腹侧楔前叶则主要参与构成默认脑网络的核心,起到空间记忆的作用[14],它在整个楔前叶中发挥着重要作用。
1.MHE患者楔前叶亚区灰质体积变化的意义
本课题组已通过优化的VBM方法研究发现多个脑区存在灰质体积的减少,包括右侧小脑后叶、双侧豆状核、双侧壳核、双侧中央后回、右侧舌回、双侧颞中回、双侧海马、左侧小脑后叶、左侧苍白球、左侧前扣带回、左楔叶及左颞下回等[6]。而本研究通过VBM-DARTEL法进一步研究发现,MHE患者楔前叶整体灰质体积也是减少的,这与之前Zhang等[15]的研究结果是一致的。就亚区而言,前和中央楔前叶的主要功能为感觉运动及部分连接作用。MHE患者主要表现为精细运动及记忆认知障碍,本研究结果亦显示左侧前和中央楔前叶的灰质体积下降并不明显;而后楔前叶主要参与情景记忆,本组结果显示其灰质体积下降程度较前和中央楔前叶明显,结果与MHE患者的临床表现是一致的,表明MHE患者记忆功能障碍与中央楔前叶灰质体积下降有一定关系。腹侧楔前叶在整个楔前叶的功能中发挥着较为重要的作用,主要是参与构成脑默认神经网络,与后扣带回一起在脑默认神经网络中起到较为核心的作用[9],本研究结果显示MHE患者的腹侧楔前叶的灰质体积是明显下降的。之前Bai等的研究表明,有轻度遗忘及记忆障碍的患者,他们的静息态默认脑网络的功能连接以及楔前叶/后扣带回区域同质性会出现一定的衰减[16],且Chen等[17]还发现MHE组楔前叶的局部一致性(regional homogeneity,ReHo)值也是显著减低的,提示当这部分脑区受影响后,空间记忆能力会缺失以及认知功能会出现下降。神经病理学研究认为,氨、锰的聚集及神经炎症可引起神经细胞凋亡及不可逆损伤,而MHE脑灰质主要以星形胶质细胞Alzheimer II型变为特征[18],猜测灰质体积减少可能与上述机制有关,从而最终导致相应脑区功能减低的改变。
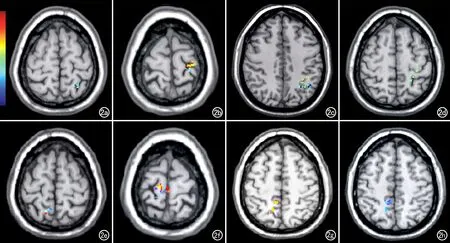
图2 VBM分析伪彩图,不同层面显示双侧侧楔前叶各亚区灰质体积较正常组差异有显著意义的区域(红黄色表示MHE组灰质增加区域,蓝绿色表示MHE组灰质减少区域)。a) 左侧楔前叶前亚区; b) 左侧楔前叶中央亚区; c) 左侧楔前叶后亚区; d) 左侧楔前叶腹侧亚区; e) 右侧楔前叶前亚区; f) 右侧楔前叶中央亚区; g) 右侧楔前叶后亚区; h) 右侧楔前叶腹侧亚区。
本课题组前期研究结果同时还发现双侧丘脑的灰质体积较正常组增加[6],而此次结果也显示楔前叶四个亚区的灰质体积出现相应增加,猜测可能与丘脑体积增加机制一样,与补偿效应有关,神经节或神经胶质出现代偿性病理性增生或肥大,但目前还无相关神经病理学证据来证实这一观点,增加的灰质体积也并不能改善大脑功能。且大脑皮质是具有功能及结构的可塑性的,如慢性脑卒中患者会出现躯体感觉区皮质增厚[19],所以猜测当出现了灰质体积的减少,可能所在区域其实都会出现不同程度神经节或神经胶质细胞的代偿性增生,这也许就是大脑皮质功能及结构可塑性的表现。
右侧楔前叶灰质变化与左侧并不完全相同,主要表现为体积减少程度更明显,这可能与左右脑功能分区不太一致有关。Zhang等[16]研究还发现,当轻型肝性脑病患者出现门体分流时,右侧楔前叶的下降程度较左侧更为明显,而本文结果显示,MHE患者没有出现门体分流时,右侧体积仍较左侧变化更明显,相关机制仍待继续探索。
2.MHE患者楔前叶亚区白质体积变化的意义
其实以往的研究多集中于脑灰质的变化,对脑白质的研究相对较少。Iwasa等[20]曾采用VBM法研究得出,脑白质体积与血氨水平之间存在一定的正相关,表明肝性脑病患者白质体积的改变,至少可能是由于血氨或部分炎性因子使星形胶质细胞功能发生障碍所导致的。本研究结果显示左侧前和中央楔前叶白质体积轻度增加,这两个亚区的主要功能为感觉运动及部分连接作用,这可能与MHE患者一部分运动下降有一定的关系。后楔前叶及腹侧楔前叶白质体积是明显增加的,当这部分区域由于血氨升高使星形胶质细胞受累后,会影响相应脑区的功能,包括情景记忆及空间记忆,所以轻微型肝性脑病患者会出现记忆障碍,同时在这四个亚区局部区域白质体积出现了减少。右侧楔前叶各亚区白质体积增加的程度相较于左侧更加明显,说明实验组患者大脑白质都可能受到了血氨的影响,星形胶质细胞的功能障碍,最终影响脑功能,从而主要表现出白质的增加。而皮质下白质的减少本身就会引起注意力及执行功能损害等认知障碍及姿势步态障碍。当出现脑代谢增加,对氧耗和血供的需求急剧增加,进而导致一系列病生改变,如神经元变性、水肿及细胞外间隙的增宽等等,这种脑组织长期反复的病理生理改变,最终会引起白质体积发生相应的变化,而内源性神经毒性物质,如锰,也会引起白质的改变。
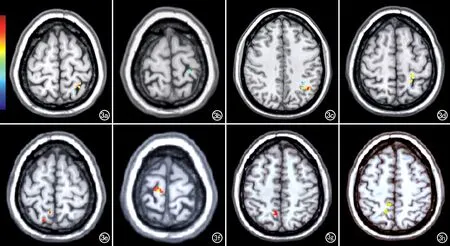
图3 VBM分析伪彩图,不同层面显示双侧侧楔前叶各亚区白质体积较正常组有显著差异的区域(红黄色表示MHE组灰质增加区域,蓝绿色表示MHE组白质减少区域)。a) 左侧楔前叶前亚区; b) 左侧楔前叶中央亚区; c) 左侧楔前叶后亚区; d) 左侧楔前叶腹侧亚区; e) 右侧楔前叶前亚区; f) 右侧楔前叶中央亚区; g) 右侧楔前叶后亚区; h) 右侧楔前叶腹侧亚区。
本研究尚存在不足之处,如能进一步扩大样本量,相信能获得更加准确的结果,能更好探究MHE患者的神经病理生理学机制。楔前叶作为默认脑网络中较为重要的脑区,当出现轻微型肝性脑病时,其四个亚区的灰白质均会出现不同程度的改变,这对早期诊断该病提供了较之前更加精确细致的诊断依据,随着对轻微型肝性脑病的研究越来越多,如果我们能同时结合多种磁共振检查方法,相信能更好地揭示神经性病变及其病理生理基础的变化,为该病的诊断提供更为可靠的依据。相信随着影像学技术的不断提高完善,对探讨轻微型肝性脑病及其他多种神经病变的神经病理学机制会起到非常关键的作用。
参考文献:
[1] Liere V,Sandhu G,De Morrow S.Recent advances in hepatic encephalopathy[J].F1000 Res,2017,4(6):1637-?.
[2] Chen HJ,Wang Y,Zhu XQ,et al.Classification of cirrhotic patients with or without minimal hepatic encephalopathy and healthy subjects using resting-state attention-related network analysis[J/OL].PLoS One,2014,9(3):e89684.DOI:10.1371/journal.pone.0089684.
[3] 郑罡,李强,张丽萍,等.肝性脑病患者基于静息态fMRI的全脑功能连接研究[J].放射学实践,2014,29(1):21-24.
[4] 周治明,赵建农,郭大静,等.功能磁共振观察基于非酒精性肝硬化的轻微型肝性脑病患者脑活动异常[J].中国医学影像技术,2014,30(1): 24-28.
[5] 周治明,赵建农,王康程,等.基于脑皮层厚度分析在肝性脑病结构改变的研究[J].临床放射学杂志,2017,36(2):171-175.
[6] 王晚千,赵建农,郭大静,等.利用VBM技术测量轻微型肝性脑病患者全脑灰质体积的变化[J].临床放射学杂志,2014,33(1):6-9.
[7] Ashburner J.A fast diffeomorphic image registration algorithm[J].Neuroimage,2007,38(1):95-113.
[8] Klein A,Andersson J,Ardekani BA,et al.Evaluation of 14 nonliear deformtion algorithmas applied to human brain MRI registration[J].Neuroimage,2009,46(3):786-802.
[9] Gönül AS,Demirel O,Kitis Ö,et al.The effects of the duration of formal education on adult brain:a voxel-based morphometry (diffeomorphic anatomical registration using exponentiated lie algebra) DARTEL study[J].Klin Psikofarmakol B,2009,19(3):221-226.
[10] Peraria JM,Xiong L,Acosta-Cabronero J,et al.Registration accuracy for VBM studies varies according to region and degenerative disease grouping[J].Neuroimage,2010,49(3):2205-2215.
[11] Fan L,Li H,Zhuo J,et al.The human hrainnetome atla:a new brain atlas based on connectional architecture[J].Cerebra Cortex,2016,26(8):3508-3526.
[12] Cunningham SI,Tomasi D,Volkow ND.Structural and func-tional connectivity of the precuneus and thalamus to the default mode network[J].Hum Brain Mapp,2017,38(2):938-956.
[13] 姜晓萍,钱伟伟,张莉,等.不同进展阶段肝性脑病患者大脑静息态功能和脑代谢研究[J].放射学实践,2017,32(7):696-700.
[14] Zhang Y,Fan L,Zhang Y,et al.Connectivity-based parcellation of the human posteromedial cortex[J].Cerebral Cortex,2014,24(3):19 727.
[15] Zhang LJ,Qi R,Zhong J,et al.The effect of hepatic encephalopathy,hepatic failure,and portosystemic shunt on brain volume of cirrhotic patients:a voxel-based morphometry study[J].PLos One,2012,7(8):e42824. DOI:10.1371/journal.pone.0042824.
[16] Bai F,Zhang Z,Yu H,et al.Default-mode network activity distinguishes amnestic type mild cognitive impairment from healthy aging:a combined structural and resting-state functional MRI study[J].Neurosci Lett,2008,438(1):111-115.
[17] Chen HJ,Zhu XQ,Yang M,et al.Changes in the regional homogeneity of resting-state brain activity in minimal hepatic encephaloathy[J].Neurosci Lett,2012,507(1):5-9.
[18] Aldridge DR,Tranah EJ,Shawcross DL.Pathogenesis of hepatic encephalopathy:role of ammonia and systemic inflammation[J].J Clin Exp Hepatol,2015,5(Supple 1):S7-S20.
[19] Schaechter JD,Moore CI,Connell BD,et al.Structural and functional plasticity in the somatosensory cortex of chronic stroke patients[J].Brain,2006,129(10):2722-2733.
[20] Iwasa M,Mifuji-Moroka R,Kuroda M,et al.Regional reduction in gray and white matter volume in brains of cirrhotic patients:voxel-based analysis of MRI[J].Metab Brain Dis,2012,27(4):551-557.
