阿尔茨海默病前扣带回亚区体积与认知损伤相关性
2020-09-09吴兴启田仰华
吴 越,吴兴启,汪 凯,2,田仰华,2
阿尔茨海默病(alzheimer's disease, AD) 是常见的神经系统退行性疾病[1],以多认知域损伤为主要特征[2-3]。患者发病后出现进行性认知功能下降,最终丧失生活能力,是痴呆的最常见原因之一[4]。前扣带回(anterior cingulate cortex, ACC)是信息处理和调节的重要节点[5],随着影像技术发展,将ACC进一步分为5个亚区,即尾状核(caudal aera)、背侧尾状核(caudodorsal area)、腹前(rostroventral area)、膝前扣带回(pregenual ACC)和膝下前扣带回(subgenual ACC) 5个亚区[6]。但在AD疾病的进程中,患者ACC不同亚区体积的变化是否与患者认知损伤有关,目前仍不明确,因此该研究拟通过计算每个ACC亚区平均体积,探究ACC亚区的结构改变与患者认知功能的关系。
1 材料与方法
1.1 病例资料选取2018年1月1日~2019年12月31日期间就诊于安徽医科大学第一附属医院神经内科门诊诊断为AD的患者,入组标准:① 所有患者均符合美国神经病学、言语障碍和卒中老年性痴呆和相关疾病学会(NINCDS-ADRDA) 诊断标准中的很可能诊断为AD者,符合诊断标准的核心表现[7];② 简明精神状态量表(mini mental state examination, MMSE)小于24分;③ 全面衰退量表(global degeneration scale, GDS) 范围3~6分。排除标准:① 药物滥用史;②其他神经精神疾患;③其他严重躯体疾患。共纳入患者45例。
健康对照组(healthy controls, HC)选取2017年9月~2018年7月在社区招募的健康志愿者40例。入组标准:① 无神经精神疾病史及家族史;② 右利手;③ 与患者性别、年龄相匹配。排除标准同患者组。本研究经安徽医科大学伦理委员会批准,患者本人及监护人知情并签署同意书。
1.2 神经心理学评估采用MMSE和GDS对所有被试者整体认知功能进行评估;同时采用日常生活能力评估量表(activity of daily living scale, ADL)对被试者的生活能力进行评估。
1.3 磁共振数据采集和分析
1.3.1数据采集 磁共振数据采集所有被试者T1 WI、T2 FLAIR和高分辨3D结构相。所有扫描均在安徽医科大学第一附属医院采用GE Signal 3.0 T MRI仪采集。扫描时要求被试者保持清醒、闭眼、保持不动。正式扫描前,采集T1加权成像及T2加权成像,排除明显器质性病变。所有被试者在检查前静坐休息30 min,向其解释检查过程,以保证其在检查过程中能够情绪平静,对检查高度合作,避免头部移动以保证图像质量。3D T1结构相磁共振采用三维快速自旋回波序列,具体参数如下:重复时间7.0 ms,回波时间2.9 ms,反转时间900 ms,视野(240 mm × 226 mm),矩阵(256×256),层厚1.2 mm。
1.3.2灰质体积计算 使用DPARSF软件包将磁共振结构像DICOM数据转换为NIFIT格式,采用SPM软件包对NIFIT文件进行组织识别及分割,生成每位被试者的灰质、白质、脑脊液密度概率图。将得到灰质图配准到标准空间,体素大小为1.5 mm×1.5 mm×1.5 mm,采用8 mm的半高全宽高斯平滑核将配准的图形进行空间平滑。双侧前扣带回亚区的蒙特利尔神经研究所标准空间坐标(montreal neurological institute, MNI坐标)位置见表1,亚区位置见图1。
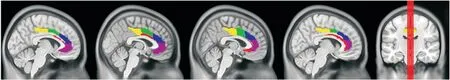
图1 各亚区位置图

表1 双侧前扣带回5个亚区在蒙特利尔神经研究所标准空间的位置
1.3.3ROI灰质体积提取 ROI分别定义为以双侧ACC的5个亚区,亚区模板来自人脑连接图谱[6],将模板予以重新采样后作为感兴趣区(region of interesting, ROI),利用DPABI提取ACC亚区的灰质体积(grey matter volume, GMV)。
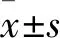
2 结果
2.1 人口统计学与背景资料统计结果患者组和健康对照组性别、年龄差异无统计学意义;患者组的MMSE、GDS评分低于健康对照组,差异有统计学意义,提示患者认知能力较健康组减弱;患者组的ADL评分高于健康对照组,差异有统计学意义,提示患者生活能力下降。见表2。
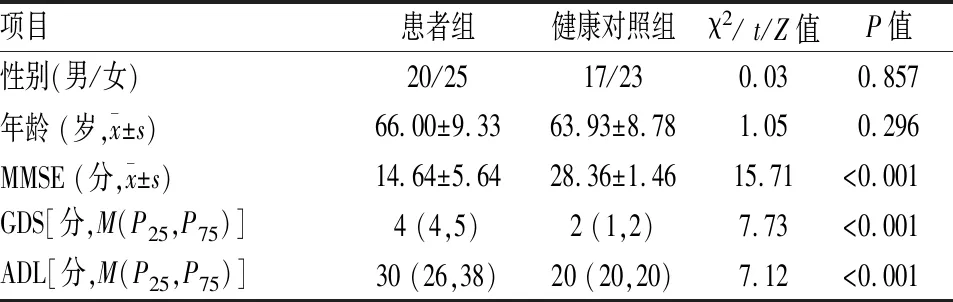
表2 人口统计学和背景资料
2.2 两组前扣带回亚区体积比较亚区体积分析采用2×10 (组别×亚区数)混合设计协方差分析。以组别(患者组和健康对照组)作为被试间自变量,以亚区(左右各5个亚区)为被试内自变量。组别和亚区存在交互效应 (F(2.8, 230)=11.21,P<0.001)。组别的主效应差异有统计学意义(F(1, 82)=26.57,P<0.001)。亚区间的主效应差异有统计学意义(F(2.8, 230)=16.47,P<0.001)。
进一步分析两组各亚区体积差异,结果显示双侧尾状核亚区体积患者组和健康对照组差异均有统计学意义; 双侧背侧尾状核亚区体积患者组和健康对照组差异均有统计学意义; 双侧腹前亚区体积患者组和健康对照组差异均有统计学意义; 双侧膝前扣带回亚区体积患者组和健康对照组差异均有统计学意义; 双侧膝下前扣带回亚区体积患者组和健康对照组差异均有统计学意义。具体结果见表3。
2.3 多元线性回归分析在患者组,将双侧ACC的亚区体积作为变量对MMSE进行多元线性回归,采用逐步法建立模型,右侧膝前扣带回体积进入回归方程,能解释MMSE得分变异的10.1%,F(1, 43)=4.85,P=0.033,右侧膝前扣带回体积对MMSE得分有正向预测作用(β=0.007,95%CI:0.001~0.014,t(43)=2.20,P=0.033)。对GDS量表进行多元线性回归,采用逐步法建立模型,结果显示右侧膝下前扣带回体积进入回归方程,能解释GDS得分变异的10.6%,F(1, 43)=5.11,P=0.029, 右侧膝下前扣带回体积(β=-0.001,95%CI:-0.002~0.000,t(43)=-2.26,P=0.029)对GDS得分有负向预测作用,患者该区体积萎缩越严重,全面衰退量表得分越高,整体认知能力越差。对ADL进行多元线性回归,采用逐步法建立模型,无变量进入回归模型。
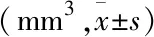
表3 两组ACC亚区灰质体积比较
3 讨论
本研究显示AD患者组双侧扣带回各亚区体积均减小,表明患者出现广泛的前扣带回萎缩,且本研究显示患者的整体认知能力较正常对照组明显下降。通过建立回归模型发现右侧膝前扣带回和膝下前扣带回体积萎缩对AD患者认知能力损伤密切相关,即患者该前扣带回亚区萎缩越严重,患者认知能力越差。
既往研究[8]提示AD患者较正常人相比前扣带回的体积萎缩明显,这与本研究结果一致。有血流灌注的队列研究[9]表明AD患者前扣带回的血流灌注明显小于正常对照,结合本研究结果,患者前扣带回体积的减少或与血流灌注不足有关,提示血管性因素是AD不可忽略的发病原因之一[10-11]。与既往研究相比,本研究对亚区体积进行分析表明,各个亚区在AD病程中皆有萎缩,提示前扣带回易受该病影响。
本研究还通过建立回归模型显示患者前扣带回不同亚区体积和MMSE以及GDS量表相关。患者膝前扣带回体积和MMSE得分关系密切,患者的膝前扣带回亚区体积萎缩越严重,其认知损伤越明显。既往研究[12]表明膝前扣带回是一个结构和功能复杂的区域,其功能和认知能力密切相关,由于该亚区受疾病影响,出现萎缩后进而影响亚区功能,从而引起患者认知能力的下降。本研究还表明患者膝下前扣带回亚区体积和GDS得分关系密切,该量表可反映整体认知功能。既往研究[13]表明膝下前扣带回不仅仅和社会功能密切相关,而且和一些其他重要的脑组织有密切的功能联系。因此膝下前扣带回体积的萎缩,除了导致亚区本身功能障碍,也可能引起其他脑区的功能异常,所以该亚区萎缩可能引起较为广泛的认知损伤,从而出现膝下前扣带回亚区的萎缩和整体认知功能下降密切相关的结果。脑深部刺激穹隆区是当前减缓AD患者认知损伤的干预方法[14],本研究表明膝前扣带回和膝下前扣带回亚区与患者认知损伤关系密切,且位置临近,提示二者结构与功能协同,有成为干预的特异性靶点的可能,本研究为未来治疗AD疾病干预靶点的选择提供理论基础。本研究未发现尾状核、背侧尾状核和腹前亚区体积和认知损害的关联性,可能的原因是该亚区有一定的功能储备[15],所以体积萎缩后并未对认知能力产生显著影响。
本研究着重分析ACC各个亚区体积变化以及各亚区与AD患者认知损伤的关系以及亚区体积和患者整体情况的关联,但是无法观察相关前扣带回亚区体积改变和临床评估结果改变的关系,后续可增加随访,进一步探究二者关系,并且在今后的研究中,可以加大样本量以及选取多中心的AD患者,并细分亚型以保证结果的可靠性,为以后AD的临床诊断、鉴别提供更可靠的影像证据。
