骨原发假肌源性(上皮样肉瘤样)血管内皮瘤的临床病理及影像学特征
2018-05-04衣利磊刘壮盛谢乐周守国张家雄王娟
衣利磊, 刘壮盛, 谢乐, 周守国, 张家雄, 王娟
假肌源性(上皮样肉瘤样)血管内皮瘤(pseu-domyogenic epithelioid sareoma-like haemangioendothelioma,PHE/ES-HE)是一类非常少见的血管源性肿瘤。ES-HE由Billings等[1]于2003年首次报道,PHE则由Hornick等[2]于2011年首次报道,WHO2013软组织肿瘤新分类中将二者合并为一类,即PHE/ES-HE,归属于中间型血管肿瘤[3]。PHE/ES-HE主要累及软组织,24%累及骨[2,4]。目前国内外文献共报道约80余例本病,但多为个案报道,而关于骨原发PHE/ES-HE的影像学表现方面的文献报道甚少。作者搜集6例骨原发PHE/ES-HE患者的临床病理及影像学资料,结合文献进行回顾性分析,旨在进一步提高对本病的认识。
材料与方法
1.病例资料
将2013-2017年在广州中医药大学附属佛山市中医院、中山大学附属江门医院经病理证实且有完整X线、CT和MRI资料的6例骨PHE/ES-HE患者纳入研究。记录和分析每例患者的临床和影像资料、组织病理学及免疫组化结果。
2.检查方法
6例患者均行X线、CT平扫、MR平扫和增强检查。X线检查使用Philips Digital Diagnost数字X线机。CT检查使用Philips Brilliance 64排CT机,扫描参数:120 kV,200 mA,矩阵512×512,层距5 mm,层厚5 mm,重建层厚1.25 mm。在工作站上对原始图像行多平面重组(muitiple pannner refomation,MPR)。MRI检查使用Siemens Avanto 1.5T MR扫描仪,扫描序列包括横轴面、冠状面和矢状面T1WI(TR 500 ms,TE 14 ms)、T2WI及T2WI加脂肪抑制(TR 4000 ms,TE 80 ms),层厚5 mm,矩阵256×256。常规平扫后经肘静脉注射Gd-DTPA,剂量0.1 mmol/kg,行脂肪抑制T1WI,扫描层厚5 mm,层间距0~3 mm。
3.影像分析
由2位有10年以上骨骼肌肉系统影像诊断经验的医师共同对图像进行观察和分析,记录病变的部位、形态、大小、边界、密度、信号、强化程度和方式、内部情况(有无骨嵴、囊变、坏死或钙化)、边缘情况(有无骨质硬化边,有无骨皮质破坏中断和周围软组织肿块)。当2位医师意见不一致时,请科室集体阅片,经讨论达成一致意见。
4.病理学检查
患者均行病灶手术刮除或切除,标本经福尔马林固定、8%盐酸甲酸脱钙和常规石蜡包埋切片及HE染色后进行光镜观察,并行免疫组化SP法染色标记FLi-1、CD31、FⅧα、AE1/AE3、Ki-67和CD34等。
结 果
6例患者的临床资料见表1。患者的平均年龄31.8岁,病程3个月~5年,无全身症状。
6例患者共发现31个骨骼病灶。3例为单发病灶,分别位于右髂骨、右股骨(图1)和右跟骨(图2);3例为多发病灶,分别位于右股骨和右胫骨(图3)、右胫腓骨以及右胫腓骨和右距骨。X线片显示所有病灶呈类圆形或不规则溶骨性骨质破坏,边界较清。CT显示骨质破坏区大小0.3~8.2 cm,可累及骨髓腔和骨皮质。MRI示所有病灶均有明显强化。3个单发病灶密度、信号不均,边缘骨质硬化,相邻骨皮质均破坏中断,周围形成较大软组织肿块,病灶内部均见残存骨嵴,1例可见囊变,1例可见钙化(图2b)。28个多发病灶中19个病灶的密度、信号均匀,9个密度、信号不均,15个边缘可见硬化边,病灶内部均无骨嵴、囊变或钙化,邻近骨皮质均无破坏中断,周围未见软组织肿块形成。
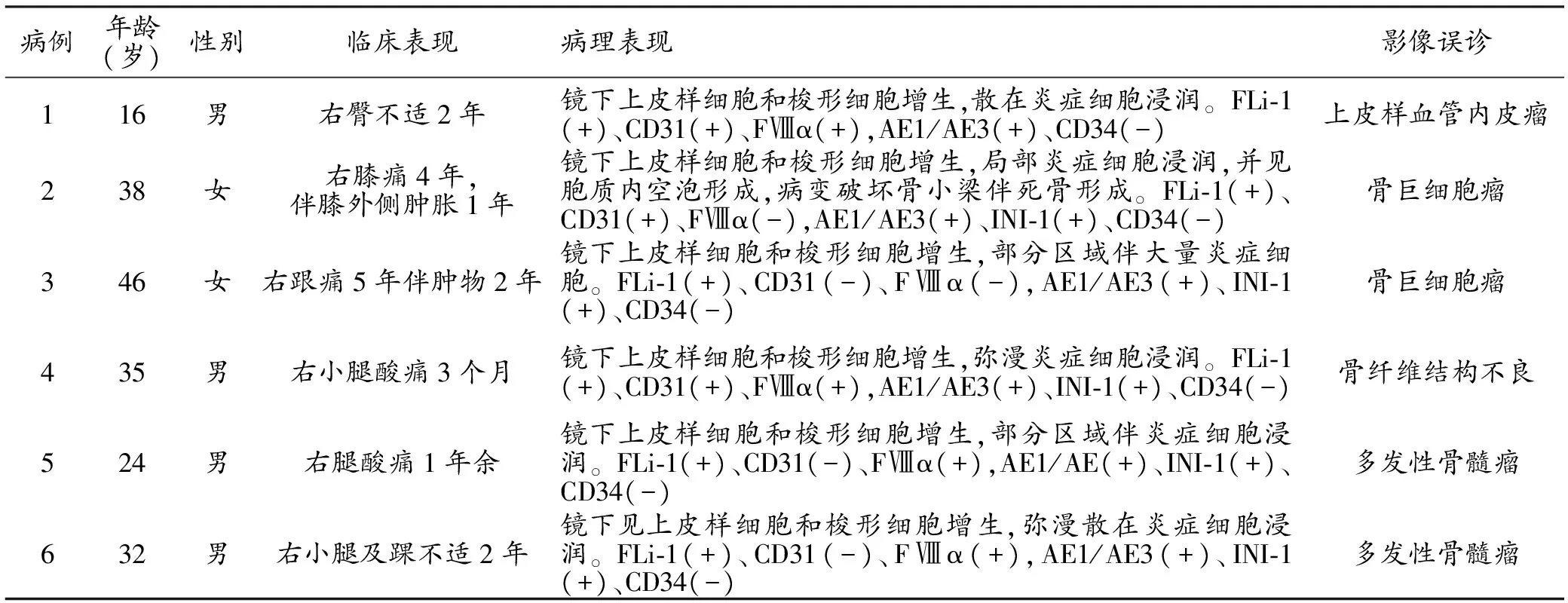
表1 6例PHE/ES-HE患者的的临床病理资料及影像诊断
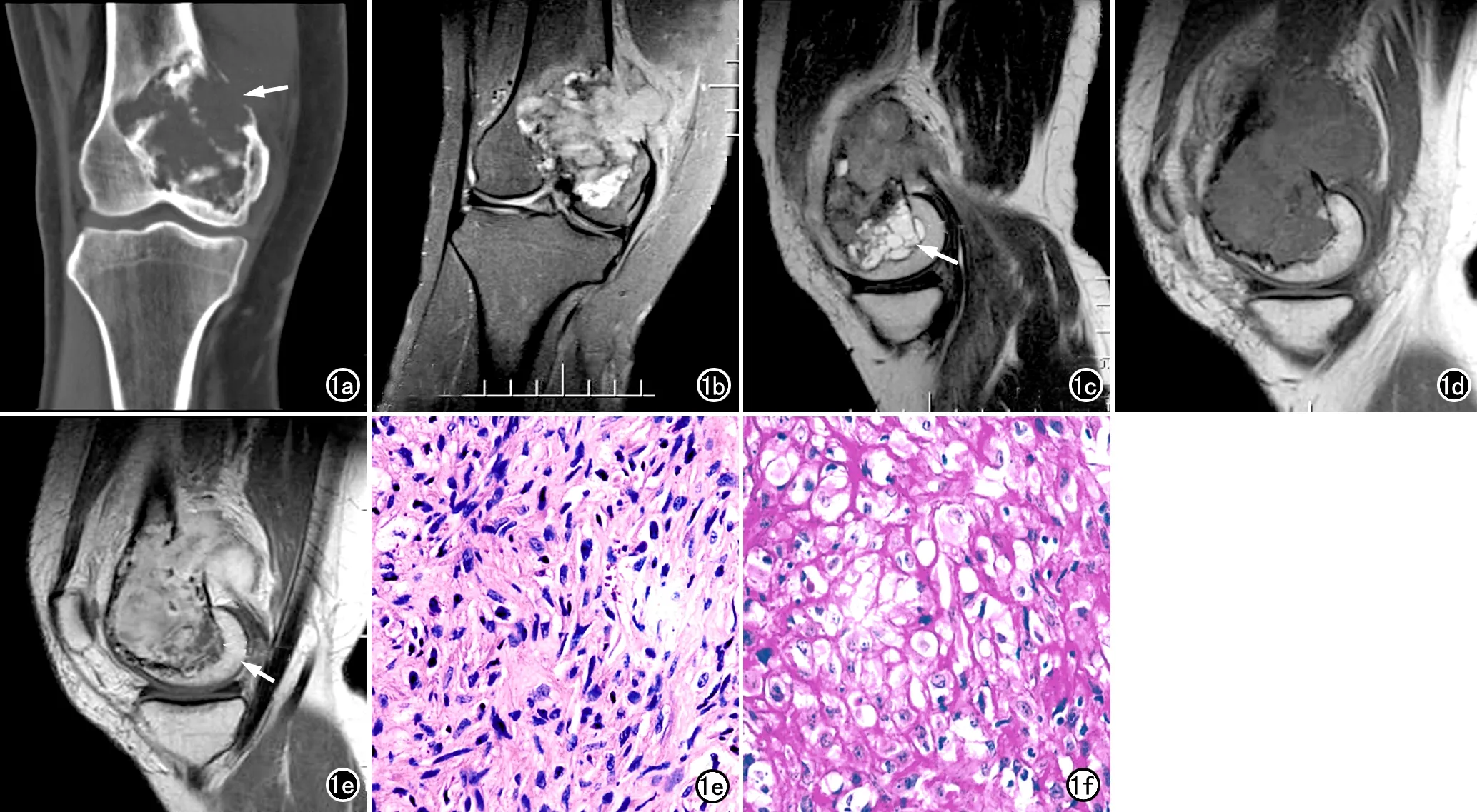
图1 女,38岁,右侧膝关节不适4年,疼痛加重伴肿胀半年。a) CT示右股骨下端关节面下溶骨性骨质破坏并多发残留骨嵴,边缘硬化,骨皮质中断(箭); b) 抑脂PDWI示右股骨下端病灶呈混杂高信号; c) T2WI示病灶大部分呈稍高信号,病灶下缘小部分呈多囊样明显高信号; d) T1WI示病灶呈等信号; e) T1WI增强扫描示病灶大部分呈不均匀明显强化,病灶下缘小部分呈囊壁样强化(箭),病变向后突破骨皮质形成软组织肿块; f) 镜下示瘤组织由交织状、席纹状排列的梭形细胞构成(×400,HE); g) 镜下示胞质内空泡形成,核空大,可见明显核仁,间质胶原丰富(×400,HE)。
6例患者术前影像学均误诊(表1),其中2例误诊为多发性骨髓瘤,2例误诊为骨巨细胞瘤,1例误诊为纤维结构不良,1例误诊为上皮样血管内皮瘤。
6例患者的病理组织学及免疫组化表现见表1。镜下可见结节状、条片状增生的卵圆形或圆形的上皮样细胞及梭形细胞,胞质丰富,嗜伊红色,未见血管腔隙形成,仅1例见少量胞质内空泡形成,间质内多见散在炎症细胞;免疫组织化学标记:FLi-1(+),CD31部分(+),FⅧα部分(+),AE1/AE3部分(+),Ki-67<20%(+),CD34(-)。
讨 论
PHE/ES-HE是血管内皮瘤的一种新亚型,属于临床少见的中间型血管肿瘤,约半数位于肌肉,约24%累及骨[2,5]。骨原发PHE/ES-HE生长相对缓慢,内脏或淋巴结转移少见,但易有局部复发和区域软组织转移;单发病灶多采用局部病灶扩大刮除或切除,合并软组织侵犯者多辅助化疗和/或放疗;多发病灶者,建议行局部广泛切除或根治性截肢术,并长期密切随访[5]。

跟骨病灶大部分呈欠均匀高信号(箭); d) T1WI示病灶呈等信号; e) T1WI增强扫描示病灶大部分呈明显强化,其中类圆形部分未见强化(箭); f) 抑脂T1WI增强扫描示病灶大部分呈明显强化,其中类圆形部分未见强化(箭),病变向前外形成软组织肿块并包绕腓骨长短肌腱; g) 镜下示瘤组织间质内以中性粒细胞为主的炎症细胞浸润(×200,HE)。
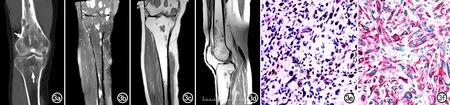
图3 男,35岁,右小腿酸痛9个月。a) CT线示右股骨及胫骨多发溶骨性骨质破坏,边界清楚伴硬化边(箭); b) 抑脂T2WI示右股骨及胫骨多发病灶呈高信号; c) T1WI示多发病灶呈等信号; d) T1WI增强扫描示右股骨及胫骨多发病灶均明显强化; e) 免疫组化示 FLI-1阳性(×400,SP); f) 免疫组化示AE1/AE3阳性(×400,SP)。
1.临床特点
综合分析文献已报道的骨原发PHE/ES-HE资料,此病好发于40岁以内男性,四肢常见,下肢多于上肢,累及部位包括胫骨、腓骨、股骨、跟骨、跖骨、胸椎、胸骨、肱骨和锁骨[3-13]。病史多为2~3年,短者1个月,长者达10余年。临床表现因病变部位而异,多表现相应部位不同程度的疼痛,无全身症状[5]。本组6例中除1例累及髂骨外,其余病变均位于下肢骨,临床表现为患处不同程度疼痛,病程3个月~5年,这些临床特点与Hornick等[2]的报道基本相符。Inyang等[7]报道的10例骨原发PHE/ES-HE均为多发病灶,而Hung等[11]报道的50例软组织及骨PHE/ES-HE中28例为单发,22例为多发。本组3例为单发,3例为多发,与Inyang等的报道不符,但与Hung等报道的男女比例基本相近。这可能与目前骨原发PHE/ES-HE的文献报道总例数较少,每组病例的样本数少,数据的偏倚比较大,这些数据尚无法反映单发与多发病灶的真实比例有关。
2.病理及细胞分子遗传学
PHE/ES-HE组织形态上兼有上皮样肉瘤和上皮样血管内皮瘤的部分特点,没有明确的血管分化证据,无明显的肿瘤性血管腔形成及出血改变。镜下见结节状、条片状增生的卵圆形或圆形的上皮样细胞及梭形细胞,胞质丰富,嗜伊红色,少部分肿瘤细胞胞质内可见空泡形成,肿瘤间质可见散在炎症细胞[4-8]。免疫组化有助于确定其内皮细胞分化,肿瘤细胞上皮标记物CK(AE1/AE3)、CAM5.2、EMA及血管内皮细胞标记物CD31、FⅧα和FLi-1不同组合表达阳性,INI-1蛋白呈完整表达无缺失且CD34(-)。病理诊断PHE/ES-HE须组织形态学结合免疫组化综合判断[8,14]。
细胞分子遗传学方面,Hung[11]及Wahher[15]等的报道显示,t(7;19)(q22;q13)可形成SERPINEl-FOSB融合性基因。该融合性基因是PHE/ES-HE肿瘤组织的一个稳定基因变异,较少出现于其它软组织或骨肿瘤中,对PHE/ES-HE的诊断具有较高特异性。
3.影像学表现
本组6例骨原发PHE/ES-HE共31个骨骼病灶,其共同影像学表现为溶骨性骨质破坏,边界清楚,增强后病灶明显强化,与文献报道相符[10-12]。边界清楚的溶骨性骨质破坏,主要是由于骨假肌源性(上皮样肉瘤样)血管内皮瘤在骨内生长较慢、病程较长、侵袭性较低;而病灶强化明显则符合其血管源性肿瘤的特征。
骨原发PHE/ES-HE的影像表现既有共同特征,单发与多发病灶又各具特点。本组半数病例为多发病灶,一例患者所有病灶均位于同一骨,2例患者病灶分布于不同骨,骨质破坏的形态多为类圆形,中心性或偏心性生长,可位于骨皮质和骨髓腔。多个小病灶可相互融合成较大病灶。大部分病灶内密度及信号较均匀,无骨膜反应及软组织肿块,与文献报道[9-12]相近。本组病例骨多发病灶均无突破骨皮质形成软组织肿块,笔者推测是因为多发病灶者在病灶较小时临床症状相对单发者明显,容易早期发现,而骨单发病灶者在病变突破骨皮质前症状多不明显,难以早期发现,直至病变突破骨皮质形成软组织肿块才就诊发现。本组中3例单发病灶患者即因为软组织肿块来诊,病史分别为2、4和5年,说明单发病灶者临床症状较轻,肿瘤进展较慢,亦符合其中间型的分类特点。本组单发病灶影像表现较复杂,骨质破坏常不规则,边缘可见硬化边,内部密度、信号不均匀,可出现残存骨嵴、钙化及囊性变,并可突破骨皮质形成软组织肿块。文献关于骨PHE/ES-HE单发病灶的影像表现方面的报道极少且均为个案报道,本组病例亦只有3例单发病灶者,其影像表现特征的总结仍有待病例数量的积累。
4.鉴别诊断
由于对本病的认识不足,骨原发PHE/ES-HE常被误诊为恶性骨肿瘤或发育异常疾病。本组6例术前影像学检查均误诊。
多发病灶者临床及影像学上需与以下疾病鉴别。①多发性骨髓瘤:发病年龄较大,好发于中轴骨,四肢骨较少,全身骨痛症状明显,尿本周氏蛋白多呈阳性。影像表现为骨质疏松背景下的虫噬样、穿凿状骨质破坏区,少有硬化边及骨膜反应。影像上骨PHE/ES-HE多发病灶与骨髓瘤鉴别有一定难度[13],本组2例误诊为该病。②转移瘤:多有原发肿瘤病史,骨痛症状明显;骨质破坏区边缘模糊。由于本组3例多发病灶患者均无原发肿瘤病史,因此没有误诊为转移瘤者。③纤维结构不良:可单发或多发,骨质破坏区多表现为毛玻璃样改变,常伴有骨形态改变,因其成分为纤维组织、骨及软骨组织,T1WI多呈低信号,T2WI信号多样,多无硬化边。骨PHE/ES-HE可继发于纤维结构不良[16],本组1例患者即误诊为该病。
单发病灶者临床及影像学上需与以下疾病鉴别。①骨巨细胞瘤,发好于青壮年长骨骨端,偏心性膨胀性骨质破坏,边界清晰,无硬化边,侵袭性骨巨细胞瘤可突破皮质形成软组织肿块,本组2例单发病灶者误诊为该病。回顾这2例骨PHE/ES-HE的影像资料,笔者认为PHE/ES-HE骨质破坏区周围明显的硬化边可资鉴别。②上皮样血管内皮瘤:临床少见的恶性血管源性肿瘤,文献报道可出现类似骨PHE/ES-HE的影像表现[17,18],常需活检病理发现空泡细胞等原始血管形成依据以及CD34(+)鉴别[6-7]。本组1例单发病灶者误诊为该病。③上皮样血管肉瘤:表现为蜂窝状或“洞中洞”征象,一般为纯溶骨性破坏而边缘模糊不清,有些表现为溶骨与硬化的混合型,纯粹的硬化病变少见,骨内膜的侵蚀、皮质破坏和肿瘤向骨外延伸较常见,部分可见放射状骨针和明显的软组织肿块[19]。
总之,40岁以下的男性、下肢骨溶骨性骨质破坏、边界清楚、显著强化是骨原发PHE/ES-HE的临床及影像学特征,但是本病的术前影像学诊断困难,需与多发性骨髓瘤和骨巨细胞瘤等疾病相鉴别。
参考文献:
[1] Billings SD,Folpe AL,Weiss SW.Epithelioid sareoma-like haemangioendothelioma[J].Am J Surg Pathol,2003,27(1):48-57.
[2] Hornick JL,Fletcher CD.Pseudomyogenic hemangioendothelioma:a distinctive,often multicentric tumor with indolent behavior[J].Am J Surg Pathol,2011,35(2):190-201.
[3] Fletcher CDM,Bridge JA,Hogendoorn PCW,et al.World Health Organization classification of soft tissue and bone tumours[M].Lyon:IARC Press,2013:153-154.
[4] 蔡俊娜,彭芳,李里香,等.上皮样肉瘤样血管内皮瘤的临床病理学观察[J].中华病理学杂志,2011,40(1):27-31.
[5] 汪庆余,郝华,刘绮颖,等.假肌源性血管内皮瘤6例临床病理分析[J].临床与实验病理学杂志,2014,30(10):1122-1126.
[6] 李红霞,范钦和,张智,等.上皮样肉瘤样血管内皮瘤临床病理分析[J].中华病理学杂志,2012,41(11):767-768.
[7] Inyang A,Mertens F,Puls A,et al.Primary pseudomyogenic hemangioendothelioma of bone[J].Am J Surg Pathol,2016,40(5):587-598.
[8] 汪庆余,郝华,雷浪,等.假肌源性(上皮样肉瘤样)血管内皮瘤2例临床病理观察[J].诊断病理学杂志,2015,22(6):354-357.
[9] Amary MF,O'Donnell P,Berisha F,et al.Pseudomyogenic (epithelioid sarcoma-like) hemangioendothelioma:charaeterization of five cases[J].Skeletal Radiol,2013,42(7):947-957.
[10] McGinity M,Bartanusz V,Dengler B.Pseudomyogenic hemangioendothelioma (epithelioid sar rcoma-like hemangioendothelioma,fibroma-like variant of epithelioid sarcoma) of the thoracic spine[J].Eur spine J,2013,22(3):506-511.
[11] Hung YP,Fletcher CD,Hornick JL.FOSB is a useful diagnostic marker for pseudomyogenic hemangioendothelioma[J].Am J Surg Pathol,2017,1(5):596-606.
[12] Sheng WQ,Wang J.Primary pseudomyogenic hemangioendothelioma of bone[J].Histopathology,2012,61(6):1219-1224.
[13] Bryanton M,Makis W.Pseudomyogenic hemangioendothelioma mimicking multiple myeloma on18F-FDG PET/CT,followed by spontaneous regression[J].Clin Nucl Medic,2015,40(7):579-581.
[14] Cacciatore M,Dei Tos AP.Challenging epithelioid mesenehymal neoplasms:mimics and traps[J].Pathology,2014,46(2):126-134.
[15] Walther C,Tayebwa J,Lilijebjrn H,et al.A novel SERPINEI-FOSB fusion gene results in transcriptional up-regulation of FOSB in pseudomyogenic hemangioendothelioma[J].J Pathol,2014,232(5):534-540.
[16] Ye C,Yu X,Zeng J,et al.Pseudomyogenic hemangioendothelioma secondary to fibrous dysplasia of the left lower extremity in a 14-year-old female:a case report[J].World J Surg Oncol,2016,14(1):198-202.
[17] 张立华,袁慧书.脊柱恶性血管源性肿瘤的影像表现及鉴别诊断[J].放射学实践,2015,30(4):373-377.
[18] 徐凌斌,徐雷鸣,董海波,等.骨上皮样血管内皮瘤的影像特征[J].中华放射学杂志,2014,48(2):158-160.
[19] 唐浩,胡桂周,邹丹凤,等.四肢原发性血管源性恶性肿瘤的影像学表现[J].放射学实践,2014,29(9):1079-1083.
