肺磨玻璃样结节:有助于预判肺腺癌浸润性的CT征象
2018-05-04赵娇李建华费佳李凤黎佳维伍建林
赵娇, 李建华, 费佳, 李凤, 黎佳维, 伍建林
胸部CT扫描对肺部磨玻璃样结节(ground glass nodule,GGN)的检出率越来越高,尽管对其CT诊断和鉴别诊断已有较多的研究和报道,但广大患者仍处于不安和惊恐之中,部分原因是被检出的GGN大部分被证实为肺腺癌。实际上,目前被CT检出且经手术确诊的呈GGN表现的肺腺癌中很大比例属于浸润前病变,其手术治愈率接近100%[1-4]。因此,如果术前依据CT征象能预估GGN的浸润性,将对指导治疗、评估患者的预后及缓解患者的心理压力产生重要影响。目前,基于CT征象对直径≤3.0 cm的肺GGN进行浸润性预判的相关研究相对较少。笔者对经病理证实的176例GGN患者的病例资料进行回顾性分析,旨在提取有助于预判和区分肺腺癌浸润性的CT征象。
材料与方法
1.一般资料
搜集本院2013年1月-2017年6月经手术病理证实的176例肺部GGN患者的病例资料。依据最新国际肺腺癌分类标准[5], 67例为浸润前病变,包括不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)11例、原位腺癌(adenocarcinoma in situ,AIS)56例;111例为浸润性病变,包括微浸润腺癌(minimally invasive adenocarcinoma,MIA)40例和浸润性腺癌(invasive adenocarcinoma,IA)69例。67例浸润前病变中,男16例,女51例,年龄33~74岁,平均(54.58±9.35)岁;40例MIA中,男13例,女27例,年龄36~76岁,平均(54.65±8.84)岁;69例IA中,男22例,女47例,年龄30~79岁,平均(58.99±11.25)岁。依据有关文献及病变的生物学行为[6-8],本研究中将浸润前病变和MIA归为非浸润性腺癌组,共计107例。主要临床表现:咳嗽、咳痰47例,胸痛或不适35例,咯血8例,体检或意外发现86例。
入组标准:①经手术病理证实;②术前2周内行MSCT检查和1 mm层厚的薄层重建;③病灶最大直径≤3 cm、且磨玻璃成分≥50%;④术前未接受穿刺活检或放化疗;⑤术后病理组织学诊断依据为2015年肺腺癌多学科新分类标准[5]。
2.CT检查
使用Siemens Somatom Definition双源CT机或Somatom Definition AS 64层CT机行常规扫描。患者均采取仰卧位,扫描范围自胸腔入口至肋膈角下方,扫描参数:80~120 kV,200~280 mA,层厚5.0~7.0 mm,层间隔5.0 mm,矩阵512×512。扫描结束后将原始图像采用1.0 mm层厚进行薄层重建。图像观察条件:肺窗窗宽1600~2000 HU,窗位-800~-600 HU;纵隔窗窗宽250~350 HU,窗位30~50 HU;必要时根据病灶的直径和密度调整至合适的窗宽和窗位。
3.CT征象评价
由2位有10年以上工作经验的高年资胸部影像医师采用双盲法分别阅片,意见不一致时经讨论协商后取得一致意见。主要评估内容如下。①病变部位:分析至肺叶水平;②形态学特点:边缘情况(清晰/光滑、分叶征、毛刺征)、血管集束征、胸膜凹陷征、内部空泡或空腔和空气支气管征;③病灶直径:取病灶最大层面,测量病灶最大直径及其垂直径线的长度,以两者的平均值作为病灶直径;④CT值测量:取病灶最大层面,在不同位置勾画ROI测量病灶的CT值,ROI的范围应至少包含病灶2/3的区域,测量2次取平均值,测量时应避开血管及支气管;⑤计算病灶的相对CT值:病灶最大层面的平均CT值与同层面正常肺组织的平均CT值之比。
4.统计学分析
使用SPSS 22.0软件包进行统计学分析。计数资料采用χ2或Fisher检验,计量资料比较采用t检验。对变量进行单因素方差分析,筛选出具有统计学差异(P<0.05)的指标,然后进行二元Logistic回归分析,根据分析结果绘制该指标的ROC曲线,确定鉴别诊断的最佳临界值。
结 果
1.一般资料
本研究中非IA组与IA组间患者性别构成的差异无统计学意义(P>0.05 )。非IA组和IA组患者的平均年龄分别为(54.61±9.12)和(58.99±11.25)岁,两组间差异有统计学意义(P=0.005)。
2.两组GGNs的CT征象比较
两组GGN的主要CT征象及统计分析结果见表1。在发病部位上,176例GGN中位于右上肺69例(39.2%),右中肺14例(8.0%),右下肺29例(16.5%),左上肺42例(23.9%),左下肺22例(12.5%)。IA组和非IA组间病灶分布的差异无统计学意义(P>0.05)。本研究中纯磨玻璃结节(pGGN)117例(66.5%),混合磨玻璃结节(mGGN)59例(33.5%);非浸润腺癌组大多表现为pGGN(89.7%),IA组大多表现为mGGN(69.6%),两组间在GGN类型上的差异有高度统计学意义(P<0.001)。在形态学上,分叶、毛刺、胸膜凹陷征及空气支气管征在IA组中的出现率大于非浸润腺癌组(图1~3),差异均有统计学意义(P<0.05);而血管集束征、空泡或空腔征的出现率在两组间的差异无统计学意义(P>0.05)。

表1 两组GGN的主要CT征象及比较
注:括号内数据为组内构成比。
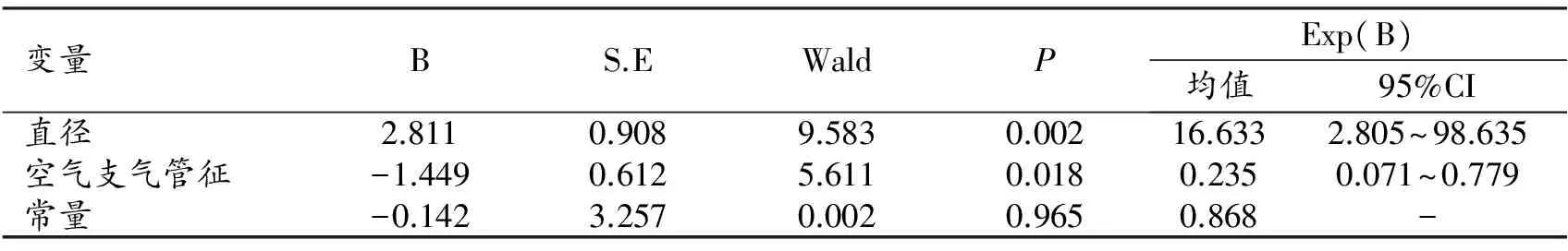
表2 GGN病灶CT征象的二元Logistic回归分析
IA组病灶的平均直径和CT值均大于非IA组,组间差异均有明显统计学意义(P<0.001);IA组病灶的相对CT值小于非IA组,差异有统计学意义(P<0.001)。
3.GGN浸润性相关因素的评估
将腺癌的浸润性作为因变量,患者的年龄、GGN类型、病灶边缘形态、胸膜凹陷征、空气支气管征、病灶直径、CT值和相对CT值设协变量,进行二元Logistic回归分析(表2),结果显示:病灶直径及空气支气管征为鉴别和预判GGN是否具有浸润性的重要因素。
ROC曲线分析结果显示,以GGN直径≥1.28 cm作为诊断IA的阈值,诊断敏感度为81.3%,特异度为60.9%,曲线下面积为0.813(图4)。
讨 论
病理研究中发现肺部浸润前病变和MIA通常沿肺泡壁生长,肺泡结构多未受破坏[9-11],在CT上表现为pGGN,但并不是所有的pGGN均为浸润前病变或MIA。本研究中即有30.4%的pGGN病理证实为浸润性腺癌(IA)。而在Wilshire等[12]的研究中,42.8%的pGGN证实为IA,因此并不能依据GGN病变的均匀程度来判断其浸润程度。当然,随着病灶内部浸润性成分的增加,在CT上相应表现为mGGN[13]。但从磨玻璃成分至实性成分之间的变化是一个动态演变过程,在临床工作中,有时两者之间很难给出明确的界限,因此,除分析GGN的密度特征 之外,深入探究其它有价值的征象十分必要。
本研究中单因素方差分析发现,GGN浸润程度与其部分形态学CT表现相关,包括病灶边缘特征、胸膜凹陷征及空气支气管征等。Furuya等[14]认为GGN病灶边缘征象可反映其潜在的病理性质,其中分叶征系由于病灶各部生长速度不均所致,毛刺征则是肿瘤向支气管、血管或小叶间隔浸润而形成,如病灶边缘出现分叶、毛刺征常提示其恶性程度较高[15-16]。本研究中,IA组分叶和毛刺征的出现率明显多于非浸润腺癌组(P<0.001),也进一步证实了上述学者的观点。此外,胸膜凹陷征也是判断病变良恶性的重要征象,其病理学机制可能由于病灶内部的纤维组织收缩引起[17-18]。本研究中有53.6%的IA病灶可见胸膜凹陷征,与既往的研究结果基本一致[19]。值得注意的是,有研究表明空气支气管征无助于鉴别非浸润腺癌及IA[20];但最近的一项研究发现,IA中出现空气支气管征的概率较非浸润腺癌增高[21];本研究也得出相似的结论,说明该征象在IA与非IA的鉴别诊断中具有潜在的重要价值。

图1 AIS。a) 高分辨力CT示左肺下叶pGGN(箭),平均直径1.13cm,CT值-735.89HU,边缘清晰,紧邻胸膜,可见血管集束征; b) 镜下示肿瘤大部分区域肺泡结构完整,肺泡间隔增宽,异型的肺泡上皮细胞沿肺泡壁贴壁生长,无间质及血管浸润(HE,×100)。 图2 MIA。a) 高分辨力CT示右肺上叶mGGN(箭),平均直径1.62cm,CT值-721.72HU,边缘清晰,有分叶征,可见血管集束征与空腔影; b) 镜下示大量肺泡呈钉突样生长,部分肺泡内陷在纤维组织内,肺泡上皮细胞密集,有一定的异型性,在间质内浸润生长(HE,×100)。 图3 IA。a) 高分辨力CT示右肺中叶mGGN(箭),平均直径2.19cm,CT值-635.16HU,边缘清晰,其内可见空气支气管征,周边见血管集束征、胸膜凹陷征; b) 镜下示腺泡样结构排列紊乱,细胞密集,有明显异形性,间质纤维组织增生明显(HE,×100)。

图4 GGN直径预测浸润性腺癌的ROC曲线,曲线下面积为0.813。
本研究定量分析还发现,GGN病灶直径、CT值、相对CT值与患者年龄在预测GGN的浸润程度中具有较好的诊断价值。病灶直径是评估肿瘤T分期的关键指标,通常越大分期越晚,IA可能性越大。本研究中也证实IA组直径明显大于非浸润腺癌组,与相关报道一致[22]。CT值也是评估GGN病理性浸润的预测因素,随着病变浸润程度的增加,肿瘤细胞与肿瘤组织密集度上升,肿瘤性肺泡腔内脱落细胞积聚增多,空气含量逐渐减少,CT值也逐渐增高[23,24]。在Lim等[25]研究中,非浸润腺癌平均CT值[(-626±84.4) HU]明显低于IA[(-507±109.1) HU]。本研究结果也与上述研究一致;同时,为减少不同个体间吸气程度影响,本研究还测量了相对CT值,该研究表明IA的相对CT值小于非浸润腺癌组(0.63±0.11 vs 0.72±0.10),差异有统计学意义(P<0.001)。尽管如此,CT值测量仍受病灶血管及支气管等影响,虽然针对病灶最大层面进行测量,但也并不能真实反映病灶整体CT值,仍有待于深入研究。此外,本研究发现IA患者的年龄较非浸润腺癌组大,提示年龄也是预测IA的危险因素之一。
本研究将单因素分析结果中有统计学意义的变量进行二元Logistic回归分析,但仅发现病灶直径及空气支气管征是预测GGN浸润程度的重要危险因素,其它变量的差异虽无统计学意义,但并不能说明其对肿瘤浸润程度的评估无价值。在Lee等[19]的研究中指出,分叶征及胸膜凹陷征是预测肺腺癌浸润程度的重要征象。而在另一项纳入101例GGN的研究中,则认为大小和CT值联合评估对预测肺腺癌的浸润程度有重要作用[26]。本研究ROC曲线表明鉴别非浸润腺癌及IA直径的最佳临界值为1.28 cm,这为日后的临床诊断提供一定的参考依据,但本研究样本量较少,选取数据上可能存在偏倚。此外,空气支气管征也是鉴别非浸润腺癌与IA的有价值征象,且随肺GGN浸润程度的增加而出现比例相应增加,与既往研究一致[27,28]。
综上所述,对GGN的CT表现进行科学分析和比较研究可以发现一些有助于预测其浸润程度的征象,本研究中发现GGN的直径及空气支气管征是预测IA的危险因素,其他征象也应全面分析与综合考虑,为患者GGN精准诊断和术前预测评估提供充分的影像学依据。
参考文献:
[1] Yanagawa N,Shiono S,Abiko M,et al.The correlation of the international association for the study of lung cancer (iaslc)/american thoracic society (ats)/european respiratory society (ers) classification with prognosis and egfr mutation in lung adenocarcinoma[J].Ann Thorac Surg,2014,98(2):453-458.
[2] Kadota K,Villena-Vargas J,Yoshizawa A,et al.Prognostic significance of adenocarcinoma in situ,minimally invasive adenocarcinoma,and nonmucinous lepidic predominant invasive adenocarcinoma of the lung in patients with stage I disease[J].Am J Surg Pathol,2014,38(4):448-460.
[3] Eguchi T,Kadota K,Park B J,et al.The new iaslc-ats-ers lung adenocarcinoma classification:what the surgeon should know[J].Semin Thorac Cardiovasc Surg,2014,26(3):210-222.
[4] Cho JH,Choi YS,Kim J,et al.Long-term outcomes of wedge resection for pulmonary ground-glass opacity nodules[J].Ann Thorac Surg,2015,99(1):218-222.
[5] Travis WD,Brambilla E,Nicholson AG,et al.The 2015 world health organization classification of lung tumors:impact of gene-tic,clinical and radiologic advances since the 2004 classification[J].J Thorac Oncol,2015,10(9):1243-1260.
[6] Tsutani Y,Miyata Y,Nakayama H,et al.Prediction of pathologic node-negative clinical stage ia lung adenocarcinoma for optimal candidates undergoing sublobar resection[J].J Thorac Cardiovasc Surg,2012,144(6):1365-1371.
[7] Allen MS,Darling GE,Pechet TT,et al.Morbidity and mortality of major pulmonary resections in patients with early-stage lung cancer:initial results of the randomized,prospective acosog z0030 trial[J].Ann Thorac Surg,2006,81(3):1013-1019;discussion 1019-1020.
[8] Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic society/european respiratory society:international multidisciplinary classification of lung adenocarcinoma:executive summary[J].Proc Am Thorac Soc,2011,8(5):381-385.
[9] Lederlin M,Puderbach M,Muley T,et al.Correlation of radio- and histomorphological pattern of pulmonary adenocarcinoma[J].Eur Respir J,2013,41(4):943-951.
[10] Lee SW,Leem CS,Kim TJ,et al.The long-term course of ground-glass opacities detected on thin-section computed tomography[J].Respir Med,2013,107(6):904-910.
[11] 陈群慧,叶晓丹,朱莉,等.肺孤立性磨玻璃密度结节的超高分辨力CT表现及与病理的相关性[J].放射学实践,2014,29(1):57-60.
[12] Wilshire CL,Louie BE,Manning KA,et al.Radiologic evaluation of small lepidic adenocarcinomas to guide decision making in surgical resection[J].Ann Thorac Surg,2015,100(3):979-988.
[13] Kodama K,Higashiyama M,Yokouchi H,et al.Prognostic value of ground-glass opacity found in small lung adenocarcinoma on high-resolution ct scanning[J].Lung Cancer,2001,33(1):17-25.
[14] Furuya K,Murayama S,Soeda H,et al.New classification of small pulmonary nodules by margin characteristics on high-resolution CT[J].Acta Radiol,1999,40(5):496-504.
[15] Nambu A,Araki T,Taguchi Y,et al.Focal area of ground-glass opacity and ground-glass opacity predominance on thin-section CT:Discrimination between neoplastic and non-neoplastic lesions[J].Clin Radiol,2005,60(9):1006-1017.
[16] Nakajima R,Yokose T,Kakinuma R,et al.Localized pure ground-glass opacity on high-resolution CT:Histologic characteristics[J].J Comput Assist Tomogr,2002,26(3):323-329.
[17] Winer-Muram HT.The solitary pulmonary nodule[J].Radiology,2006,239(1):34-49.
[18] Fan L,Liu SY,Li QC,et al.Multidetector CT features of pulmonary focal ground-glass opacity:differences between benign and malignant[J].Br J Radiol,2012,85(1015):897-904.
[19] Lee SM,Park CM,Goo JM,et al.Invasive pulmonary adenocarcinomas versus preinvasive lesions appearing as ground-glass nodules:differentiation by using ct features[J].Radiology,2013,268(1):265-273.
[20] Kim HY,Shim YM,Lee KS,et al.Persistent pulmonary nodular ground-glass opacity at thin-section CT:histopathologic comparisons[J].Radiology,2007,245(1):267-275.
[21] Si MJ,Tao XF,Du GY,et al.Thin-section computed tomography-histopathologic comparisons of pulmonary focal interstitial fibrosis,atypical adenomatous hyperplasia,adenocarcinoma in situ,and minimally invasive adenocarcinoma with pure ground-glass opacity[J].Eur J Radiol,2016,85(10):1708-1715.
[22] Moon Y,Sung SW,Lee KY,et al.Pure ground-glass opacity on chest computed tomography:predictive factors for invasive adenocarcinoma[J].J Thorac Dis,2016,8(7):1561-1570.
[23] Zhang L,Yankelevitz DF,Carter D,et al.Internal growth of nonsolid lung nodules:radiologic-pathologic correlation[J].Radiology,2012,263(1):279-286.
[24] Jung JI,Kim H,Park SH,et al.CT differentiation of pneumonic-type bronchioloalveolar cell carcinoma and infectious pneumonia[J].Br J Radiol,2001,74(882):490-494.
[25] Lim HJ,Ahn S,Lee KS,et al.Persistent pure ground-glass opa-city lung nodules ≥10mm in diameter at CT scan:histopathologic comparisons and prognostic implications[J].Chest,2013,144(4):1291-1299.
[26] Eguchi T,Yoshizawa A,Kawakami S,et al.Tumor size and computed tomography attenuation of pulmonary pure ground-glass nodules are useful for predicting pathological invasiveness[J].PLoS One,2014,9(5):e97867.
[27] Kim TJ,Goo JM,Lee KW,et al.Clinical,pathological and thin-section CT features of persistent multiple ground-glass opacity nodules:comparison with solitary ground-glass opacity nodule[J].Lung Cancer,2009,64(2):171-178.
[28] Lim HJ,Ahn S,Lee KS,et al.Persistent pure ground-glass opa-city lung nodules ≥10mm in diameter at CT scan:histopathologic comparisons and prognostic implications[J].Chest,2013,144(4):1291-1299.
